CDK5介导的PPARγ磷酸化在动脉粥样硬化泡沫细胞形成过程中的作用
2019-11-06沈娜贺晶邸研博刘勇田凤石刘运德
沈娜,贺晶,邸研博,刘勇,田凤石,刘运德
动脉粥样硬化(Atherosclerosis,AS)是心血管疾病的病理基础,单核/巨噬细胞在其发生发展过程中发挥重要作用。单核/巨噬细胞泡沫化是AS发生发展的标志,细胞内脂质聚积,胆固醇外流减少,促进了泡沫细胞形成[1]。过氧化物酶体增殖物激活受体γ(Peroxisome proliferator-activated receptor gamma,PPARγ)属于核受体超家族中一员,在糖尿病、肥胖和心血管疾病等代谢性疾病中都具有重要意义,PPARγ除了高表达于脂肪组织外,还可表达于血管及动脉粥样斑块中的单核/巨噬细胞内[2]。研究显示,PPARγ可通过调节巨噬细胞清道夫受体CD36、清道夫受体A1(Scavenger receptor A1,SR-A1)和胆固醇外流基因三磷酸腺苷结合盒转运体A1(ATP binding cassette transporter A1,ABCA1)、三磷酸腺苷结合盒转运体G1(ATP binding cassette transporter G1,ABCG1)影响泡沫细胞形成[3-4],但其机制尚待明确。细胞周期素依赖蛋白激酶5(Cyclin-dependent kinase 5,CDK5)持续激活可使PPARγ磷酸化,进而导致肥胖相关的脂代谢异常[5],而此作用是否参与AS形成过程中单核/巨噬细胞内脂质变化仍不清楚。本研究旨在通过观察CDK5介导的PPARγ磷酸化对泡沫细胞形成的影响,探讨CDK5/pPPARγ途径在AS中的作用和机制。
1 材料与方法
1.1实验材料 小鼠Raw264.7巨噬细胞购自中国科学院上海细胞库;DMEM培养基、标准胎牛血清、胰蛋白酶均购自美国Gibco公司;氧化低密度脂蛋白(Oxidized low density lipoprotein,ox-LDL)购自广州奕元生物技术有限公司;Roscovitine(一种CDK抑制剂)、油红O、BCA蛋白定量检测试剂盒购自美国Sigma公司;总胆固醇和游离胆固醇测定试剂盒购自北京普利莱基因技术有限公司;兔抗pPPARγ购自北京博奥森生物技术有限公司;兔抗tPPARγ、p35、CDK5及鼠抗β-actin均购自英国Abcam公司;辣根过氧化物酶标记的羊抗兔、羊抗鼠IgG购自北京索莱宝公司;总RNA提取试剂盒购自美国Qiagen公司、反转录PCR(Reverse transcription PCR,RT-PCR)试剂盒购自日本Takara公司;引物由上海生工生物工程股份有限公司合成;二氧化碳培养箱、紫外分光光度计均购自美国Thermo Fisher公司;酶标仪购自瑞士Tecan公司;PCR仪、电泳转印系统、凝胶成像分析仪均购自美国Bio-Rad公司。
1.2方法
1.2.1细胞培养与分组 用含10%胎牛血清的DMEM培养基培养Raw264.7巨噬细胞,待细胞生长至对数期,消化细胞为单个细胞,铺于6孔板中,每孔5×105个细胞。将细胞分为3组(每组3个复孔),即对照组(C组)、ox-LDL组(50 mg/L ox-LDL,O 组)、Roscovitine+ox-LDL组(15µmol/L Roscovitine+50 mg/L ox-LDL,R组)。待细胞融合至70%左右,R组加入15µmol/L Roscovitine预处理30 min,之后O组和R组分别加入50 mg/L ox-LDL继续培养24 h,使其转化为泡沫细胞;C组不作处理。
1.2.2Western blot检测pPPARγ、tPPARγ、p35和CDK5蛋白的表达 每孔收集1×106个细胞,加入适量裂解液裂解,BCA法测定各组蛋白含量;将处理好的样品以30µg/孔加到SDSPAGE胶孔中,恒压80 V电泳,当Marker开始分离时,将电压调至120 V,湿转法恒压90 V冰浴转膜1 h,室温封闭1 h,一抗(兔抗pPPARγ,1∶1 000;兔抗tPPARγ,1∶1 000;兔抗p35,1∶1 000;兔抗CDK5,1∶2 000;鼠抗β-actin,1∶10 000)4 ℃过夜,二抗(1∶10 000)室温孵育45 min,ECL法显影,显色后置于凝胶成像仪中成像,采用β-actin作为内参,利用Image Lab软件对各组蛋白条带的灰度值进行分析。
1.2.3油红O染色 使用油红O对C组、O组、R组转化成熟的Raw264.7细胞进行染色,吸净培养基,PBS洗1次;4%多聚甲醛固定30 min,PBS洗3次;每孔加1 mL油红O工作液,37℃孵育30 min,弃去油红O,PBS洗3次,于显微镜下观察各组细胞染色情况并拍照。随后每孔加入200µL异丙醇抽提油红O,使用紫外分光光度计测定358 nm处OD值。
1.2.4细胞内胆固醇含量的检测 收集3组分化成熟的Raw264.7细胞,分别加入150µL裂解液,混匀后,静置10 min,室温2 000×g,离心5 min,取上清液备用。BCA法对各组蛋白进行定量检测,剩余样品用于检测细胞总胆固醇(TC)、游离胆固醇(FC)、胆固醇酯(CE)含量并计算CE/TC,CE/TC>0.5表明泡沫细胞转化成功。取190µL工作液加到96孔板中,之后分别加入标准品、待测样品各10µL,37℃孵育20 min,于酶标仪检测各孔OD值,绘制标准曲线并计算浓度,以每毫克蛋白浓度校正胆固醇含量。
1.2.5RT-PCR检测摄取相关基因CD36、SR-A1和外流相关基因ABCA1、ABCG1的表达 细胞诱导成熟后,按照试剂盒说明书提取各组总RNA,并反转录为cDNA,按以下体系进行PCR反应:总体积25µL,10×Taq buffer 2.5µL,dNTP mix 2.5µL,上下游引物各1µL,cDNA模板1µL,RNase-free water补足至25µL。反应条件:95℃预变性5 min;95℃变性30 s,55℃退火30 s,72℃延伸40 s,共35个循环;72℃延伸7 min,最后4℃维持。反应结束后,将产物进行琼脂糖凝胶电泳,于凝胶成像仪中成像,采用β-actin作为内参,利用Image Lab软件对各组条带的灰度值进行分析,见表1。

Tab.1 Primers for RT-PCR表1 RT-PCR引物
1.3统计学方法 采用SPSS 16.0统计软件进行分析,符合正态分布的计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较行LSD-t检验,P<0.05为差异具有统计学意义。
2 结果
2.1CDK5介导的PPARγ磷酸化在ox-LDL诱导的Raw264.7巨噬细胞中的作用 Western blot结果显示,ox-LDL诱导后,O组pPPARγ/tPPARγ和p35/CDK5比值较C组明显升高;加入CDK5抑制剂后,R组pPPARγ/tPPARγ和p35/CDK5比值较O组显著降低,差异均有统计学意义(P<0.05),见图1、表2。
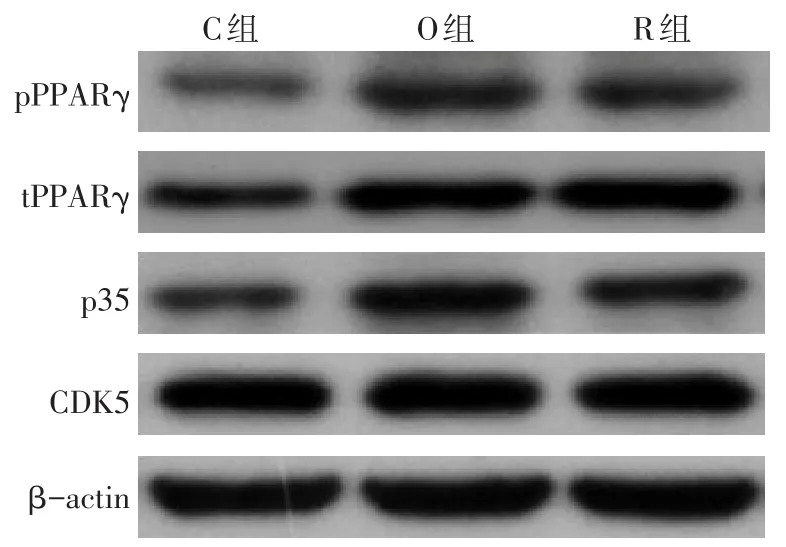
Fig.1 Role of CDK5-mediated PPARγ phosphorylation in ox-LDL-induced Raw264.7 macrophages图1 CDK5介导的PPARγ磷酸化在ox-LDL诱导的Raw264.7巨噬细胞中的作用
Tab.2 Role of CDK5-mediated PPARγ phosphorylation in ox-LDL-induced Raw264.7 macrophages表2 CDK5介导的PPARγ磷酸化在ox-LDL诱导的Raw264.7巨噬细胞中的作用 (n=3,±s)

Tab.2 Role of CDK5-mediated PPARγ phosphorylation in ox-LDL-induced Raw264.7 macrophages表2 CDK5介导的PPARγ磷酸化在ox-LDL诱导的Raw264.7巨噬细胞中的作用 (n=3,±s)
*P<0.05,**P<0.01;a与C组比较,b与O组比较,P<0.05
组别pPPARγ/tPPARγp35/CDK5 C组O组R组F 0.30±011 0.52±0.10a 0.24±0.10b 6.206*0.49±0.07 1.06±0.21a 0.64±0.13b 11.731**
2.2泡沫细胞形成情况 油红O染色结果显示,O组脂质聚积较C组明显增多(OD值:0.37±0.05vs.0.21±0.02),R组脂质聚积较O组减轻(0.25±0.03vs.0.37±0.05),差异均有统计学意义(n=3,F=21.237,P<0.01),见图2。细胞内胆固醇含量检测结果显示,O组TC、FC、CE和CE/TC比值较C组升高,R组TC、FC、CE和CE/TC比值较O组降低,差异均有统计学意义(P<0.05),见表3。

Fig.2 Effects of CDK5 inhibitor on lipid accumulation in ox-LDL-induced Raw264.7 macrophages(Oil red O staining,×400)图2 CDK5抑制剂对ox-LDL诱导的Raw264.7巨噬细胞脂质聚积的影响(油红O染色,×400)
Tab.3 Differences of cholesterol content in Raw264.7 macrophages表3 Raw264.7巨噬细胞内胆固醇含量的变化(n=8,±s)
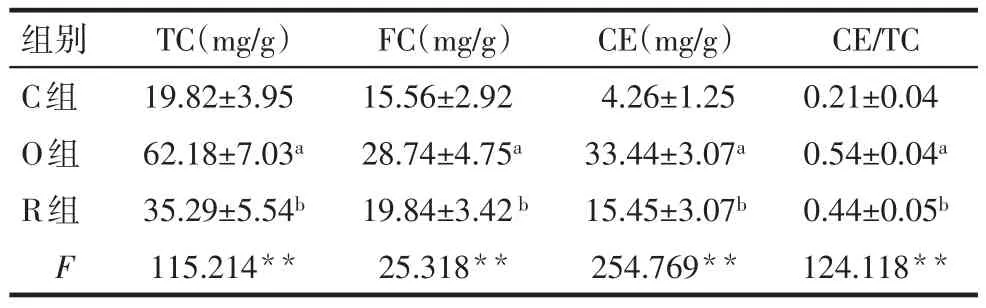
Tab.3 Differences of cholesterol content in Raw264.7 macrophages表3 Raw264.7巨噬细胞内胆固醇含量的变化(n=8,±s)
**P<0.01;a与C组比较,b与O组比较,P<0.05
组别C组O组R组F TC(mg/g)19.82±3.95 62.18±7.03a 35.29±5.54b 115.214**FC(mg/g)15.56±2.92 28.74±4.75a 19.84±3.42b 25.318**CE(mg/g)4.26±1.25 33.44±3.07a 15.45±3.07b 254.769**CE/TC 0.21±0.04 0.54±0.04a 0.44±0.05b 124.118**
2.3脂质代谢相关基因的mRNA的水平 与C组相比,O组ox-LDL摄取相关基因CD36和SR-A1的mRNA表达水平升高,而胆固醇外流相关基因ABCA1和ABCG1的mRNA表达水平降低;加入抑制剂处理后,R组CD36和SR-A1的mRNA表达水平较O组降低,而ABCA1和ABCG1的mRNA表达水平较O组升高,差异均有统计学意义(P<0.05),见图3、表4。

Fig.3 The expression levels of lipid metabolism-related genes图3 脂质代谢相关基因的mRNA表达水平
Tab.4 Expression levels of lipid metabolism-related genes表4 脂质代谢相关基因的mRNA表达水平 (n=3,±s)

Tab.4 Expression levels of lipid metabolism-related genes表4 脂质代谢相关基因的mRNA表达水平 (n=3,±s)
*P<0.05;a与C组比较,b与O组比较,P<0.05
组别C组O组R组F摄取相关基因CD36 0.29±0.08 0.58±0.12a 0.32±0.09b 7.176*SR-A1 0.26±0.11 0.68±0.20a 0.35±0.13b 6.012*外流相关基因ABCA1 0.62±0.10 0.34±0.08a 0.63±0.14b 6.869*ABCG1 0.73±0.15 0.42±0.11a 0.72±0.08b 6.786*
3 讨论
AS是一种多因素引起的脂代谢紊乱性疾病,LDL诱导的细胞内脂质聚积被认为是AS的触发因素,LDL经氧化修饰后被巨噬细胞摄取,大量胆固醇储存于巨噬细胞中,最终形成泡沫细胞[6]。本研究以ox-LDL诱导Raw264.7巨噬细胞,构建泡沫细胞模型,油红O染色结果可见模型组细胞内出现大量红染脂质颗粒,细胞内总胆固醇含量增加,且CE/TC比值>0.5,符合泡沫细胞特点[7],表明泡沫细胞造模成功。
PPARγ是一种配体激活型转录因子,可调控肥胖、脂代谢紊乱、糖尿病、胰岛素抵抗等多种与AS发生相关的危险因素[8],其功能紊乱可导致血管病变,例如 AS和高血压[9]。CDK5是 PPARγ 的上游激酶[10],存在于神经元细胞、角膜上皮细胞、单核细胞等多种类型细胞中,CDK5被p35蛋白或其剪切体p25激活后参与调节机体多种生物学功能[11]。Bai等[12]研究中指出,ApoE-/-缺陷小鼠中p25/CDK5水平明显高于对照组,且使用CDK5抑制剂Roscovitine干预后,动脉粥样硬化斑块面积明显减少,说明CDK5活性升高促进了AS的发生发展。在本课题组前期研究中证实,PPARγ激动剂替米沙坦可降低CDK5激活引起的PPARγ磷酸化,调节脂联素等脂代谢相关基因的表达,起到改善胰岛素抵抗的作用[13-14]。而CDK5介导的PPARγ磷酸化对巨噬细胞和AS的作用尚未明确。本研究观察到ox-LDL刺激后,p35/CDK5和pPPARγ/tPPARγ水平明显升高,CDK5抑制剂干预后,pPPARγ和p35蛋白表达均呈下降趋势,而PPARγ和CDK5蛋白表达并无变化,提示ox-LDL可能通过某种途径上调了p35表达,使CDK5活性升高,进而导致PPARγ磷酸化水平升高。此外,本研究还观察到,巨噬细胞内脂质聚积和细胞内胆固醇浓度的变化与pPPARγ/tPPARγ变化一致,提示PPARγ磷酸化可能诱导了巨噬细胞内脂质代谢紊乱,最终导致泡沫细胞形成。
为了进一步探讨PPARγ磷酸化影响泡沫细胞形成的机制,本研究对比了各组脂质代谢相关基因的表达。清道夫受体CD36和SR-A1在ox-LDL摄取中发挥主要作用[15],其表达升高可促进巨噬细胞对ox-LDL摄取,使细胞内胆固醇生成增加,促进泡沫细胞形成。高脂喂养的ApoE-/-小鼠的主动脉斑块及ox-LDL诱导的巨噬细胞内CD36和SR-A1水平均明显上升,证实二者的存在促进了AS发生[16-17]。ATP结合盒转运蛋白ABCA1和ABCG1是调控巨噬细胞内胆固醇流出的主要蛋白,参与胆固醇逆向转运过程,促进巨噬细胞内游离胆固醇流至高密度脂蛋白颗粒及载脂蛋白A1,延缓AS进程[18]。ABCA1和ABCG1功能障碍或基因表达减少均可导致胆固醇外流受阻,促进AS发生。研究显示,PPARγ激动剂降低了CD36基因的表达[19],增高了ABCA1和ABCG1基因的表达[20],提示 PPARγ激活对AS具有保护作用。本研究发现,在泡沫细胞形成过程中,pPPARγ/tPPARγ水平增高,CD36、SR-A1基因表达水平上升,ABCA1和ABCG1基因表达水平下降,在抑制剂影响泡沫细胞形成的过程中,CD36和SR-A1基因表达变化与pPPARγ/tPPARγ水平一致,ABCA1和ABCG1的基因表达水平与pPPARγ/tPPARγ水平呈相反趋势,提示PPARγ磷酸化后,其转录活性可能降低,进而引起上述基因表达失衡,促进泡沫细胞形成。
综上所述,CDK5激活所导致的PPARγ磷酸化可能通过调节ox-LDL摄取和胆固醇外流相关基因的表达,加重巨噬细胞内脂质聚积,促进泡沫细胞形成,加速AS进程。
