用HPLC-MS/MS法考察两种伏立康唑注射剂在大鼠体内的药动学及组织分布情况
2019-11-05王志君陈礼治
王志君,陈礼治,王 卓
(海军军医大学长海医院药学部,上海 200433)
伏立康唑(voriconazole)是在氟康唑的结构基础上合成的三唑类广谱抗真菌药,临床上主要用于治疗由曲霉菌、念珠菌、隐球菌和组织胞浆菌引起的系统性真菌感染,也可用于治疗肝移植术后的侵袭性真菌感染。伏立康唑在水中几乎不溶解,美国辉瑞制药公司研制开发的注射用伏立康唑中采用磺丁基-β-环糊精钠(阴离子型高水溶性环糊精衍生物)包合药物分子,形成非共价复合物,可增加其溶解性,提高药物的稳定性和水溶性。四川美大康华康药业有限公司生产的注射用伏立康唑,采用专用溶媒(乙醇∶丙二醇=1∶1)溶解伏立康唑后,再将溶液加至生理盐水中。伏立康唑的血药浓度测定方法如高效液相色谱-串联质谱法(HPLC-MS/MS)已有文献报道[1-2],同时有深入的药动学研究[3],以及不同辅料对伏立康唑影响的研究[4-5],但伏立康唑氮氧化物的体内药动学研究报道较少[6]。本研究建立了同时测定伏立康唑和伏立康唑氮氧化物的HPLC-MS/MS法,并考察大鼠注射不同溶媒制备的伏立康唑注射剂后,伏立康唑及其代谢物伏立康唑氮氧化物在大鼠体内的组织分布。
1 材料和方法
1.1 仪器 G6410A液质联用仪、Agilent Mass Hunter分析软件[安捷伦科技(中国)有限公司];XW-80A涡旋混合器(上海琪特分析仪器有限公司);5804R低温冷冻离心机(转子型号F45-30-11,离心半径95 mm)、MiniSpin离心机(离心半径60 mm,Eppendorf中国有限公司);AG285电子分析天平、PB-10酸度计(赛多利斯科学仪器北京有限公司);DL-180A超声波清洗器(上海之信仪器有限公司)。
1.2 试剂和药品 伏立康唑对照品(纯度99.2%,批号100862-201402)、氟康唑对照品(纯度99.7%,批号100314-201605)均购自中国食品药品检定研究院;伏立康唑氮氧化物(纯度99.7%,Toronto Research Chemicals Inc.,批号Ch 100314-201605);注射用伏立康唑A(0.1 g/瓶,四川美大康华康药业有限公司,批号18042219,专用溶媒批号18042826);注射用伏立康唑B(0.2 g/瓶,美国辉瑞制药有限公司,批号2521601);甲醇、乙腈(色谱纯,美国Tedia公司);乙酸和乙酸铵等其他试剂均为分析纯;实验用水为二次蒸馏水。
1.3 动物 雄性Wistar大鼠,体质量170~230 g,清洁级,购自海军军医大学实验动物中心[实验动物合格证号:SCXK(苏)2018-0002],饲养温度(23±2) ℃,湿度45%~75%,每12小时交替照明,自由饮水、饮食。
1.4 色谱条件和质谱条件
1.4.1 色谱条件 色谱柱为ACE C18-AR柱(150 mm×4.6 mm,5 μm);流动相为乙腈-0.2%乙酸水溶液(内含20 mmol/L乙酸铵),体积比为80∶20;流速0.5 ml/min;进样量1 μl;柱温40 ℃。
1.4.2 质谱条件 采用电喷雾离子源(ESI);在正离子检测方式下选择多反应监测(MRM)扫描进行二级质谱分析;质谱检测:毛细管电压3.6 kV;雾化器压力206.8 kPa(30 psi);离子源温度100 ℃,干燥气温度350 ℃,干燥气流速10 L/min。用于定量分析中的离子反应:伏立康唑[M+H]+m/z350.2(母离子)→281.0 (子离子),裂解器电压和碰撞能量分别为124 V和12.0 eV;伏立康唑氮氧化物[M+H]+m/z366.1(母离子)→224.0(子离子),其裂解器电压和碰撞能量分别为100 V和8.0 eV;氟康唑[M+H]+m/z307.1(母离子)→220.1(子离子),其裂解器电压和碰撞能量分别为130 V和14.0 eV。
1.5 对照品储备液的制备 称取伏立康唑、伏立康唑氮氧化物和内标氟康唑对照品各10 mg,置于10 ml容量瓶中,用甲醇溶解并定容至刻度,配制成浓度为1 mg/ml的3种对照品储备液,置于4~8 ℃冰箱,备用。
1.6 样品采集
1.6.1 血浆样品 取12只大鼠,以随机数字表法随机分成两组,每组6只,实验前禁食12 h,可自由饮水。按40 mg/kg剂量分别从尾静脉注射A、B两种伏立康唑注射剂[7],于给药前,给药后5、30 min,1、2、4、6、8、12、24 h经眼眶静脉丛取血约0.5 ml,置于肝素化EP管中,604×g离心5 min后取血浆,于-80 ℃保存,备用。
1.6.2 组织样品 取60只大鼠,随机分成两组,每个时间点平行设定3只,实验前禁食12 h,可自由饮水。按40 mg/kg剂量分别从尾静脉注射A、B两种伏立康唑注射剂,于给药前,给药后5、30 min,1、2、4、6、8、12、24 h处死大鼠,取出心脏、肝脏、脾脏、肺、肾脏、脑组织,洗去残余血液,去除多余的结缔组织,用生理盐水清洗干净,滤纸吸干表面水分,称重。
1.7 样品前处理
1.7.1 组织匀浆上清液的制备 精密称取各组织1.0 g,不足1.0 g取全量,加入2 ml生理盐水制备组织匀浆,将组织匀浆以1.13×104×g离心5 min,取上清液,即为组织匀浆上清液,置于-80 ℃低温冰箱备用。
1.7.2 血浆和组织匀浆上清液样品的前处理 取待处理血浆和组织匀浆上清液样本各200 μl,加入甲醇溶液600 μl,振荡2 min,1.13×104×g离心10 min,取200 μl上清液置EP管中,再加入0.2%乙酸溶液(含50 mmol/L乙酸铵)和甲醇溶液(含5 μg/ml内标)各200 μl,涡旋混合20 s,转移至进样瓶,按1.4项下色谱条件和质谱条件进样分析。
1.8 动物行为观察 取12只大鼠,随机分成两组,每组6只,实验前禁食12 h,可自由饮水。按40 mg/kg剂量分别从尾静脉注射A、B两种伏立康唑注射剂,分别于给药后24 h观察动物行为,记录大鼠是否身体残缺、相互攻击或死亡等。
1.9 数据处理 采用Phoenix WinNolin 64(版本8.1.0.3530)数据处理软件的非房室模型,以统计矩法进行药动学参数的计算,采用R软件3.5.1版本做统计学分析,药动学参数的比较采用t检验,组织分布的比较采用配对t检验。
2 结 果
2.1 质谱分析 取伏立康唑对照品溶液(20 μg/ml)、伏立康唑氮氧化物对照品溶液(20 μg/ml)和内标氟康唑溶液(5 μg/ml),进行碎片分析,得到二级质谱扫描图,见图1。
2.2 方法专属性 分别取空白血浆、加入混合对照品的模拟血浆样品和给药后1 h的血浆样品,按1.7项下方法进行前处理,按1.4项的色谱条件和质谱条件检测。结果发现,氟康唑、伏立康唑氮氧化物和伏立康唑的保留时间分别为3.2、3.3和3.9 min,见图2。空白血浆和流动相中干扰组分的响应低于分析物定量下限响应值的20%,并低于内标响应值的5%,表明杂质对3种组分的测定无干扰。

图1 伏立康唑、伏立康唑氮氧化物和氟康唑的二级质谱图Figure 1 Mass spectrograms of voliconazole,voliconazole nitrogen oxides and fluconazoleA:伏立康唑;B:伏立康唑氮氧化物;C:氟康唑
图2 伏立康唑、伏立康唑氮氧化物和氟康唑的HPLC-MS/MS谱图Figure 2 HPLC-MS/MS chromatograms of voriconazole,voriconazole nitrogen oxides and fluconazole A:空白血浆;B:空白血浆+混合对照品溶液;C:血浆样品(给药后1 h);1:伏立康唑氮氧化物;2:伏立康唑;3:氟康唑
2.3 标准曲线的建立 精密吸取大鼠空白血浆,心脏、肝脏、脾脏、肺、肾脏和脑组织的组织匀浆液各200 μl,分别精密加入不同浓度的混合对照品溶液,得到系列对照组织样品,制备含伏立康唑、伏立康唑氮氧化物分别为0.01、0.02、0.05、0.1、0.5、1、2、5、10、20、40 μg/ml的系列对照血浆和组织样品,按1.7项下方法进行前处理,按1.4项的色谱条件和质谱条件检测。以伏立康唑或伏立康唑氮氧化物与内标氟康唑面积的比值(y)对血浆浓度(x)进行线性回归,从而得到线性回归方程。结果表明,所测成分在各自的线性范围内线性关系良好,见表1。

表1 大鼠血浆和组织中伏立康唑和伏立康唑 氮氧化物的线性回归方程Table 1 Linear regression equations of voriconazole and voriconazole nitrogen oxides in rat plasma and tissues (n=11)
2.4 定量限和最低检测限 按照样品处理方法,配制系列不同浓度的血浆样品溶液,进行样品处理后进样分析。以信噪比(S/N)≥10的检测浓度作为定量限,伏立康唑和伏立康唑氮氧化物的定量限分别为0.6和10 ng/ml。以S/N≥3的检测浓度为最低检测限,伏立康唑和伏立康唑氮氧化物的最低检测限分别为0.2和2.5 ng/ml。
2.5 精密度实验和回收率实验
2.5.1 批内回收率和精密度 取200 μl大鼠空白血浆及200 μl各组织空白匀浆液配制以下系列浓度样品:(1)伏立康唑定量下限(血浆为0.02 μg/ml,组织为0.01 μg/ml)、低浓度(0.05 μg/ml)、中浓度(2 μg/ml)、高浓度(血浆为40 μg/ml,组织为20 μg/ml);(2)伏立康唑氮氧化物定量下限(血浆、肾脏、脑组织为0.02 μg/ml,心脏、肝脏、脾脏、肺为0.05 μg/ml),低浓度(血浆、肾脏、脑组织为0.05 μg/ml,心脏、肝脏、脾脏、肺为0.1 μg/ml),中浓度(血浆、肾脏、脑组织为1 μg/ml,心脏、肝脏、脾脏、肺为2 μg/ml),高浓度(血浆为40 μg/ml,心脏、肝脏、脾脏、肺为5 μg/ml,肾脏、脑组织为2 μg/ml)。根据当日的标准曲线测定质控样品的绝对回收率。绝对回收率=实测浓度/实际加样浓度×100%。结果表明,伏立康唑批内回收率>85%,RSD<9.6%(n=5);伏立康唑氮氧化物批内回收率>87.2%,RSD<8.1%(n=5)。
2.5.2 批间回收率和精密度 分别配制3批2.5.1项下4种浓度的质控血浆和各组织样品残渣复溶液,每一浓度取5个样本,按1.7项下方法进行前处理,按1.4项的色谱条件和质谱条件检测,分3 d进行测定,把测定的峰面积代入当天的标准曲线,计算质控样品的回收率。结果表明,伏立康唑批内回收率>88.5%,RSD<7.7%(n=5);伏立康唑氮氧化物批内回收率>89.1%,RSD<8.6%(n=5)。
2.6 稳定性实验 制备伏立康唑和伏立康唑氮氧化物低浓度(0.02 μg/ml)、高浓度(40 μg/ml)的血浆样品,分别进行以下实验。(1)冻融实验:冰冻温度-80 ℃,解冻温度25 ℃,反复冻融3次,进行稳定性实验。(2)长期冷冻实验:将含药血浆样品于-80 ℃放置1个月后进行稳定性实验。(3)血浆样品处理后48 h稳定性实验:将血浆样品按1.7项下方法进行前处理,室温下保存48 h,按1.4项的色谱条件和质谱条件检测,每一浓度取5个样本,把测定的峰面积代入当天的标准曲线,计算回收率。结果表明,在3种稳定性实验中,伏立康唑的回收率>91.5%,RSD<8.6%(n=5);伏立康唑氮氧化物的回收率>93.1%,RSD<9.1%(n=5)。表明血浆样品反复3次冻融后稳定性良好;血浆样品在-80 ℃条件下至少可以保存1个月;血浆样品处理后可在室温下保存48 h。结果显示,待测组分在大鼠血浆中的稳定性符合生物样品的检测要求。
2.7 基质效应考察 取6批空白血浆,制备伏立康唑和伏立康唑氮氧化物低浓度(0.02 μg/ml)、高浓度(40 μg/ml )的血浆样品,按1.7项下方法进行前处理,按1.4项的色谱条件和质谱条件检测,每一浓度取5个样本,把测定的峰面积代入当天的标准曲线,计算回收率。伏立康唑的RSD<9.2%,伏立康唑氮氧化物的RSD<10.1%(n=5)。
2.8 药动学实验 把12只Wistar大鼠随机分为两组,分别从尾静脉注射两种伏立康唑注射剂后,于系列时间点取血浆,按1.7项下方法进行前处理,按1.4项的色谱条件和质谱条件检测,得到药动学参数,见表2,平均血浆药物浓度-时间曲线图见图3。采用t检验对AUC0~24 h进行比较,结果无显著性差异(伏立康唑P=0.144 8,伏立康唑氮氧化物P=0.860 8),表明两种伏立康唑注射剂的AUC0~24 h差异无统计学意义。
2.9 组织分布实验 精密吸取组织匀浆液按1.7项下方法进行前处理,按1.4项的色谱条件和质谱条件检测,把测定的峰面积带入线性回归方程,计算出给药后大鼠各组织中伏立康唑和伏立康唑氮氧化物的浓度和药-时曲线下面积。各组织匀浆上清液中伏立康唑和伏立康唑氮氧化物的药物浓度-时间曲线见图4,各组织中24 h药物浓度-时间曲线下面积见图5。由图5可见,24 h内伏立康唑的组织药物累积浓度由大到小依次为肝脏>脾脏>心脏>肾脏>肺>脑组织,伏立康唑氮氧化物的组织药物累积浓度由大到小依次为心脏>脾脏>肺>肝脏>肾脏>脑组织。两种伏立康唑注射剂在心脏、肝脏、脾脏、肺、肾脏和脑组织的总体暴露未见显著性差异(P>0.05),不排除在特定脏器中可能存在显著性差异。

表2 两种伏立康唑注射剂在大鼠体内的药动学参数Table 2 Pharmacokinetic parameters of two kinds of voriconazole injections in rats (n=6)
CL:清除率;AUC0~24 h:24 h药物浓度-时间曲线下面积;AUMC:一阶曲线下面积;MRT:平均滞留时间

图3 伏立康唑和伏立康唑氮氧化物的平均血浆药物浓度-时间曲线图Figure 3 Average plasma drug concentration-time curves of voriconazole and voriconazole nitrogen oxidesA:伏立康唑;B:伏立康唑氮氧化物;○:国产制剂;●:进口制剂;

图4 伏立康唑和伏立康唑氮氧化物在组织匀浆上清液中的药物浓度-时间曲线Figure 4 The average drug concentration-time curves of voriconazole and voriconazole nitrogen oxides in tissue homogenate supernatantA:心脏;B:肝脏;C:脾脏;D:肺 E:肾脏;F:脑组织;○:伏立康唑(国产制剂);●:伏立康唑(进口制剂); △:伏立康唑氮氧化物(国产制剂);▲:伏立康唑氮氧化物(进口制剂);
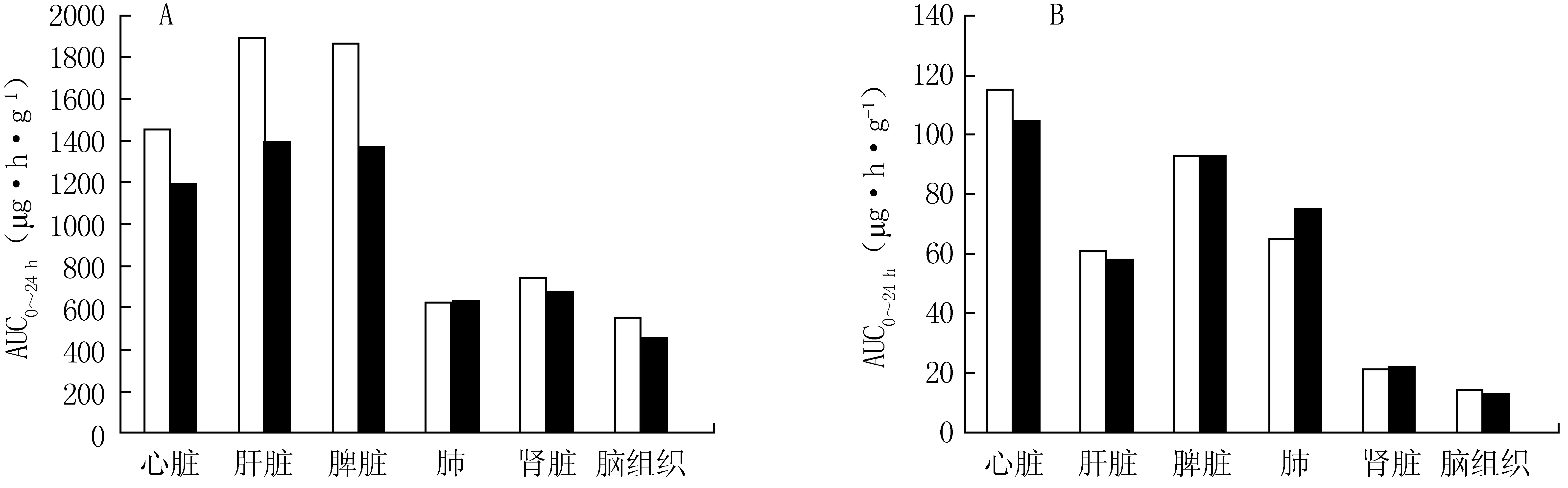
图5 各组织中24 h药物浓度-时间曲线下面积Figure 5 Area under the curve in each observed tissue within 24 hoursA:伏立康唑;B:伏立康唑氮氧化物;□:国产制剂;■:进口制剂;
2.10 动物行为 对两组共12只Wistar大鼠分别从尾静脉注射两种伏立康唑注射剂后进行24 h观察。(1)0 h:国产制剂组1只大鼠昏厥,进口制剂组无大鼠昏厥。(2)12 h:国产制剂组3只大鼠的尾部变黑,毛发蓬松,缩肩拱背,拒俘反射迟钝;进口制剂组1只大鼠的尾部变黑。(3)24 h:国产制剂组2只大鼠断尾,4只大鼠尾部变黑,出现烧灼创伤,2只大鼠进行攻击,1只大鼠死亡;进口制剂组1只大鼠尾部变黑,出现烧灼创伤,未观察到大鼠相互攻击,无死亡。
3 讨 论
目前,伏立康唑的剂型有口服制剂和注射剂等,其口服生物利用高,对曲霉属、念珠菌属、足放线病菌属和镰刀菌属的真菌感染有临床疗效,是治疗肺霉曲病的首选药物。伏立康唑主要在肝脏通过CYP450的同工酶CYP2C19代谢[8],主要代谢产物为无抗菌活性的伏立康唑氮氧化物,血浆中约占72%[9]。
进口和国产伏立康唑注射液的溶媒不同,为考察溶媒是否影响伏立康唑注射液在大鼠体内的药动学和组织分布,设计单周期单剂量尾静脉注射,考察药动学和组织分布情况。结果表明,国产和进口伏立康唑注射液的tmax和cmax一致,伏立康唑的平均药-时曲线有双峰现象,符合非线性代谢特点,因静脉给药,排除胃对药物多时间和多部位吸收造成双峰现象的可能性。伏立康唑为脂溶性药物, 进入血液后,部分药物分布到内脏组织中,当代谢到一定程度时,组织中的药物重新释放进入血液,可能是造成双峰现象的主要原因。故此情况下,以t1/2作为主要的药动学参数不太合理。两种注射剂的药动学参数无显著性差异,因此两种注射剂在大鼠体内的药动学表现相似,增溶剂未从本质上改变血浆中伏立康唑的药动学行为。
两种注射剂在大鼠体内的组织分布类似,伏立康唑在肝脏中浓度最高,其余组织中浓度相差不大;伏立康唑氮氧化物在肺、肝脏和心脏中浓度更高,肾脏和脑组织中的浓度更低。伏立康唑的组织药物浓度-时间曲线也有双峰现象,同时观察到伏立康唑(进口制剂)血药浓度在12 h内的下降速度比国产制剂更快,但国产制剂对大鼠的刺激性更大,分析原因可能是国产制剂以乙醇-丙二醇=1∶1为溶媒,且采用静注方式给药。本研究由于实验动物样本量的限制,只对单剂量给药进行考察,实验结果具有一定的局限性,需要进一步深入研究。
