临床药师对一例华氏巨球蛋白血症病人的药学服务
2019-11-05代恩勇白元松赵亚男
朱 昆,代恩勇,白元松,赵亚男*
(1.吉林大学中日联谊医院药学部,长春 130013;2.吉林大学中日联谊医院肿瘤血液内科,长春 130013)
目前,新医改方案对药学服务提出了方向性要求,现代医院药学的工作重点由保障药品供应向临床药学服务转变,临床药师应当融入临床治疗的全过程,为病人安全、合理用药提供保障。华氏巨球蛋白血症(Waldenström macroglobulinemia,WM)属罕见B细胞淋巴瘤,是一种以骨髓、肝、脾及淋巴结内淋巴浆细胞浸润和血清中出现大量单克隆免疫球蛋白M(IgM)为特征的恶性浆细胞病,属于极其罕见的B细胞淋巴瘤,年发病率约为3/100万,占非霍奇金淋巴瘤的2%。由于WM的发病率极低[1],药学服务实践案例鲜有报道。目前,WM的治疗主要以化疗为主,病人在使用化疗药物过程中面临更大的用药风险。本文以1例WM病人的诊疗过程为例,探讨临床药师如何利用专业特长,做好药学服务,降低病人的用药风险,在临床治疗团队中发挥更大的作用。
1 病例资料
病人,女,51岁,入院1个月前体检发现脾脏肿大,于2018-02-02入住吉林大学中日联谊医院肿瘤血液内科,入院诊断为华氏巨球蛋白血症中危组(IPSSWM 2分)。综合病人病情,确立化疗方案为利妥昔单抗+环磷酰胺+长春地辛+氢化泼尼松。住院期间重要临床信息及药物治疗时间轴见图1。
2 分析和讨论
2.1 WM的临床诊断 WM无特异形态学、免疫表型及遗传学改变,其临床诊断过程极其复杂,需紧密结合临床表现及病理学检查结果进行综合判断。研究发现,在WM病人中,髓样分化因子88(myeloid differentiation factor 88,MYD88)基因L265P突变率高达90%以上[2],MYD88L265P突变对于鉴别诊断WM具有重要意义。该病人临床症状与脾边缘带淋巴瘤极为相似,二者均为CD20(+),但脾边缘带淋巴瘤MYD88L236P为(―)。故结合免疫球蛋白、骨髓形态学、骨髓活检免疫组化检查结果,基因检测MYD88L236P(+)及临床表现,根据MW国际预后评分系统(IPSSWM),该病人可明确诊断为MW中危组(IPSSWM 2分)。
2.2 治疗方案分析 目前,尚无针对WM的特异性药物,但对WM相关器官肿大或血细胞降低的病人,首选含有利妥昔单抗的化疗方案。虽然R-CHOP化疗方案(即利妥昔单抗+环磷酰胺+多柔比星+长春新碱+泼尼松)的临床效果较为理想,但蒽环类药物在其中的地位受到质疑,而R-CVP方案(利妥昔单抗+环磷酰胺+长春新碱+泼尼松)与R-CHOP方案疗效相当,且ADRs发生率更低[3]。病人因脾脏肿大被收入院,入院查得红细胞计数3.18×1012/L,血红蛋白101.0 g/L,属于WM相关器官肿大及血细胞降低病人,医嘱给予利妥昔单抗+环磷酰胺+长春地辛+氢化泼尼松,替代R-CVP方案。长春地辛与长春新碱同属长春碱类抗肿瘤药物,与长春新碱相比,长春地辛具有抗瘤谱广、神经系统毒性小的优点,低剂量作用强度是长春新碱的3倍,且无交叉耐药,ADRs较少,故本次化疗方案较为合理。
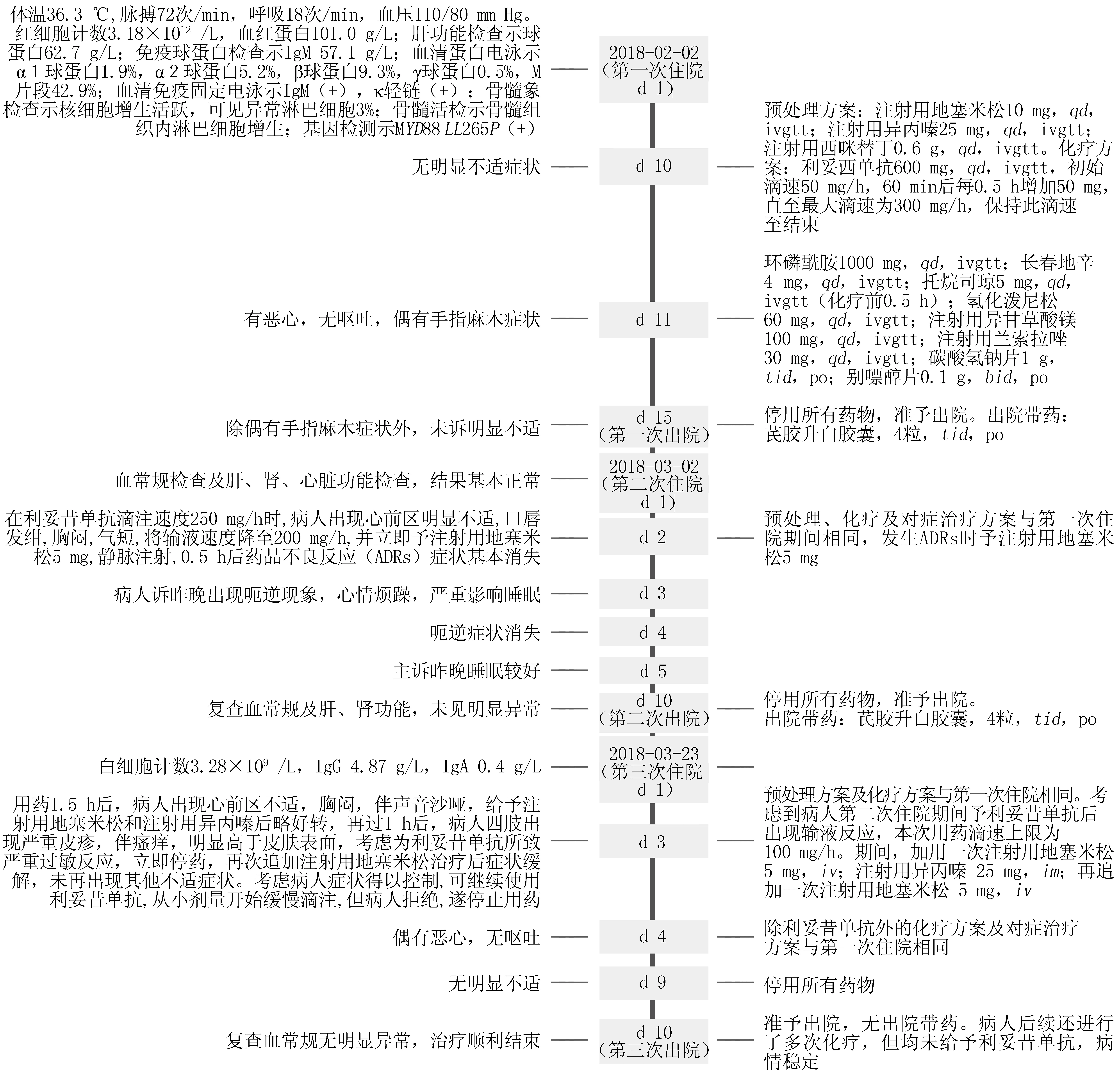
图1 病人3次住院期间的重要临床信息及治疗时间轴
2.3 化疗的药学服务 为预防化疗药物导致的胃肠道反应,化疗前0.5 h给予注射用托烷司琼对症治疗。嘱病人化疗期间多食高热量、高蛋白、高维生素及易消化的温软食物,少食多餐。病人在第一次住院治疗期间出现手指麻木症状,不能排除长春地辛导致的神经损伤可能。长春碱类药物导致的末梢神经炎多在用药后1~2周出现,随疗程数增多逐渐加重,化疗停止后会逐渐好转,但在用药d 2发生显著周围神经病变的案例较少。结合该病人的临床症状,临床药师建议以营养神经为主,可予单唾液酸四己糖神经节苷脂类药物[4],但病人考虑到经济压力,拒绝了临床药师的建议。为了缓解临床症状,帮助病人快速康复,临床药师指导病人对麻木手指做适当功能训练,如手指伸展、抓握练习,减少冷刺激,用温水洗手,病人出院前手指麻木症状有所减轻。
环磷酰胺对尿路有较强刺激性,会使血尿酸升高。为了减轻泌尿系统毒性,医师叮嘱病人化疗期间多饮水,日摄入水量维持在3 L以上;为了减轻高尿酸对身体的伤害,医嘱给予别嘌醇以抑制尿酸生成,予碳酸氢钠碱化尿液,较为合理。别嘌醇有骨髓抑制风险,该病人已经出现WM相关贫血,临床药师全程密切监测病人骨髓抑制相关风险,如出血、感染,嘱病人注意保暖,避免感冒。直至出院,病人除了有轻度骨髓抑制外,未发生感染及相关并发症。
病人在第二次化疗期间出现呃逆症状,夜晚无好转,烦躁, 睡眠较差。 临床药师查阅文献发现, 地塞米松有致呃逆的ADRs[5],原因可能有以下几方面: (1)提高中枢神经系统兴奋性,使中枢-内脏神经调节功能失调,导致膈神经过度兴奋;(2)增加胃蛋白酶及胃酸分泌,刺激胃肠道迷走神经,反射性引起膈肌收缩;(3)影响肾上腺素能受体数量及受体介导的细胞信息传递过程,提高受体的敏感性,加大膈肌收缩力。此外,地塞米松还会导致病人出现激动不安、烦躁等精神系统症状,约45%的病人会发生中、重度失眠[6]。故病人的呃逆、烦躁、失眠现象极有可能是地塞米松相关的ADRs,建议病人不必过度紧张,告知其停药后一般会自行缓解,必要时可予药物干预。结果在停用地塞米松d 2,病人的呃逆、烦躁、失眠症状均好转。
2.4 利妥昔单抗化疗的药学服务 利妥昔单抗是一种人/鼠嵌合型抗CD 20单克隆抗体,可与B淋巴细胞膜上的CD 20抗原特异性结合,通过抗体依赖性细胞毒作用以及补体依赖性细胞毒作用杀伤B细胞,达到抗肿瘤或免疫调节的作用。为了降低利妥昔单抗相关毒性,临床给药前予以注射用地塞米松+异丙嗪+西咪替丁三联预处理。目前,利妥昔单抗常规预处理并无统一标准,临床药师建议根据既往经验选用糖皮质激素和/或抗组胺药物治疗[7],但临床医师未予采纳。临床药师审核医嘱发现,医师仅标注预处理方案应在利妥昔单抗用药前使用。为了确保治疗方案落实到位,临床药师建议将医嘱进一步明确为利妥昔单抗给药前0.5 h给予预处理方案,便于护理人员准确把握给药时机,保证预处理方案效果最大化。医师接受了临床药师的建议,对用法进行了调整。
研究表明,对利妥昔单抗导致的输液反应,降低输注速度或停止用药可消除或缓解临床症状,待输液反应完全消退后,可以降低50%输注速度继续输注[8]。对于症状较严重的病人,可积极对症治疗。该例病人首次应用利妥昔单抗后未发生输液反应,但在第二次住院用药过程中出现心前区不适、口唇发绀的输液反应,在降低输注速度并对症治疗后,症状缓解,最终完成利妥昔单抗的治疗。在第三次住院治疗时,为了保障病人用药安全,临床药师建议利妥昔单抗的滴速控制在100 mg/h,但病人仍然发生较严重的输液反应,即使降低滴速并对症治疗,ADRs症状仍然进展,最后被迫终止治疗,不仅破坏了治疗的连续性,还给病人造成了很大的经济损失。
临床药师查阅文献后认为,病人最后两次用利妥昔单抗治疗时出现的输液反应极有可能属于再次输液反应。再次输液反应是指距离上次用药间隔较长一段时间后,再次用药出现的输液反应。有研究报道1例滤泡性淋巴瘤病人在第三次输注利妥昔单抗3 h后,出现呼吸急促、高热、双肺大片渗出影,怀疑为急性呼吸窘迫综合征,给予大剂量甲泼尼龙并进行机械通气后好转[9]。为了明确该例病人发生再次输液反应的原因,保障用药安全,临床药师查阅文献,发现曾有报道当病人免疫功能异常时,应用利妥昔单抗发生输液反应的症状可能更为剧烈[10]。该病人在第三次入院时由于疾病及化疗的影响,血清免疫球蛋白和白细胞水平异常,整体免疫功能较差,不排除诱发或加重输液反应可能。故临床药师提示医师,应用利妥昔单抗时不仅要仔细询问病人既往过敏史,还应评估其免疫功能,警惕潜在的用药风险。
WM的发病率极低,故临床药师参与其治疗的实践机会很少。在该病例治疗过程中,临床药师不仅结合指南对WM的治疗方案进行了评估,还对预处理方案和ADRs及时做出分析与判断,全程开展药学服务,保证用药安全、有效,促进临床合理用药。
