内皮细胞敲除TFPI对小鼠急性肺损伤的影响
2019-11-04庞烈文黄杰春王宜青陈晓峰
施 梦 苗 峰 陈 佶 庞烈文 黄杰春 王宜青 陈晓峰
急性肺损伤(acute lung injury,ALI)是一种重要并发症,异常激活炎性细胞和凝血系统是急性肺损伤的关键致病因素[1]。急性肺损伤患者尸体解剖的研究发现,损伤的肺部微血管中存在广泛的微血栓[2]。急性呼吸系统感染的早期,肺组织局部凝血功能的激活可以限制微生物的浸润及在局部消灭病原微生物。研究也表明,凝血功能增强可以在肺损伤病理变化和肺功能损伤过程中起重要作用[3]。因此,肺组织局部凝血状态改变可能是急性肺损伤患者药物治疗的潜在靶点。组织因子(tissue factor,TF)是凝血系统的主要分子,在血栓性疾病中起关键作用。肺损伤研究发现TF引起的凝血系统激活,导致肺部炎症加重[4]。组织因子途径抑制物(tissue factor pathway inhibitor,TFPI)是一种天然的抗凝血物质,可以抑制凝血蛋白酶复合物TF/FVⅡa/FXa。TFPI主要产生于内皮细胞,凝血酶刺激细胞时释放入血[5]。
急性肺损伤治疗手段有限,缺乏有效的药物,治疗中较棘手。脓毒症引起的急性肺损伤动物模型发现,肺组织中TF表达上调和炎性细胞浸润[6]。TFPI可以降低脓毒症肺损伤动物的死亡率[7]。然而,临床研究中发现TFPI只改善一部分肺损伤患者的肺功能,治疗效果有限[8]。复旦大学基础医学院代谢疾病研究所马端教授实验团队制备了内皮细胞敲除TFPI基因的小鼠,肺损伤后血管内皮通透性增加,肿瘤的肺部转移增多[9]。内毒素可以诱导急性肺损伤发生,是制备急性肺损伤动物模型的常用方法[10]。肺血管内皮细胞敲除TFPI后使急性肺损伤的血管通透性增加及肺损伤加重,本研究旨在探索其发病机制。
材料与方法
1.实验动物:成年C57BL/6野生型小鼠由上海中科院斯莱克实验动物中心提供;血管内皮细胞特异性敲除TFPI的纯合及杂合小鼠由复旦大学基础医学院代谢疾病研究所马端教授实验室提供。
2.实验方法:(1)内毒素气道滴注建立小鼠急性肺损伤模型:所有实验过程都遵循复旦大学实验动物使用条例。TFPI基因敲除鼠是C57BL/6遗传背景小鼠,提鼠DNA,用TFPI和TEK基因引物进行PCR反应,再进行琼脂糖凝胶电泳。根据电泳结果分成野生型、TFPIflox/flox和TFPIflox/flox/Tek-Cre小鼠。饲养至8~12周,体重约25g;气管内滴注内毒素建立急性肺损伤小鼠模型。各组小鼠,取血浆行凝血功能,TF和TFPI浓度检测。用0.5ml预冷的PBS液进行左肺肺泡灌洗,离心收集细胞沉淀行炎性细胞计数及分类,上清液保存在-80℃,后行蛋白、炎性因子、TFPI和TF浓度测定。取右肺中叶,固定行HE病理检查和免疫组化检测。取右肺下叶计算湿干重比。取右肺上叶提取蛋白及RNA,进行检测。(2)全血的收集和血浆的制备:全血与枸橼酸钠溶液按9∶1混合,制备去除血小板的新鲜血浆。留取上清液,分装保存至-80℃。整个过程要在取全血后2h内完成[11]。(3)血浆凝血功能的检测:血浆上清液用法国的Stago半自动血凝仪和西门子的诊断试剂进行APTT(activated partial thromboplastin time,APTT),PT (prothrombin time,PT)和TT(thrombin time,TT)时间的测定。(4)肺干湿重比:肺干湿重比=(肺总湿重-锡箔纸)/(肺总干重-锡箔纸)[12]。(5)肺泡灌洗液中炎性细胞计数:肺泡灌洗液收集后,在4℃离心机中400×g离心10min,取上清液分装后-80℃保存。用100μl PBS液重悬细胞沉淀,用小动物血细胞分析仪检测炎性细胞数量。(6)肺损伤的形态学评分:取右肺中叶固定和石蜡包埋,制成HE病理切片,用半定量方法评价肺损伤程度。每一个样本的病理评分都用5个视野评分的平均值来表示。(7)用ELISA的方法评估小鼠TFPI、TF及炎性因子的含量:使用购自美国R&D公司的ELISA试剂盒,检测小鼠肺泡灌洗液中的炎性因子TNF-α、IL-1β和IL-6的含量。检测小鼠血浆、肺泡灌洗液、肺组织中TF和TFPI的含量。(8)检测伊文思蓝渗出率:定量检测白蛋白与伊文思蓝结合物含量是一种常用于检测组织内血管屏障及单层内皮细胞完整性的方法。处死小鼠前2h,尾静脉给予伊文思蓝溶液(20mg/kg),左肺灌洗留取肺泡灌洗液,将灌洗后的左肺浸入到甲酰胺溶液中,在65℃温箱中孵育72h后,收集甲酰胺孵育液,将左肺组织取出后烘干,称重记录干肺重。测量630nm含有伊文思蓝的肺泡灌洗液和甲酰胺溶液的吸光度,计算伊文思蓝的含量[12]。(9)免疫组化检测:石蜡切片进行脱蜡及脱水,用相应一抗4℃孵育过夜,相应二抗3℃孵育30min,制备免疫组化切片标本。(10)组织蛋白的提取和Western blot法检测:肺组织标本留取后立即放入液氮内冻存,然后保存至-80℃冰箱中。肺组织标本块用蛋白裂解液匀浆、离心、留取上清液。用10%及12%的SDS/PAGE胶跑电泳,用Western blot法鉴定各组小鼠单位肺组织中MPO、NF-κB、VCAM-1和TFPI含量。
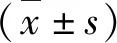
结 果
1.内皮细胞TFPI敲除小鼠的培育及鉴定:用PCR及琼脂糖凝胶电泳方法鉴定各小鼠的基因型,根据基因型分组,每组6只小鼠。用Western blot法和ELISA方法评价TFPI敲除小鼠的敲除效率。Western blot法检测发现TFPI敲除小鼠肺组织TFPI蛋白含量只有野生小鼠的28%(P=0.003)。ElISA检测发现TFPI敲除小鼠肺组织TFPI蛋白含量只有野生小鼠的13.9%(P=0.000);TFPI敲除小鼠肺泡灌洗液中TFPI蛋白含量只有野生小鼠的29%(P=0.000);TFPI敲除小鼠血浆中TFPI蛋白含量比野生小鼠血浆中的含量低91.8%(P=0.000),详见图1。
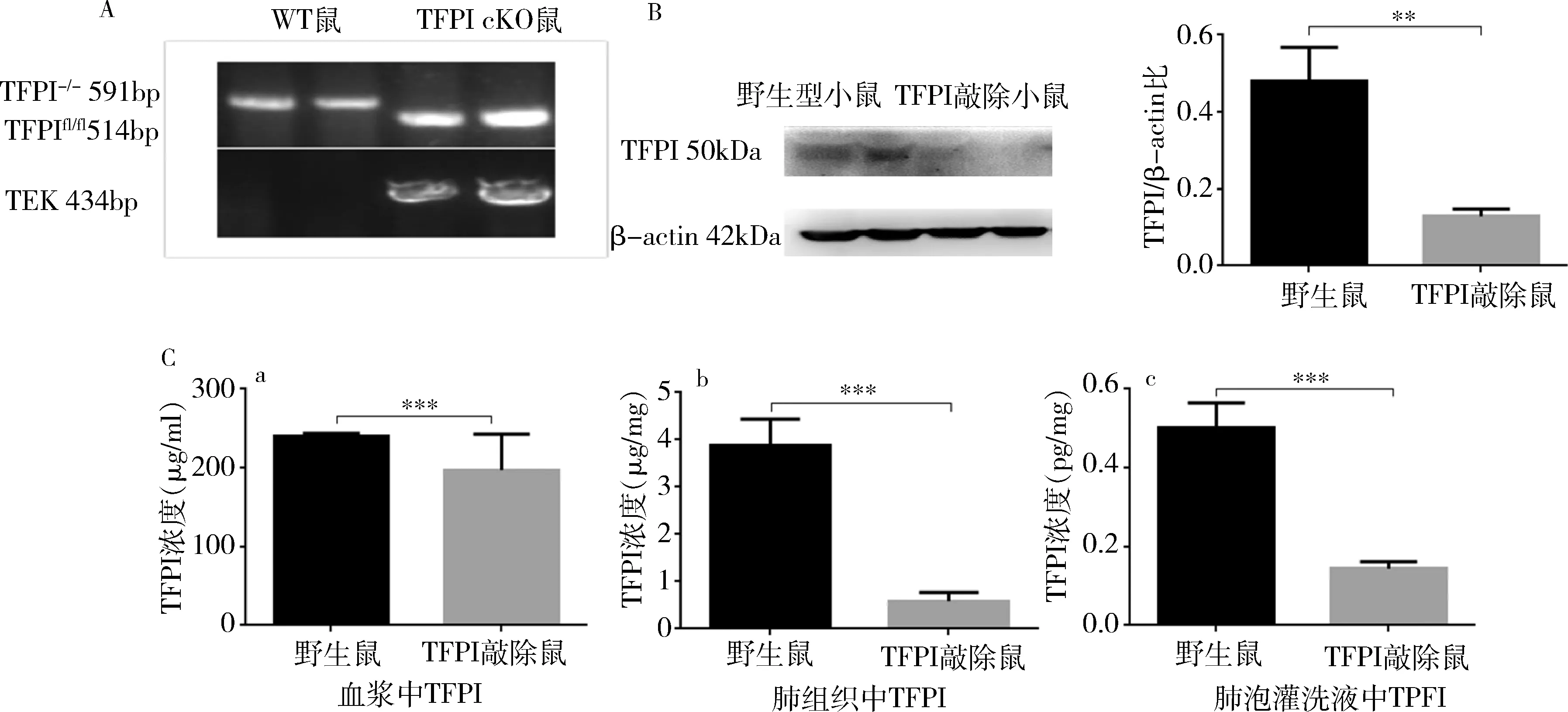
图1 内皮细胞TFPI敲除鼠的鉴定A.用琼脂糖凝胶电泳鉴定小鼠基因型;B.敲除鼠肺组织中TFPI蛋白的表达明显降低;C.用ELISA方法测定TFPI敲除鼠血浆、肺组织及肺泡灌洗液中TFPI的蛋白含量明显降低;**P<0.01, ***P=0.000
2.TFPI敲除鼠急性肺损伤后凝血功能和TFPI浓度的变化:用半自动血凝仪检测发现3种基因型小鼠的凝血功能差异无统计学意义(P>0.05)。用LPS处理过的小鼠,其凝血功能各参数也没有明显变化。急性肺损伤后48h,TFPI基因敲除小鼠(502±63pg/ml)和野生小鼠(1638±89pg/ml)肺泡灌洗液中TFPI含量和对照组(基因敲除小鼠:143±7pg/ml,野生型小鼠:501±26pg/ml)比较都明显升高(P<0.05)。急性肺损伤后基因敲除小鼠(584±188pg/mg)和野生小鼠(2890±280pg/mg)肺组织中TFPI的含量与对照组野生型小鼠(3872±566pg/mg)比较明显降低(P<0.05)。肺泡灌洗液TFPI浓度的增加是由于急性肺损伤后肺泡灌洗液中的蛋白浓度增高所致。但是,急性肺损伤后小鼠血浆中TFPI浓度与对照组小鼠比较变化不大(P>0.05),详见图2。
图2 各组小鼠凝血功能和各组织中TFPI含量的变化A.各组小鼠凝血功能检测指标的变化;B.血浆中TFPI蛋白含量的变化;C.肺组织中TFPI蛋白含量的变化;D.肺泡灌洗液中TFPI的变化;**P<0.01,***P=0.000
3.敲除TFPI后LPS诱导的急性肺损伤病理改变加重:应用半定量评分方法评价肺损伤的严重性(图3B)。内皮细胞TFPI敲除小鼠急性肺损伤病理变化加重(P<0.01)。和野生型对照组小鼠比较,野生型小鼠及TFPI基因敲除小鼠急性肺损伤后肺组织炎性反应明显增加(P=0.000),详见图3。

图3 肺损伤后各组小鼠病理改变A.各组小鼠肺损伤后病理损伤的示意图(HE,×100);B.各组小鼠肺损伤评分的变化;**P<0.01,***P=0.000
4.敲除TFPI后急性肺损伤的血管渗透性增加:肺湿干重比表示肺水肿程度。LPS诱导急性肺损伤小鼠肺泡灌洗液中蛋白浓度明显增加。LPS也可以引起白蛋白结合的伊文思蓝从血管内渗出到肺间质中,进一步证实了LPS对血管内皮屏障的影响。野生型对照组小鼠肺泡灌洗液中伊文思蓝浓度为3.89±0.70μg/ml,组织中伊文思蓝浓度为1.70±0.90μg/mg,急性肺损伤野生型小鼠肺泡灌洗液伊文思蓝浓度上升至16.20±0.80μg/ml,肺组织中伊文思蓝浓度为4.07±0.65μg/mg。经LPS诱导急性肺损伤的基因敲除小鼠,其肺湿干重比及肺泡灌洗液蛋白浓度都高于野生型急性肺损伤小鼠;同时基因敲除小鼠急性肺损伤后,其肺泡灌洗液和肺组织中伊文思蓝浓度也明显增加,详见图4。

图4 内皮细胞敲除TFPI可以引起肺损伤血管渗透性增加A.急性肺损伤后湿干重比;B.肺泡灌洗液中蛋白含量;C.肺泡灌洗液中伊文思蓝含量;D.肺组织中伊文思蓝含量;**P<0.01, ***P=0.000
5.敲除TFPI后急性肺损伤中炎性细胞浸润及炎性反应加重:LPS诱导急性肺损伤后肺泡灌洗液中炎性细胞数量明显增加。TFPI基因敲除急性肺损伤小鼠肺泡灌洗液中白细胞数量比野生型急性肺损伤小鼠的炎性细胞高50%。急性肺损伤肺组织中MPO浓度的增加表示中性粒细胞的浸润及活性增加。组织中MPO含量也可以用免疫组化的方法来确定。笔者用ELISA的方法检测了小鼠肺组织中炎性因子TNF-α、IL-1β和IL-6的浓度。TFPI基因敲除小鼠急性肺损伤后肺泡灌洗液和肺组织中炎性因子TNF-α、IL-1β和IL-6的浓度与野生型小鼠急性肺损伤比较增加更多,详见图5。
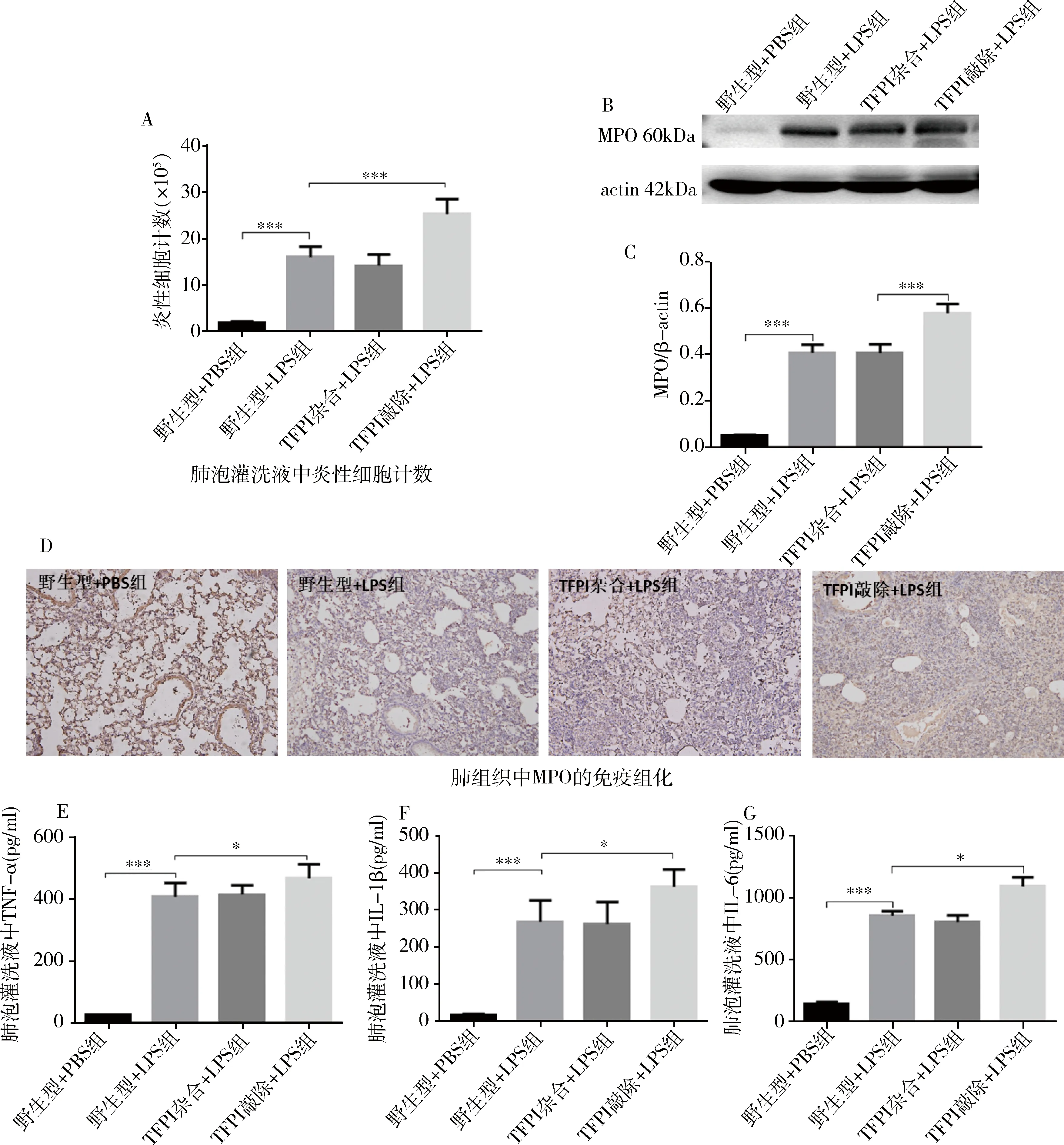
图5 内皮细胞敲除TFPI可以引起急性肺损伤炎性反应增加A.肺泡灌洗液中炎性细胞数量变化;B、C.用Western blot法检测肺组织中MPO含量;D.用免疫组化方法检测肺组织中MPO含量(辣根过氧化物酶法,×100);(E、F、G)用ELISA方法检测肺泡灌洗液中炎性因子含量变化;*P<0.05, ***P=0.000
6.TFPI敲除鼠急性肺损伤后可以通过NF-κB通路破坏内皮细胞屏障:通过进一步探索TFPI基因敲除小鼠急性肺损伤程度加重的机制。笔者检测了内皮细胞炎性损伤的主要信号通路,VCAM-1和NF-κB信号通路。LPS诱导的急性肺损伤小鼠与对照组比较VCAM-1表达明显增加,而且TFPI基因敲除小鼠急性肺损伤后肺组织中VCAM-1蛋白表达更为明显。用Western blot法检测肺组织中p-NF-κB和NF-κB蛋白的表达;LPS诱导的急性肺损伤后肺组织中p-NF-κB的蛋白表达增加明显(图6)。同时也发现内皮细胞TFPI基因敲除小鼠急性肺损伤肺组织中p-NF-κB表达增加更为明显。
讨 论
LPS可以通过对大血管及小血管内皮细胞的破坏而破坏肺部血管内皮屏障[13]。LPS诱导的小鼠急性肺损伤模型是研究急性肺损伤主要的动物模型。血管内皮细胞屏障功能失调可以通过内皮细胞渗透性、形态和LPS诱导的炎性信号及细胞来评价。
急性肺损伤的患者和动物模型中都发现了体内凝血功能和纤溶功能的异常,这些异常导致肺组织炎性反应加重。急性肺损伤后,用雾化抗凝药物可以减轻肺部的炎性反应[14]。凝血功能可能是急性肺损伤新的治疗靶点[1]。临床研究发现40%的急性肺损伤患者伴有凝血功能异常和弥散性血管内凝血[15]。
图6 内皮细胞特异性敲除TFPI可以通过NF-κB途径破坏内皮细胞间隙A.用Western blot法检测各组肺组织中VCAM-1及p-NF-κB蛋白含量;B.TFPI敲除后肺组织中VCAM-1含量增加;C.TFPI敲除后肺组织中p-NF-κB蛋白表达增加;**P<0.01,***P=0.000
本研究发现,通过气管内滴注LPS诱导的急性肺损伤小鼠的凝血功能与对照组比较差异无统计学意义,同时血浆中TFPI浓度差异无统计学意义,但是肺组织中TFPI表达明显减少。有研究认为,由于TF-VⅡ复合物可以激活肺组织的凝血,导致血栓和纤维素形成增加[16]。TFPI蛋白分子通过蛋白聚糖结合在内皮细胞上,调节TF的表达和活性,血管内皮细胞是TFPI的主要来源细胞[17]。
本研究用内皮细胞TFPI基因敲除小鼠,探究内皮细胞中TFPI对急性肺损伤的影响。内皮细胞中TFPI基因敲除后,小鼠血浆及肺组织中TFPI表达明显下降,急性肺损伤后,血管渗透性增加更明显,损伤更严重。血管渗透性是肺损伤急性阶段的特征,内皮细胞的激活可以引起黏附分子VCAM-1的表达。研究表明,LPS刺激后内皮细胞和气道平滑肌细胞表达VCAM-1[18,19]。本研究表明,小鼠急性肺损伤后VCAM-1表达明显增加,TFPI基因敲除小鼠肺损伤后表达更加明显。NF-κB的激活是调节肺组织炎性反应的关键。本研究表明, TFPI基因敲除可以增强LPS诱导磷酸化NF-κB蛋白的表达,证明内皮细胞TFPI基因敲除可以通过NF-κB的信号通路,来增强LPS诱导的血管渗出和炎症。通过NF-κB信号激活而调节的VCAM-1蛋白的表达增加,VCAM-1是一种促炎症的转录因子。
综上所述,本研究证实了内皮细胞敲除TFPI基因小鼠急性肺损伤后通过激活NF-κB信号通路促进肺组织内炎性反应和血管渗出性增加。
