酮康唑致人L02肝细胞毒性差异蛋白鉴定
2019-11-04苗玉发康慧君王晓姝李路路张河战
苗玉发 康慧君 王晓姝 李路路 张河战
酮康唑是一种吡咯类抗真菌药,文献报道可以通过干扰细胞色素P-450的活性,抑制真菌细胞膜主要固醇类物质的生物合成,损伤真菌细胞膜并改变其通透性,导致重要的细胞内物质外漏,从而达到杀菌抑菌作用。KTZ还可以抑制真菌的三酰甘油和磷脂的生物合成,抑制氧化酶和过氧化酶的活性,引起细胞内过氧化氢积聚导致细胞亚微结构变性和细胞坏死[1]。2011年8月31日,国家食品药品监督管理局在第40期《药品不良反应信息通报》中提醒警惕KTZ 200mg口服片剂的严重肝毒性,但是,KTZ致人肝损伤的毒性机制仍不完全清楚 。
本研究将KTZ和人L02肝细胞共培养诱导体外肝细胞毒性,通过双向电泳法筛选差异蛋白,并通过质谱技术鉴定蛋白质种类,探讨KTZ对人肝细胞的毒性机制。
材料与方法
1.主要试剂:KTZ(美国Sigma公司);L02人肝细胞株(中科院上海细胞生物学研究所);RPMI-1640培养液(美国Gibco公司);胎牛血清(美国Gibco公司);DMSO(美国Sigma公司);考马斯亮蓝(美国Promega公司);0.25%胰酶(江苏凯基生物技术股份有限公司);重泡涨液(美国Biorad公司);蛋白Marker(中科院上海生物化学研究所);CCK-8检测试剂盒(江苏凯基生物技术股份有限公司);活性氧检测试剂盒(南京建成生物工程研究所);全细胞蛋白提取试剂盒(美国Epigentek公司);其余试剂均为国产分析纯。
2.主要仪器:5810R型台式高速离心机(德国Eppendorf公司);全自动酶标仪(美国Thermo公司);荧光显微镜(日本Olympus公司) ;恒温培养箱(日本Sanyo公司);超净工作台(苏州净化设备有限公司);电子分析天平(日本岛津公司);Ettan IPGphor等电聚焦电泳仪(瑞典Amersham公司);Ettan DALT twelve system SDS-PAGE电泳仪(瑞典Amersham公司);UMAX ImageScanner凝胶扫描仪(美国GE healthcare公司);UV-2550分光光度计(日本岛津公司); ultrafleXtreme MALDI-TOF/TOF质谱仪(德国Bruker公司)。
3.实验方法:(1)药液的配制:KTZ临用前以培养液稀释至实验所需的终浓度。(2)细胞培养:复苏冻存的细胞,离心去除冻存液,加入含10% FBS的RPMI-1640培养液(pH值7.2),于37℃饱和湿度、5%CO2孵箱中静置培养。细胞生长到80%后,加入lml 消化液(含0.02%EDTA,0.25%胰酶)消化,待细胞变圆,间隙增大时,弃消化液,加入2ml培养液终止消化,轻轻吹打制成单细胞悬液待用[2]。(3)CCK-8法检测KTZ对人L02肝细胞增殖的影响:将单细胞悬液调至105/ml浓度,96孔板每孔100μl放入培养箱中培养24h,至完全贴壁,然后加入30、50、80、100mg/L浓度的KTZ 10μl,培养2、4、6和8h后收集上清,加入新鲜不含FBS的培养基100μl,加CCK-8溶液10μl继续培养2~4h,然后测定450nm处的加药细胞的吸光度值(试验组A值)。同时设置空白组(培养基和CCK-8溶液,无细胞)和对照组(不加药的培养基和CCK-8溶液,有细胞)。细胞增殖抑制率(%)= (对照组A值-试验组A值)/(对照组A值-空白组A值)×100%[3,4]。实验重复3次,计算平均增殖抑制率。(4)流式细胞术检测KTZ对细胞内活性氧(reactive oxygen species,ROS)的影响:将单细胞悬液调至105/ml浓度,96孔板每孔加100μl后放入培养箱中培养24h,至完全贴壁,然后加入30、50、80、100mg/L浓度的KTZ 10μl共培养4h和6h,弃上清,PBS洗1次,加DCFH-DA(5μmol/L) 50μl,37°C孵育30min,含3% FBS的PBS洗两次,加50μl PBS重悬,上机检测[5]。对照组细胞内荧光强度设定为100,其他组荧光强度与对照组进行比较,来表示胞内活性氧的多少。(5)蛋白样品制备:将80mg/L KTZ培养6h的人肝细胞作为进一步研究对象。收集的对照组细胞和实验组细胞分别设有3个复样,对照组样本编号为C1-55622、C1-55623和C1-55630,实验组样本编号为T1-55625、T1-55626和T1-55627。蛋白质提取方法按照美国Epigentek公司提供的说明书进行,Brad-ford 法测定蛋白浓度,液氮保存备用。(6)双向聚丙烯酰胺凝胶电泳(2D-PAGE):将对照组和实验组各1.0mg蛋白质加入重泡涨液中,使总体积为450μl,用等电聚焦仪按如下程序自动进行: 12h重泡涨;250V,0.5h;1000V,0.5h;8000V,9h,总电压时间约为52000Vh。结束后, 将胶条分别放入5ml平衡液Ⅰ(2% DTT)和5ml 平衡液Ⅱ(含2.5% 碘乙酰胺)中各平衡15min, 然后进行第二向垂直平板SDS-聚丙烯酰胺凝胶电泳[6~8]。(7)图像分析:将胶块放入考马斯亮蓝R-250中染色,然后在脱色液中脱色至背景清晰,得到6张考染图。然后对凝胶进行拍摄,用Imagemaster 7.0软件对图片进行分析,选取3倍以上的差异点作为目的蛋白进行质谱分析。(8)差异蛋白酶解及质谱分析: 沿染色区边缘切下凝胶中目的蛋白质点,放入0.5ml试管中,200μl超纯水37℃浸泡30min,在100μl脱色液[ACN (乙腈)∶100mmol/L碳酸氢铵=3∶7]中震荡脱色30min,重复2~3遍,直到胶块和脱色液无色;将胶块浸入100% ACN中15min,真空离心干燥5min;加入10~15μl Trypsin酶液,4℃放置45min,37℃空气浴9~11h,吸出反应液置EP 管中;加入33%ACN和0.1%TFA(三氟乙酸)50μl, 轻微振荡萃取30min,瞬时离心,吸上清置EP管中。再用含66%ACN和0.1%TFA,以及含100% ACN和0.1%TFA的萃取液各萃取一次。混合上述液体(反应液和3次萃取液)冷冻真空抽干至5~6μl,4℃冰箱保存。质谱分析时冻干样品管中加入3μl 50% ACN/0.5% TFA 溶解,加基质溶液3μl, 混匀后取1μl 点样于不锈钢板上,空气自然干燥后在ultrafleXtreme MALDI-TOF/TOF质谱仪上进行分析[9~11]。(9)数据库检索:使用Mascot检索软件在NCBInr数据库中检索质谱鉴定的蛋白质。使用国际互联网UniProt提供的数据库查询蛋白质功能,查询地址:https://www.uniprot.org/。
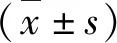
结 果
1.KTZ对人L02肝细胞增殖的抑制作用:细胞增殖抑制率随着KTZ剂量的增加和作用时间的延长而显著上升。KTZ浓度为80mg/L和100mg/L时,与对照组比较,各时间点对细胞的增殖抑制比较差异有统计学意义(P<0.05)。KTZ浓度为50mg/L时,作用4h后对细胞的增殖抑制比较差异有统计学意义(P<0.05)。KTZ浓度为30mg/L时,作用6h后对细胞的增殖抑制比较差异有统计学意义(P<0.05)。细胞增殖抑制率与药物浓度呈正相关,浓度越高,对细胞的增殖抑制作用越强,增殖率为负数时,表示KTZ在该浓度对细胞无抑制作用,结果见图1。
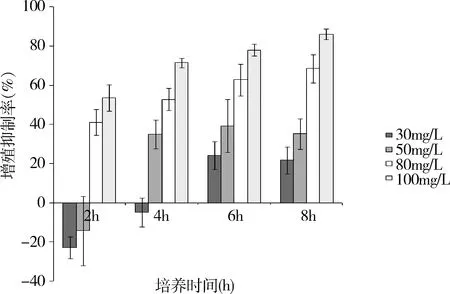
图1 不同KTZ浓度作用人L02肝细胞不同时间后细胞增殖的抑制率
2.KTZ对人L02肝细胞ROS的影响:当KTZ浓度≥80mg/L时,与对照组比较,4h和6h两个时间点的荧光强度均显著升高(P<0.01),即胞内活性氧显著性升高,结果见图2。
图2 不同KTZ浓度作用人L02肝细胞不同时间后细胞内荧光强度比值与对照组比较,*P<0.01
3.双向凝胶电泳结果:通过细胞增殖抑制实验和胞内ROS实验发现,当KTZ浓度≥80mg/L时,在不同时间点,都会产生显著性的细胞增殖抑制和细胞凋亡。因此,收集与80mg/L KTZ共培养6h的人肝细胞作为实验组,进行蛋白提取及双向凝胶电泳实验。通过与对照组比较,共获得17个蛋白差异点。与对照组比较,含量增加的点有38、149、360、427、1683、1750、1763、1765、1827和1836(图3,以点38为代表);与对照组比较,含量减少的点有93、375、399、423、451、1098和1992(图4,以点399为代表)。
图3 点38的双向凝胶电泳图
图4 点399的双向凝胶电泳图
4.差异蛋白质谱鉴定结果:质谱鉴定出有意义的蛋白,且通过UniProt数据库查询与细胞毒性相关的上调蛋白4个,下调蛋白 3个,结果见表1。
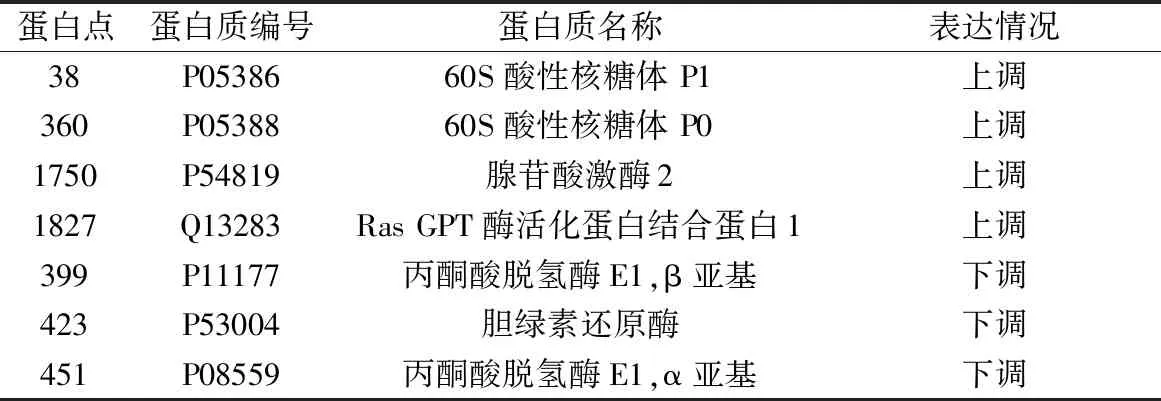
表1 差异蛋白质谱鉴定结果
讨 论
真核生物60S酸性核糖体蛋白(60S acidic ribosomal protein)大亚基上有P0、P1和P2 3种核糖体蛋白,由于它们的等电点在酸性范围内,且通常又被一些蛋白激酶磷酸化,故称为酸性核糖体P蛋白。这些蛋白质在核糖体上形成由五聚体复合物(P1/P2)2-P0组成的向外凸出的茎区结构,此茎区与核糖体上的28S rRNA的一个保守结构域共同形成一个GTPase相关位点,并在蛋白质翻译延伸过程中起重要作用。研究表明酸性核糖体蛋白P参与蛋白质的合成,维持生命稳定性,还具有参与DNA修复,细胞发育和细胞分化等调控过程。此外,酸性核糖体P蛋白还与肿瘤的发生、发展、细胞凋亡以及许多疾病有关[12,13]。
ROS是氧的某些代谢产物和一些反应的含氧自由基,在生理状态下,机体产生的自由基与抗氧化防御系统处于相对平衡。在病理状态下,机体产生大量自由基,会造成细胞结构和功能破坏。KTZ能增加人肝细胞的胞内ROS,从而诱导人肝细胞凋亡。腺苷酸激酶2(adenylate kinase 2,AK2) 是位于线粒体内膜中的腺苷酸激酶亚型,其mRNA在肝脏、心脏、骨骼肌和胰腺中含量较高,在肾脏、胎盘和大脑中略少。但是,AK2蛋白在肝脏、肾脏和心脏中高表达,在肺和骨骼肌中低表达。该酶在线粒体中的定位表明其在细胞增殖和凋亡的能量需求中起重要作用。在凋亡过程中,AK2能与Fas相关死亡域蛋白和caspase-10结合形成复合物从而激活一种新的细胞凋亡通路,但其具体机制仍不清楚[14]。
Ras GPT酶活化蛋白结合蛋白1 (ras GTPase-activating protein-binding protein 1,G3BP1)具有结合ATP、DNA、mRNA和RNA的活性,具有依赖ATP的DNA和RNA解螺旋酶活性以及核酸内切酶活性。有研究表明G3BP1能与HCV病毒的非功能区蛋白5B和反义链RNA的5′-相互作用,可能是 HCV复制复合物的一个组成部分[15]。本研究中Ras GPT酶活化蛋白结合蛋白1的上调可能与KTZ导致的细胞凋亡过程有关,具体机制仍待深入研究。
丙酮酸脱氢酶复合体(pyruvate dehydrogenase complex,PDHc)主要由丙酮酸脱氢酶(E1)、二氢硫辛酸乙酰转移酶(E2)、二氢硫辛酸脱氢酶(E3)和一些辅助因子组成的多酶复合物,E1亚单位是由两个α亚基和两个β亚基组成的异构四聚体。E1、E2和E3以首尾相连的形式将丙酮酸不可逆的氧化脱羧,将乙酰基转移给辅酶A,从而形成重要的物质乙酰辅酶A,在细胞线粒体呼吸链能量代谢中起重要作用。临床上,丙酮酸脱氢酶E1α亚基突变或者磷酸化是丙酮酸脱氢酶缺乏的主要原因,也是儿童乳酸酸中毒和早发性、退行性、神经变性病的最常见的病因。此外,在两个病例中发现由E1β亚基缺陷导致的乳酸酸中毒和肌张力低下[16]。 本研究中细胞毒性发生时,E1 α亚基和 β亚基表达均增强,可能与细胞呼吸链能量代谢变化有关。
血红素是血红蛋白和其他血红素蛋白的辅基,当血红素蛋白降解时,血红素几乎转变成胆红素和一氧化碳。这一转变过程是由血红素加氧酶和胆绿素还原酶(biliverdin Ⅸ alpha reductase)催化完成。胆绿素还原酶是一种胞质酶,哺乳动物的胆绿素还原酶的相对分子质量约为34000,且为单体分子。在NAD(P)H存在时,胆绿素还原酶能将胆绿素IXα还原成胆红素Ixα[17]。肝细胞毒性发生时胆绿素还原酶下调,可能与细胞凋亡过程有关。
本研究用蛋白组学技术鉴定出与细胞毒性相关的上调蛋白4个,下调蛋白3个,提示KTZ诱导细胞毒性发生时,细胞内发生了一系列复杂的变化,包括基因表达变化、能量代谢变化和血红素代谢变化。这些差异性蛋白可能在药物毒性诱导的肝细胞凋亡过程中发挥重要作用,这也是KTZ细胞毒性机制研究的重要方向。
