下调CD36在心肌中的表达对肥胖小鼠心肌纤维化和凋亡的影响
2019-11-04钱润芳陈俊婷周佳莉张逸杰
陶 静 钱润芳 陈俊婷 周佳莉 夏 巍 张逸杰
肥胖是一种慢性代谢性疾病,主要表现为体脂含量的增加,其发生率在全球均呈上升趋势。临床上通常将体重指数>30kg/m2定义为肥胖。世界卫生组织(WHO)的调查报告显示,当前全球约有5亿肥胖症患者[1]。该疾病已超越营养不良,成为全球成年人最大的慢性健康问题[2]。虽然我国肥胖的发生率低于美国、英国等发达国家,但由于人口基数大,患病人群的绝对数量仅次于美国,居世界第2位[3]。病理性肥胖是导致劳力丧失和死亡的主要原因之一,不仅影响到成人,而且影响到儿童和青少年[2]。
肥胖与心血管疾病的发生密切相关,是高血压、冠心病、2型糖尿病等疾病的高风险因素,其患病人群多合并高脂血症、胰岛素抵抗等代谢紊乱,可引起不同器官的病理改变[4~6]。即使排除其他心血管病危险因素,肥胖患者心肌也可出现广泛病变而导致心脏重构,表现为从舒张性心力衰竭(以下简称心衰)到收缩性心衰的演变[7]。
心肌细胞在生理状态时主要通过脂肪酸(fatty acids, FA)的β氧化及葡萄糖的有氧氧化供能。肥胖或糖尿病时,机体发生胰岛素抵抗,心肌细胞对葡萄糖的利用率降低,更加依赖FA的β氧化供能,对FA的转运及利用效率均提升[8]。这种能量代谢谱的改变使得心肌内有害脂质蓄积、代谢副产物生成增多,通过脂毒性效应及氧化应激损伤,介导心肌纤维化、心肌细胞凋亡及钙调控异常等一系列病理改变,最终导致肥胖性心肌病[9~11]。因此,改变肥胖状态下心肌细胞FA的代谢率,可能成为治疗肥胖性心肌病的一种策略。
脂肪酸转位酶又称为CD36,是FA分解代谢过程中的限速酶,分布于心肌细胞膜上及胞质中。位于细胞膜上的CD36负责将FA转运入胞参与β氧化。肥胖或糖尿病时,胞质中的CD36可转移至细胞膜,导致更多的FA摄取入胞参与氧化供能[12]。本研究假设下调肥胖小鼠心肌CD36的表达可降低FA代谢率,改善心肌能量代谢紊乱,进而抑制心肌纤维化,降低心肌细胞凋亡率。为验证该假设,笔者构建了靶向小鼠CD36的重组慢病毒,通过RNA干扰下调其在心肌组织中的表达。
材料与方法
1.实验动物及研究方案:本实验与此前已发表的研究共用同一批实验动物,详见参考文献[10]:4周龄的雄性SPF级C57BL/6小鼠,随机分为3组,即正常对照(N-mock)组、肥胖对照(O-mock)组和肥胖干预(O-CD36)组。研究方案见图1。小鼠4周龄时,依据分组给予相应的喂养方案;6周龄时,通过向小鼠心肌内注射不同的慢病毒以下调目标基因的表达;16周龄时,处死取材,获取左心室组织用于心肌纤维化及凋亡相关指标检测。所有操作均遵循 “3R原则”。
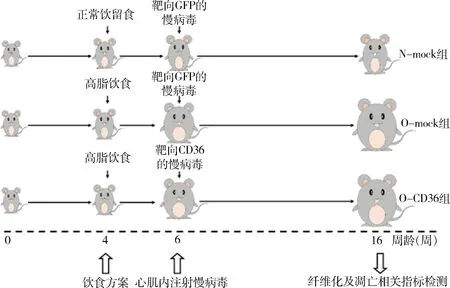
图1 研究方案小鼠自断乳后给予正常饮食,4周龄起根据分组给予不同的饮食方案,6周龄时通过向心肌内注射不同的慢病毒以下调目标基因的表达,16周龄时处死取材完成心肌纤维化和凋亡相关指标检测
2.仪器与试剂:实验用到的仪器包括病理切片机(RM 2016,德国Leica公司)、正置明场显微镜(Eclipse Ci-E,日本Nikon公司)、实时定量PCR仪(CFX96,美国Bio-Rad公司)等。主要试剂包括SYBR Green试剂盒(FP205,北京天根生化科技有限公司)、CD36一抗(sc-9154,美国Santa Cruz公司)、GAPDH一抗(CW0100A,北京康为世纪生物科技有限公司)、caspase-8一抗(66093-1-AP,武汉三鹰生物技术有限公司)、caspase-12一抗(Ab62484,英国Abcam公司)、CHOP一抗(2895,美国CST公司)、β-actin一抗(BM0627,武汉博士德生物工程有限公司)、TUNEL细胞凋亡检测试剂盒(11684817910,瑞士Roche Applied Science公司)。
3.慢病毒制备:分别构建靶向小鼠CD36及绿色荧光蛋白(green fluorescent protein,GFP)的重组慢病毒用于心肌内注射。其中,CD36为本研究中RNA干扰的目标基因,GFP则作为对照,慢病毒靶点序列详见参考文献[10]。
4.心肌内注射介导靶向心肌的RNA干扰:心肌内注射的方法参照本课题组已建立的方法学,在不断肋开胸的情况下,使用微量注射针向每只小鼠左心室肌内注射10μl慢病毒[13]。
5.实时荧光定量RT-PCR:取小鼠左心室组织,提取总RNA后合成cDNA,再按照SYBR Green说明书进行real-time RT-PCR。选取GAPDH作为内参,引物序列如下:TGF-β1正向引物:5′-TTGCTTCAGCTCCACAGAGA-3′,反向引物:5′-TGGTTGTAGAGGGCAAGGAC-3′;TGF-β2正向引物:5′-TGAGTCACAACAGACCAACC-3′,反向引物:5′-TCAATGTAAAGTGGACGTAGGC-3′;CTGF正向引物:5′-GGAAGACACATTTGGCCCAG-3′,反向引物:5′-TAGGTGTCCGGATGCACTTT-3′;Col-Ⅰ正向引物:5′-GGCAAAGATGGAGAAGCTGG-3′,反向引物:5′-GGAAACCTCTCTCGCCTCTT-3′;Col-Ⅲ正向引物:5′-ACGTCCTGGTGAAGTTGGTC-3′,反向引物:5′-CAGGGAAGCCTCTTTCTCCT-3′;GAPDH正向引物:5′-CTCATGACCACAGTCCATGC-3′,反向引物:5′-GGATGACCTTGCCCACAGCC-3′。
6.Western blot法:取小鼠左心室组织,提取总蛋白并进行蛋白定量,经SDS-PAGE分离,电转至PVDF膜,再经一抗、二抗孵育,显影及定影,最终获得凝胶图像。实验中的一抗浓度分别为caspase-8 1∶2000,caspase-12 1∶1000,CHOP 1∶1000,β-actin 1∶200,采用Image J软件分析凝胶图像。
7.Masson染色检测心肌纤维化:Masson染色心肌组织可使胶原纤维呈蓝色,肌纤维呈红色,常用于检测心肌纤维化程度。取小鼠左心室前壁心肌组织固定后制作石蜡切片(4μm),经苏木精、丽春红、苯胺蓝顺序染色,明场下200倍随机拍照,并用Image-Pro Plus 6.0分析胶原纤维的相对着色面积,以反映心肌中胶原含量。
8.TUNEL法分析心肌细胞凋亡率:细胞凋亡时,胞内的DNA碎裂成片段,TUNEL法可有效探测DNA片段的产生,使凋亡细胞呈现棕褐色。取小鼠左心室组织制作石蜡切片(4μm),行TUNEL染色,明场下400倍随机拍照,人工计数TUNEL阳性细胞的比例,以评估心肌细胞凋亡率。
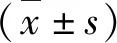
结 果
1.高脂饮食成功诱导小鼠肥胖模型:经过12周的高脂喂养,O-mock小鼠和O-CD36小鼠的体重较正常饮食的N-mock小鼠显著增加,具体数据详见本课题组前期论文[10]。
2.RNA干扰下调了CD36在肥胖小鼠心肌中的表达:real-time RT-PCR和Western blot法的结果提示,高脂饮食对小鼠心肌组织中CD36的表达无明显影响,RNA干扰显著下调了CD36的mRNA和蛋白表达,详见本课题组前期论文[10]。
3.下调CD36的表达改善了高脂饮食相关的心肌纤维化:心脏重构是心衰的基本病理生理机制,而纤维化是心脏重构的重要表现。经12周的高脂饮食,肥胖小鼠心肌组织中胶原纤维的面积占比显著增加(O-mock 6.36%±1.31% vs N-mock 2.88%±0.49%,P<0.01),下调CD36的表达减少了心肌胶原纤维的含量(O-CD36 4.54%±0.41% vs O-mock 6.36%±1.31%,P<0.05),但未降至正常水平(O-CD36 4.54%±0.41% vs N-mock 2.88%±0.49%,P<0.05;图2中A、B)。RT-PCR的结果提示,高脂饮食引起小鼠心肌组织中纤维化相关基因的mRNA表达水平均显著增加:TGF-β1(O-mock 1.44±0.18 vs N-mock 1.00±0.15,P<0.05),TGF-β2(O-mock 3.59±0.25 vs N-mock 1.00±0.09,P<0.01),CTGF(O-mock 2.96±0.27 vs N-mock 1.00±0.14,P<0.01),Col-Ⅰ(O-mock 2.32±0.50 vs N-mock 1.00±0.33,P<0.05),Col-Ⅲ(O-mock 1.88±0.25 vs N-mock 1.00±0.18,P<0.05);下调CD36的表达减轻甚至逆转了高脂饮食所引起的上述改变:TGF-β1(O-CD36 1.15±0.15 vs O-mock 1.44±0.18,P<0.05),TGF-β2(O-CD36 1.54±0.21 vs O-mock 3.59±0.25,P<0.01),CTGF(O-CD36 0.95±0.20 vs O-mock 2.96±0.27,P<0.01),Col-Ⅰ(O-CD36 1.11±0.29 vs O-mock 2.32±0.50,P<0.05),Col-Ⅲ(O-CD36 1.08±0.11 vs O-mock 1.88±0.25,P<0.05;图2中C~G)。
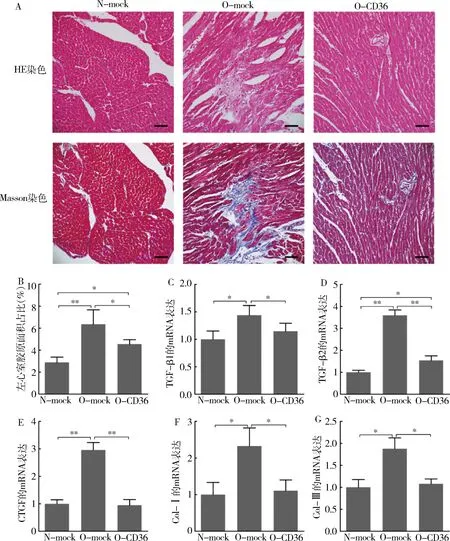
图2 心肌组织纤维化指标检测A.取小鼠左心室组织石蜡包埋后连续切片,分别行HE染色和Masson染色,同一视野下的代表性图片(×200),Masson染色使胶原纤维呈蓝色,肌纤维呈红色,标尺=200μm;B.Masson染色下,胶原纤维占心室组织切片总面积的比值(每组n=4,每只小鼠分析4~5个视野);C~G:使用RT-PCR检测小鼠左心室组织中各种纤维化标志物的mRNA表达水平(每组n=3);*P<0.05,**P<0.01
4.下调CD36的表达减轻了肥胖导致的心肌细胞凋亡:心肌细胞是不可再生细胞,其凋亡使得参与做功的心肌细胞绝对数量减少,将促进心脏重构的发生、发展。TUNEL染色的结果提示,肥胖引起小鼠心肌细胞凋亡率增加(O-mock 3.76%±0.44% vs N-mock 0.54%±0.35%,P<0.01),下调CD36的表达减轻了心肌细胞凋亡率(O-CD36 2.14%±0.40% vs O-mock 3.76%±0.44%,P<0.01),但未完全降至正常水平(O-CD36 2.14%±0.40% vs N-mock 0.54%±0.35%,P<0.01;图3中A、C)。Western blot法检测结果提示,肥胖小鼠心肌组织内凋亡相关蛋白的表达上调:caspase-8(O-mock 1.94±0.26 vs N-mock 1.00±0.21,P<0.05),caspase-12(O-mock 1.74±0.18 vs N-mock 1.00±0.12,P<0.01),CHOP(O-mock 3.14±0.48 vs N-mock 1.00±0.22,P<0.01);下调肥胖小鼠心肌CD36的表达改善甚至逆转了上述异常:caspase-8(O-CD36 1.21±0.25 vs O-mock 1.94±0.26,P<0.05),caspase-12(O-CD36 0.99±0.20 vs O-mock 1.74±0.18,P<0.01),CHOP(O-CD36 1.80±0.22 vs O-mock 3.14±0.48,P<0.01,图3中B、D~F)。
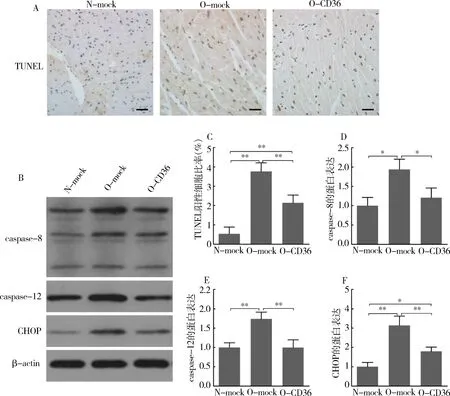
图3 心肌细胞凋亡相关指标检测A.小鼠TUNEL染色左心室组织切片(×400),凋亡细胞呈现棕褐色,标尺=100μm;B.Western blot法检测凋亡相关蛋白,以β-actin作为内参;C.TUNEL阳性细胞占心肌细胞总数的比率(每组n=4,每只小鼠分析4~5个视野);D~F.Western blot法定量分析结果显示各种凋亡相关基因的蛋白表达水平;*P<0.05,**P<0.01
讨 论
包括本课题组前期研究在内的大量资料表明,肥胖或糖尿病时,机体发生胰岛素抵抗,心肌细胞对葡萄糖利用率降低,更加依赖FA氧化供能,这种能量代谢谱的转变引起内质网应激、钙调控异常、线粒体超微结构改变等一系列病理生理效应,最终影响心肌的舒缩功能而导致心脏重构[8~11,14,15]。肥胖性心肌病患者早期常表现为射血分数保留型心衰(HFpEF),又称舒张功能不全,主要表现为左心室顺应性下降及僵硬度增加[4]。纤维化是HFpEF时常见的病理改变。然而,高脂饮食在诱导机体肥胖的同时是否促进心肌纤维化的发生尚不清楚;此外,心脏重构往往涉及心肌细胞凋亡,因而本实验将凋亡相关指标也纳为研究内容。
本研究旨在通过下调肥胖小鼠CD36表达,减少其所介导的心肌FA高代谢率,并观察此干预对纤维化及凋亡的影响。笔者的前期研究已经证实,高脂饮食可成功诱导小鼠肥胖模型,而慢病毒介导的RNA干扰可显著下调肥胖小鼠心肌中CD36的表达[10]。
Masson染色证实,肥胖引起心肌组织胶原纤维的含量显著增加;TGF-β1、CTGF、Col-Ⅰ等纤维化标志物的mRNA表达上调也支持该结论。下调CD36的表达虽未完全逆转,但显著改善心肌纤维化程度;与之相印证,心肌纤维化标志物的mRNA表达也相应下调(图2)。TUNEL染色的结果提示,高脂饮食导致心肌细胞凋亡率增加,并引起caspase-8、caspase-12、CHOP等凋亡相关蛋白的表达上调;干扰CD36在心肌中的表达减轻甚至逆转了上述异常(图3)。
现有研究表明,肥胖导致心肌纤维化可能有多种机制参与:(1)心肌细胞过度依赖FA氧化供能,代谢副产物活性氧簇生成增多,通过氧化应激损伤肌质网,后者摄取和释放钙离子的能力是引起心肌细胞舒张和收缩的关键因素,肌质网钙调控异常及胞质内钙超载将损害左心室舒张和收缩功能,促进心肌纤维化[16]。(2)肥胖导致机体血管床面积增大,交感神经兴奋并激活RAAS系统,引起水钠潴留,左心室容量和压力负荷均增加,介导心室重塑和心肌纤维化。(3)神经体液因子激活,介导炎性反应引起心肌损伤,促进成纤维细胞的增殖加剧心肌纤维化[17]。(4)脂肪细胞相对缺氧,促进免疫细胞的迁移和激活,促进脂肪组织纤维化,后者与心肌纤维化密切相关[18]。(5)分子机制,包括GSK-3β的表达下调,TGF-β、内皮素1、晚期糖基化终产物、基质细胞蛋白上调也在纤维化的发生中起重要作用[11]。本课题组的前期研究证实,下调CD36的表达可显著抑制肥胖小鼠心肌细胞内活性氧簇的生成,并改善心肌细胞钙调控异常[10,14]。因此,干扰CD36的表达以改善肥胖所导致的心肌纤维化,有其理论基础。
衰老是引起心肌纤维化的另一个重要因素,笔者的研究周期仅12周,虽然肥胖小鼠已表现出纤维化的趋势,但整体程度并不强烈(纤维化面积占比6.36%),如果延长饲养周期,心肌纤维化的程度可能更加明显。
内质网是真核细胞内蛋白质翻译合成以及钙离子储存的场所,对细胞应激反应起调节作用。内质网应激实质上是细胞对外界有害刺激的一种应答,其最终结果是对刺激的适应或凋亡[19]。当有害刺激持续,超出细胞的调节能力时,内质网应激将经由CHOP、caspase-12、JNK 3条途径介导细胞凋亡[20]。肥胖时心肌内活性氧簇的过度生成可损伤内质网,引起内质网应激并介导凋亡。本研究结果亦证实,肥胖导致CHOP和caspase-12的表达上调,心肌细胞凋亡率增加,下调CD36的表达从起始环节抑制活性氧簇的生成,减少了心肌细胞的凋亡。
综上所述,CD36在肥胖所致的心脏重构中起重要作用,下调CD36的表达可改善心肌纤维化,减少心肌细胞凋亡,是一种潜在的治疗代谢性心脏重构的有效手段。
