参仁活血颗粒对四氯化碳诱导的大鼠肝纤维化TGF-β1/Smad信号通路的影响
2019-10-31彭孟云陈然朱晓宁汪静
彭孟云,陈然,朱晓宁,汪静*
(1. 西南医科大学附属中医医院肝胆病科,四川 泸州 646000; 2. 西南医科大学,四川 泸州 646000)
肝纤维化(hepatic fibrosis,HF)是指各种致病因子长期反复刺激肝,导致细胞外基质(extracellular matrix,ECM)沉积于肝的一种慢性肝损伤的修复反应,是导致肝硬化、肝癌等终末期肝病的主要原因[1]。转化生长因子(transforming growth factor,TGF)-β1被认为是HSCs激活过程中最重要的因子,在肝纤维化形成中发挥重要作用,Smad 蛋白(drosophila mothers against decapentaplegic protein)是TGF-β1 信号传至核内关键的下游信号分子, TGF-β1通过激活下游介质Smad2和Smad3发挥其促肝纤维化的作用,研究表明四氯化碳(carbon tetrachloride,CCl4)诱导的肝纤维化小鼠中Smad2/3表达明显升高[2]。而Smad7作为TGF-β1/Smad信号通路的负调控因子,主要通过与Smad3竞争性抑制中断TGF-β1信号转导以抑制肝纤维化进展,敲除Smad7基因可促进小鼠肝纤维化的发生[3],表明TGF-β1/Smad 信号通路及相关的细胞因子在肝纤维化中发挥重要作用。
中医并无“肝纤维化”这一病名,常将其隶属“积聚”范畴。全国名中医孙同郊教授根据数十年治疗肝纤维化的临床经验,认为气虚血瘀是本病的基本病机,以补气扶正、活血化瘀为基本治疗,在此基础上自拟了具有益气活血化瘀功效的的参仁活血颗粒用于治疗肝纤维化,临床疗效显著。本研究采用参仁活血颗粒治疗肝纤维化大鼠,观察参仁活血颗粒对肝纤维化大鼠TGF-β1/Smad信号通路的调节作用,探讨参仁活血颗粒治疗肝纤维化的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
6周龄清洁级雄性SD大鼠50只,体重(200 ± 20) g,购自西南医科大学实验动物中心【SCXK(川) 2018-065】,饲养于西南医科大学动物实验中心【SYXK(川) 2018-065】,标准饲料喂养,自由饮水。大鼠均分笼饲养,每笼5只,光照与黑暗各12 h交替处理,湿度为50% ~ 60%,温度为20 ~ 22°C,适应性喂养1周。
1.1.2 实验药物和试剂
参仁活血颗粒由西南医科大学附属中医医院制剂室制备(规格:10 g/袋,批号:20150814);四氯化碳(批号:2016062301)购自成都市科龙化工试剂厂;TGF-β1抗体、Smad3抗体、Smad7抗体、CollagenⅠ抗体及Collagen Ⅲ抗体均购自美国Abcam公司;总RNA提取试剂盒(离心柱型)购自北京天根生化科技有限公司;逆转录试剂盒购自康为世纪生物科技有限公司;SYBR Green Real-time PCR Master Mix购自日本Toyobo公司;RIPA裂解液(强)及PMSF购自碧云天生物技术公司。
1.1.3 主要设备与仪器
超低温冰箱(美国Thermo公司);正置荧光显微镜(日本Nikon公司);高速低温离心机(美国Sigma公司);实时荧光定量 PCR仪(德国Eppendorf公司);PCR扩增仪、全能型蛋白转印系统、凝胶扫描成像系统及荧光化学发光图像分析仪均来自美国Bio-Bod公司。
1.2 方法
1.2.1 动物分组、造模及给药
50只雄性SD大鼠随机分为参仁活血颗粒低剂量组、参仁活血颗粒中剂量组、参仁活血颗粒高剂量组、正常组及模型组,每组10只,均予以标准饲料喂养,均正常自由活动和饮用自来水。正常组腹腔注射生理盐水1 mL/kg,2次/周,共8周;模型对照组及中药各组均给予40%四氯化碳0.2 mL/100 g,腹腔注射,2次/周,共8周。于第4周开始分别给予参仁活血颗粒低[每日1.575 g/(kg·bw)]、中[每日3.15 g/(kg·bw)]、高 [每日6.3 g/(kg·bw)) 剂量灌胃,于第8周牺牲。
1.2.2 肝病理学与免疫组化观察
取新鲜肝固定脱水包埋后切片,HE染色及Masson染色观察大鼠肝纤维化程度。免疫组化检测大鼠肝TGF-β1、collagenⅠ、collagen Ⅲ的表达。
1.2.3 Real-time PCR检测大鼠肝TGF-β1、Smad3、Smad7 mRNA的表达
引物由上海生工生物公司合成,TGF-β1(120 bp)上游5’ATTCCTGGCGTTACCTTGG3’,下游5’AGCCCTGTATTCCGTCTC CT3’;Smad3(110 bp)上游5’GAGACATTCCACGCTTCACA3’,下游5’GCTGCATTCCGGTTAACATT3’;Smad7(128 bp)上游5’GTGGC ATACTGGGAGGAGAA3’,下游5’TTGTTGTCCGAATTGAGCTG3’; β-actin(150 bp)上游5’CCCATCTATGAGGGTTACGC3’,下游5’TTT AATGTCACGCACGATTTC3’。提取肝组织RNA,1%琼脂糖凝胶电泳检测RNA完整性,逆转录为cDNA,按SYBR Green Real-time PCR Master Mix试剂盒进行Real-time PCR,反应条件:95℃ 15 s(变性)、55℃ 10 s(退火)、72℃ 20 s(延伸),循环40次,目的基因的表达量使用2-△△ct法计算。
1.2.4 Western blot检测大鼠肝TGF-β1、Smad3、Smad7蛋白的表达
100 mg的肝组织加入900 μL配置好的RIPA 裂解液提取总蛋白,BCA试剂盒测定蛋白浓度,蛋白热变性后经SDS-PAGE电泳分离并转膜到PVDF膜上,5%脱脂牛奶封闭1 h, TBST摇洗膜,加入稀释好的一抗4℃孵育过夜,TBST洗膜,稀释好的二抗常温孵育1 h,TBST洗膜,于PVDF膜正面加适量HRP substrate显影液,在BioRad GelDocXR仪器上进行信号检测,利用Gel-Pro Analyzer 软件分析。
1.3 统计学分析
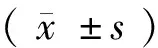
2 结果
2.1 HE染色及Masson染色观察大鼠肝病理改变
正常组大鼠肝小叶结构清晰、完整,肝细胞排列整齐,未见细胞坏死。模型组大鼠肝小叶结构严重破坏,肝细胞排列错乱,存在不同程度的小叶内坏死、碎屑样坏死及桥接坏死,大量胶原沉积,假小叶形成。参仁活血颗粒低、中剂量组肝小叶结构分别呈中-重度、轻-中度破坏,肝细胞排列不整齐,存在不同程度的炎性细胞浸润及细胞坏死,纤维结缔组织增生,其中低剂量组胶原较多沉积,中剂量组胶原沉积较前减少。而高剂量组可见部分接近正常的肝小叶结构,少量纤维结缔组织增生,纤维化程度较模型组明显改善。(图1、图2)。
2.2 各组大鼠肝TGF-β1、collagenⅠ、collagen Ⅲ的表达
正常组大鼠肝TGF-β1、collagenⅠ、collagen Ⅲ无阳性表达意义,模型组大鼠肝collagenⅠ、collagen Ⅲ及TGF-β1较正常组显著表达,而参仁活血颗粒各剂量TGF-β1、collagenⅠ、collagen Ⅲ表达均较模型组降低,且表达程度与剂量呈负相关,以参仁活血颗粒高剂量组疗效最显著(图3、图4、图5)。

注:A 正常组;B 模型组;C 中药低剂量组;D 中药中剂量组;E 中药高剂量组。(下图同)图1 各组大鼠肝HE染色Note. A. Control group. B. Model group. C. Low-dose SRHX group. D. Middle-dose SRHX group. E. High-dose SRHX group.(The same in the following figures)Figure 1 Pathological changes in liver tissues of the rats in each group(HE staining)
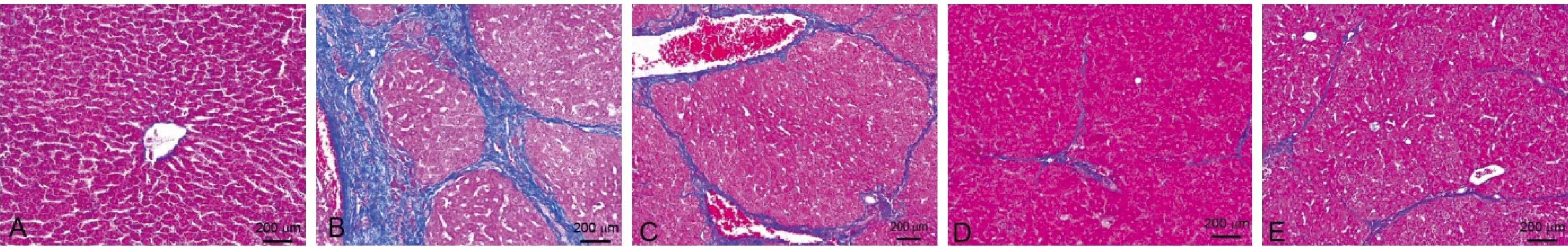
图2 各组大鼠肝Masson染色Figure 2 Liver fibrosis in the rats of different groups(Masson staining)
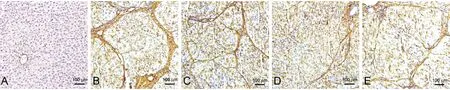
图3 各组大鼠肝collagenⅠ的表达Figure 3 Expression of collagenⅠin liver tissues of the rats in each group
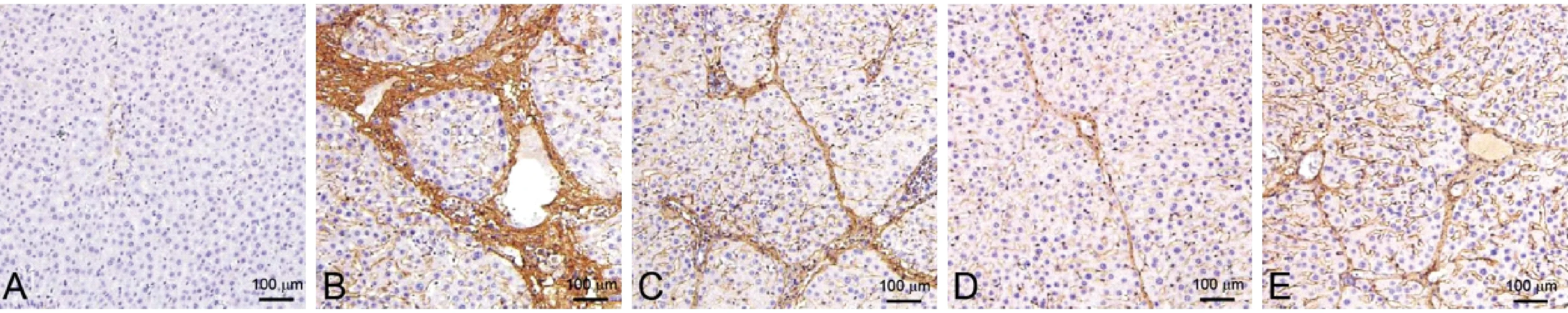
图4 各组大鼠肝collagenⅢ的表达Figure 4 Expression of collagen Ⅲ in liver tissues of the rats in each group

图5 各组大鼠肝TGF-β1的表达Figure 5 Expression of TGF-β1 in liver tissues of the rats in each group
2.3 各组大鼠肝TGF-β1、Smad3、Smad7 mRNA表达
与正常组比较,模型组大鼠肝组织TGF-β1、Smad3 mRNA的表达明显升高而Smad7 mRNA的表达明显降低(P< 0.05);参仁活血颗粒各剂量组TGF-β1、Smad3 mRNA的表达较模型组均不同程度降低,以高剂量组效果最佳(P< 0.05)。而参仁活血颗粒各剂量组Smad7 mRNA的表达较模型组明显升高,呈现出与剂量成正相关的上调趋势,以高剂量组表达升高最为显著(P< 0.05)。(见图6)
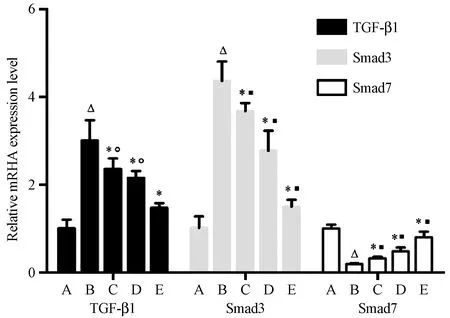
注:与正常组比较,ΔP< 0.05。与模型组比较,*P< 0.05。处理间比较,°P> 0.05。处理间比较,■P< 0.05。(下图同)图6 各组大鼠肝TGF-β1、Smad 3、Smad 7 mRNA表达水平Note. Compared with the normal group, ΔP< 0.05. Compared with the model group, *P< 0.05. Compared between treatments, °P> 0.05. Compared between treatments, ■P< 0.05.(The same in the following figure)Figure 6 Expression of TGF-β1, Smad 3 and Smad 7 mRNA in liver tissues of the rats in each group
2.4 各组大鼠肝TGF-β1、Smad3、Smad7蛋白的表达
与正常组相比,模型组大鼠肝组织中TGF-β1 蛋白的表达明显增加(P< 0.05),与模型组相比,参仁活血颗粒各剂量组大鼠肝组织中TGF-β1蛋白的表达减少(P< 0.05),但参仁活血颗粒高、中、低剂量组之间比较,差异无统计学意义(P> 0.05)。与正常组相比,模型组大鼠肝组织中Smad3 蛋白的表达明显升高而Smad7 蛋白的表达显著下降(P< 0.05);参仁活血颗粒各剂量组大鼠肝组织中Smad3 蛋白的表达较模型组降低而Smad7 蛋白的表达较模型组明显升高,以参仁活血颗粒高剂量组疗效最佳(P< 0.05)。(见图7)
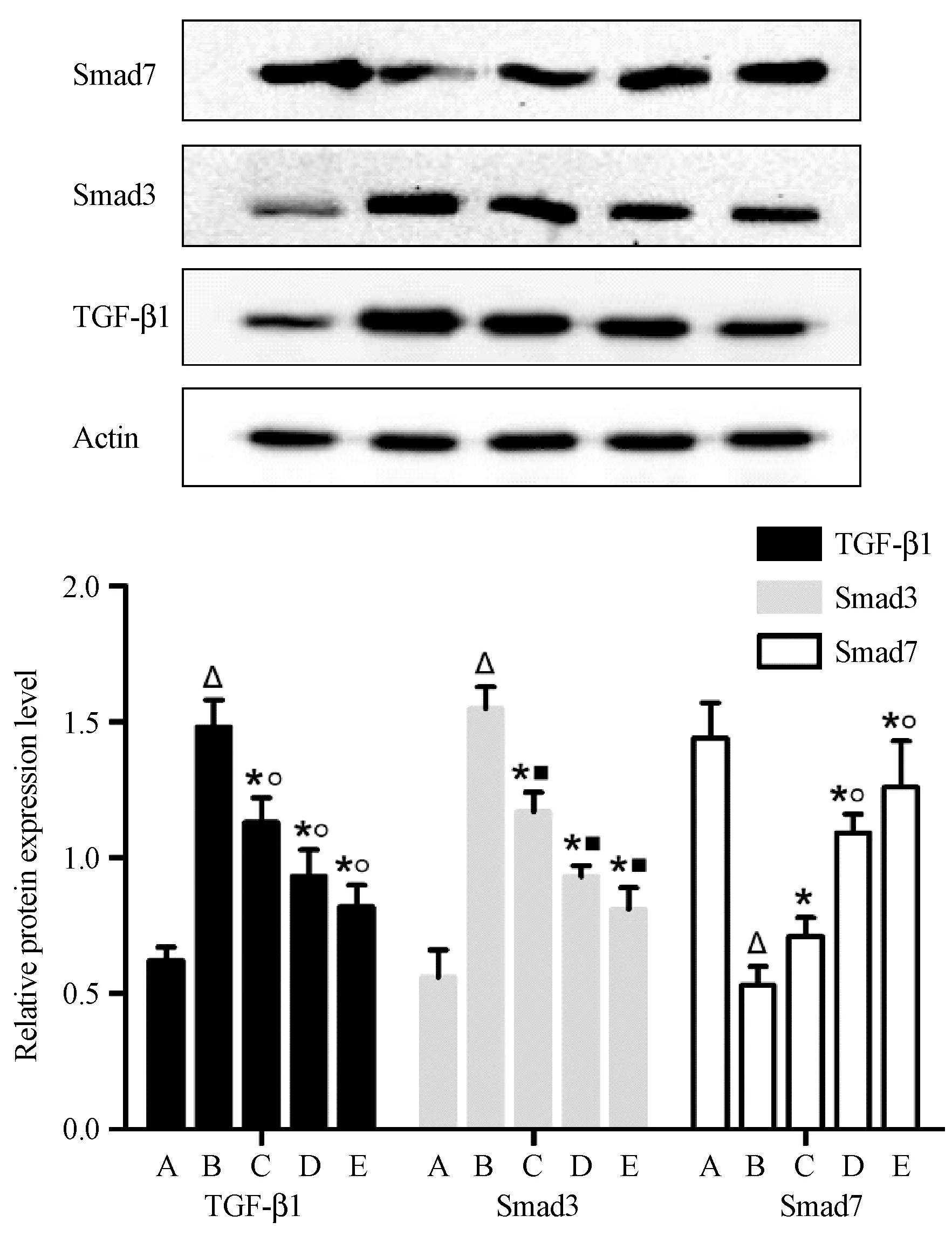
图7 各组大鼠肝TGF-β1、Smad 3、Smad 7蛋白表达Figure 7 Expression of TGF-β1, Smad 3 and Smad 7 proteins in liver tissues of the rats
3 讨论
肝纤维化是肝对各种慢性损伤如肝炎、自身免疫反应、过敏反应、代谢综合征和炎症等的修复反应,以富含I型胶原的ECM在肝内大量合成并沉积为其主要特征,而ECM主要来源于肝星状细胞的激活[4-5]。在各种肝损伤致病因素或血小板衍生生长因子(platelet-derived growth factor,PDGF)、TGF-β、肿瘤坏死因子α(tumor necrosis factor,TNF-α)和白介素1(interleukin,IL-1)等炎症细胞因子的刺激下,HSCs激活是肝纤维化发生发展的关键环节[6-7],导致大量collagen I、collagen III和纤维连接蛋白、透明质酸等ECM成分的产生,最终导致肝纤维化,其中collagen I的沉积量与肝纤维化的严重程度呈正相关。本研究采用CCl4成功构建大鼠肝纤维化模型,模型组大鼠存在大量胶原沉积,纤维间隔增多增宽,假小叶形成,collagen I及collagen III蛋白表达明显升高,而经参仁活血颗粒治疗后,肝胶原沉积减少,肝炎症及纤维化程度明显降低,collagen I、collagen III蛋白的表达较模型组明显降低,以高剂量组疗效最佳,表明参仁活血颗粒具有治疗大鼠肝纤维化的作用。
TGF-β1是目前发现的最重要的致肝纤维化的细胞因子[8],正常情况下肝TGF-β1 的表达极少,而肝损伤时其表达明显增加。Smad作为TGF-β1信号传递的关键下游蛋白,将细胞外信号传至核内,调节核内靶基因的转录,从而发挥TGF-β1的生物效应[9]。TGF-β1先后与TβR II、TβR I结合,激活TβR II磷酸化激酶,TβR I随之磷酸化活化,活化的TβRⅠ催化其下游信号分子Smad2/3蛋白磷酸化,活化的Smad2/3 蛋白构象发生改变,与Smad 4结合形成异源寡聚物转运至细胞核内,增加金属蛋白酶组织抑制剂 (tissue inhibitor of metalloproteinase, TIMP)及胶原纤维等的表达,从而激活HSCs[10];Smad7对TGF-β1信号转导起负调控作用,通过同Smad2/3与Smad4竞争性的结合TβR I从而有效阻断TGF-β1信号转导发挥抗纤维化的作用。经BMP-7 转染日本血吸虫诱导的肝纤维化小鼠模型中,α-SMA、TGF-β1、Smad2、及Smad3的表达均降低,而Smad7的表达明显升高[11]。Smad3基因敲除小鼠肝纤维化相关因子、胶原蛋白表达明显下降,Smad7表达则呈增长趋势[12]。Smad7基因敲除大鼠的HSCs数目增多,ECM大量沉积,而Smad7蛋白表达增加可以抑制HSC增殖及Ⅰ型胶原的产生,抑制肝纤维化的进展[3,13-14]。因此,TGF-β1/Smad信号通路在大鼠肝纤维化的发生发展中起着重要作用,抑制该信号通路及相关细胞因子的表达可能成为治疗肝纤维化的关键点。
中医药在防治肝纤维化的发生发展方面取得了一些重要进展。Yang等[15]采用复方鳖甲软肝片治疗CCl4诱导的肝纤维化大鼠,结果显示该药物能有效抑制TGF-β/Smad信号通路的激活,从而达到治疗肝纤维化的目的。Li等[16]研究发现由冬虫夏草菌丝体多糖(CS-PS),绞股蓝总皂苷和苦杏仁苷组成CGA中药配方能显著改善DMN诱导的大鼠肝纤维化,其作用机制可能与CGA中药配方能显著降低DMN诱导的纤维化肝组织中α-SMA、TGF-β1、TβRI、p-TβRI、p-TβRII、p-Smad2和p-Smad3蛋白质表达水平相关。Wang等[17]发现扶正化瘀方能显著降低MCD构建的脂肪性肝炎纤维化小鼠TGF-β1,Smad3和Smad4的表达,并进一步上调Smad7的表达,其机制可能与扶正化瘀方抑制TGF-β1/Smad通路中涉及的细胞因子的表达从而中断肝纤维发生中的正反馈环相关。本次实验结果显示,参仁活血颗粒能显著降低肝纤维大鼠肝TGF-β1及Smad3的表达,上调Smad7的表达,说明TGF-β1/Smad信号通路是参仁活血颗粒治疗肝纤维的作用机制之一。进一步分析研究结果,发现参仁活血颗粒中、高剂量组之间TGF-β1、Smad7 mRNA的表达差异有统计学意义(P< 0.05),而两组之间Smad7蛋白表达差异无统计学意义(P> 0.05)。这可能是由于DNA中遗传信息的表达必须经过中介产物,即转移到mRNA上,才被用于指导蛋白质的生物合成,而mRNA将遗传信息转移到蛋白质合成系统中,需经形成起始物、活化氨基酸、合成肽链的起始部分、肽链的延伸和终止、蛋白质的加工多个步骤最终才能完成蛋白质的合成,若此过程中任一条件受干扰均可影响蛋白的合成,导致蛋白合成受阻所致。通过本次研究,可得出结论:参仁活血颗粒具有显著的抗肝纤维化的疗效,其机制可能与参仁活血颗粒抑制TGF-β1、Smad3的表达,上调Smad7的表达,抑制TGF-β1/Smad信号通路激活,减少HSCs的生成,从而减少collagenⅠ及collagen Ⅲ等细胞外基质的合成相关。