经皮致敏小鼠肠道过敏模型的建立与评价
2019-10-31费巧玲齐睿娟张小雨高源韩宜芯李西蒙蔡润兰齐云
费巧玲,齐睿娟,张小雨,高源,韩宜芯,李西蒙,蔡润兰,齐云
(中国医学科学院 & 北京协和医学院药用植物研究所,北京 100193)
食物过敏在全球的发病率逐年上升,严重影响儿童生活质量。据研究报道,我国31个城市0 ~ 14岁儿童食物过敏的总患病率为5.83%,其中学龄前儿童(3 ~ 5岁)患病率最高(6.65%)[1],鸡蛋、牛奶等是最常见的食物过敏原[2]。食物过敏引起的疾病常常影响儿童生长发育, 并可能成为其他过敏性疾病的诱因[3]。由于食物过敏发病机制复杂,受遗传背景、环境因素、暴露条件等诸多因素的影响,利用食物过敏原建立动物模型来寻求新的预防和治疗措施是最为常用的研究方法。
目前,国内研究报道的食物过敏动物模型大多数采用腹腔注射食物大分子蛋白(如卵清蛋白、花生蛋白等)的致敏方式[4],加以灌胃攻击[5]。此种致敏方式虽然能够增加过敏原特异性 IgE 抗体,但其诱导的肠道病理改变并不明显[6]。而在临床上,研究者早已发现皮肤炎症与食物过敏之间存在密切的关联性,如特应性皮炎患者中IgE介导的食物过敏的发生率为15% ~ 40%[7]。近年来,国际上已出现采用皮肤接触过敏原诱导小鼠食物过敏的新方法[8],但国内尚未见相关研究。本文旨在建立经皮致敏小鼠肠道过敏的模型,以血浆tIgE水平评价全身过敏情况,以灌胃OVA攻击后血浆mMCP-1水平评价肥大细胞脱颗粒程度,初步判断经皮致敏肠道攻击优于腹腔致敏肠道攻击后,以经由耳部皮肤的致敏方式建立模型,考察该模型的病理特点,寻找其标志性的指标。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级BALB/c小鼠,雌性,6 ~ 8周龄,由北京维通利华实验动物技术有限公司提供【SCXK(京)2016-0006】。相关动物实验均在中国医学科学院药用植物研究所SPF级动物实验室进行无菌操作【SYXK(京)2017-0020】。小鼠全部饲养于独立通气笼内,饲养环境:昼夜各半交替,温度 18 ~ 25℃,湿度 50% ~ 70%。垫料、饲料和饮水均经过高温高压灭菌后使用。动物实验开展经中国医学科学院药用植物研究所实验动物伦理委员会审批(伦理审批号:SLXD-20180604521)。
1.1.2 主要试剂
卵清蛋白(Sigma,A5253),卡泊三醇软膏(爱尔兰利奥制药有限公司,041463-00),mMCP-1 ELISA 试剂盒(Thermo Fisher Scientific,88-7503-22),Mouse IgE ELISA试剂盒(Biolegend,432401),甲苯胺蓝染色液(珠海贝索生物技术有限公司,BA-4125),伊文思蓝(Sigma,E2129)。其余试剂均为分析纯。
1.1.3 主要仪器
微孔板恒温振荡器(MB100-4P,杭州奥盛仪器有限公司,中国),智能温度记录仪(TH-212,北京鸿鸥成运科技有限公司,中国),酶标仪(Type354,Thermo,美国),微型高速离心机(Spin 218, 北京东迅天地医疗仪器有限公司,中国),电动玻璃匀浆器(DY89-Ⅱ,宁波新芝生物科技有限公司,中国),数字病理扫描仪(Aperio CS2,Leica,德国)。
1.2 方法
1.2.1 小鼠肠道过敏模型三种不同致敏方式的比较
将雌性BALB/c小鼠随机分为三组,每组10只,分别采用三种不同的致敏方式。致敏方式一(传统的腹腔致敏):于0,7,13 d腹腔注射100 μg OVA(含有等体积的铝佐剂)[9];致敏方式二(经典的经皮致敏):脱去小鼠背部毛,于0 d在背部皮肤贴上1 cm × 1 cm纱布补丁(补丁中含有200 μg OVA,100 μL PBS溶解),每24 h更换补丁,于13 d撤去补丁[8];致敏方式三(皮损经皮致敏):将OVA与卡泊三醇软膏按重量比1∶100均匀混合,每只小鼠耳部皮肤涂以20 mg含有200 μg OVA的软膏混合物,连续13 d[10]。三组小鼠于14 d禁食3 h后,均灌胃OVA攻击,50 mg/只。攻击后1 h,采集小鼠尾尖血液,比较三组小鼠血浆中tIgE 和 mMCP-1 水平。
1.2.2 行为学观察及直肠温度测定
以下研究均采用经由耳部皮肤的致敏方式。设对照组与模型组,每组10只BALB/c小鼠。模型组小鼠耳部皮肤涂以混合OVA的卡泊三醇软膏,对照组小鼠耳部皮肤涂以等量不含OVA的卡泊三醇软膏,连续两周。对照组及模型组小鼠于14 d灌胃50 mg OVA 攻击后15 min 测定小鼠直肠温度[11]。在灌胃OVA攻击后1 h 内观察小鼠过敏症状,记录出现过敏症状的小鼠只数,过敏症状评价指标有:快速搔抓和摩搓鼻周围及挠头(> 10次)、弯成弓状及腹泻[12]。
1.2.3 血浆tIgE及mMCP-1测定
用ELISA方法测定灌胃攻击前对照组及模型组小鼠血浆中tIgE及mMCP-1水平,以及灌胃攻击后1 h、24 h血浆中tIgE及mMCP-1水平[13]。
1.2.4 小鼠空肠毛细管炎性渗出实验
另取BALB/c小鼠16只(设对照组及模型组,每组8只),经皮致敏两周后,灌胃OVA(50 mg/只)。攻击后5 min,尾静脉注射伊文思蓝(20 mg/kg)。3.5 h后,小鼠用戊巴比妥钠(20 mg/kg)麻醉后用10 mL PBS进行心脏灌流。取空肠组织10 cm,称湿重,用500 μL N, N-二甲基甲酰胺37°C萃取过夜。次日,将萃取液室温离心(14 000 r/min,15 min),上清在620 nm处测定吸光度。以伊文思蓝的N, N-二甲基甲酰胺溶液作标准曲线,根据标准曲线计算萃取液中伊文思蓝含量。小鼠空肠组织毛细血管渗透性以萃取液中伊文思蓝含量/组织湿重表示[14]。
1.2.5 组织病理检测
小鼠经皮致敏灌胃OVA攻击后于胃下方8 ~ 10 cm处取一段空肠组织,在中性福尔马林中固定并用石蜡包埋。组织切片分别用伊红-苏木精(Hematoxylin-eosin,HE)和甲苯胺蓝染色。计数至少十个高清视野(high-power field, HPF, × 200)下肥大细胞的数目。其测定值以每十个高清视野下的平均细胞数表示[11]。
1.3 统计学分析
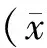
2 结果
2.1 小鼠肠道过敏模型三种不同致敏方式的比较
在小鼠肠道过敏模型的建模方法中,经皮致敏(耳部和背部皮肤)方式相比于传统的腹腔致敏方式,能使小鼠OVA灌胃攻击后1 h血浆中tIgE和mMCP-1水平显著升高(P< 0.01)(图1),但耳部和背部皮肤致敏的两种方式之间没有显著差异(P> 0.05)。由于耳部致敏方式较背部致敏更简便易行,故在后续实验中均采用耳部皮肤致敏方法。
2.2 经皮致敏肠道攻击对小鼠过敏症状的影响
小鼠常见的肠道过敏症状根据其程度不同会出现快速搔抓和摩搓鼻周围及挠头(> 10次)、腹泻、弯成弓状、不动,甚至休克死亡。经皮致敏的小鼠在灌胃OVA攻击之后约20 min开始出现过敏反应的症状。 60%的模型组小鼠出现明显的快速搔抓和摩搓鼻周围及挠头(> 10次)、70%出现腹泻(稀便)、80%出现弯成弓状。而对照组小鼠活动自如、毛色光泽、粪便没有变化(图2)。
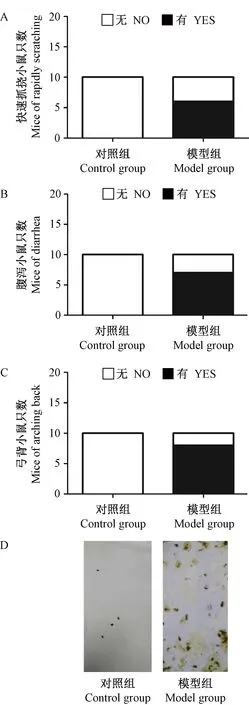
注:经皮致敏小鼠灌胃OVA攻击后1 h内出现的过敏症状:A. 快速抓挠;B. 腹泻;C. 弓背;D. 经皮致敏小鼠灌胃OVA攻击后1 h内腹泻图(n=10)。图2 经皮致敏小鼠灌胃OVA攻击后的过敏症状Note. Allergic symptoms of epicutaneously sensitized mice after OVA challenge (i.g.) within 1 h: A. Rapidly scratching. B. Diarrhea. C. Arching back. D. The images of diarrhea of epicutaneously sensitized mice after OVA challenge (i.g.) within 1 h (n=10 mice per group).Figure 2 Allergic symptoms of epicutaneously sensitized mice after OVA challenge (i.g.)
2.3 经皮致敏肠道攻击对小鼠直肠温度及空肠毛细血管炎性渗透的影响
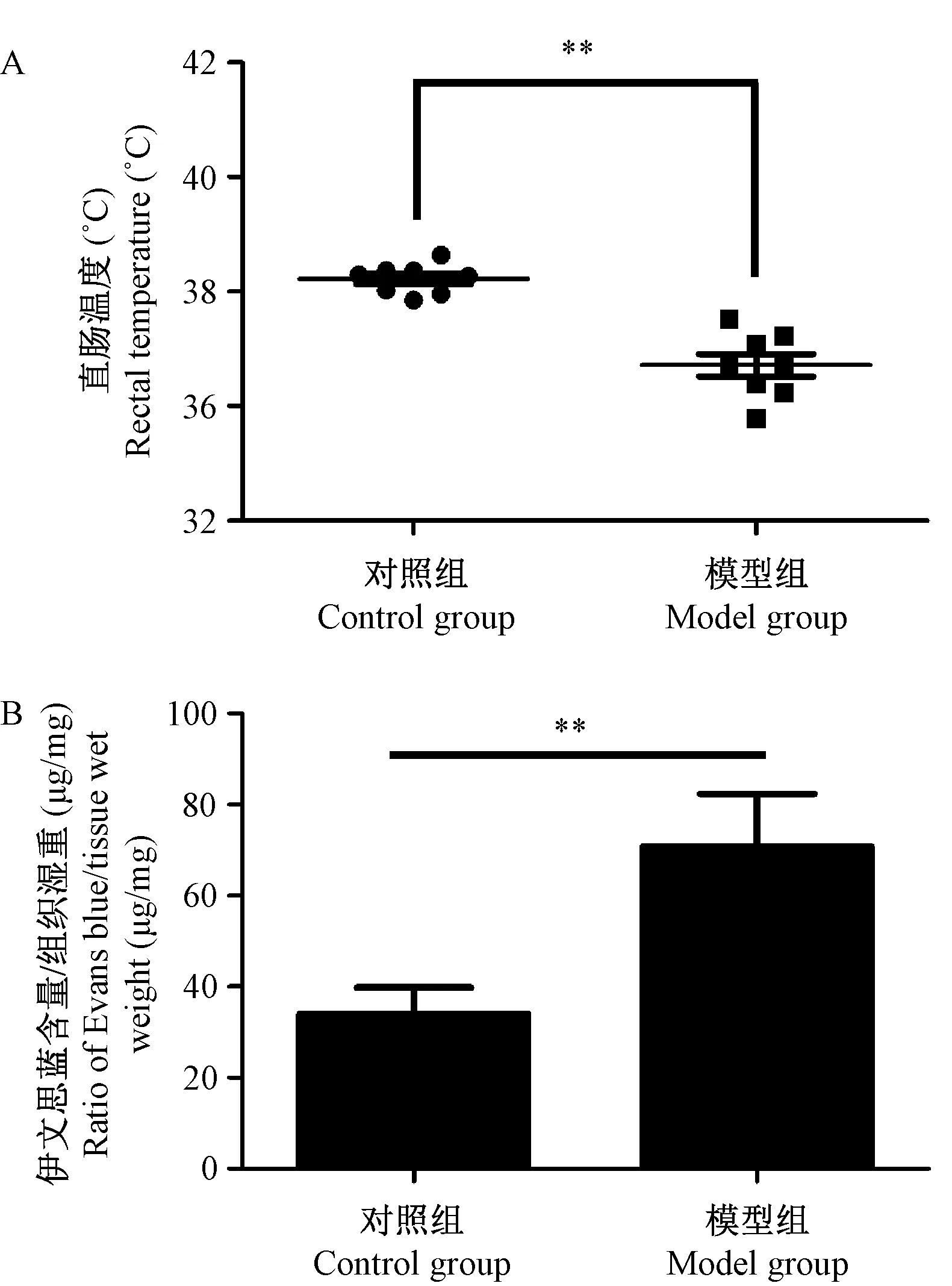
注:A. 经皮致敏小鼠灌胃OVA攻击后15 min直肠温度;B. 经皮致敏小鼠灌胃OVA攻击后3.5 h空肠毛细血管渗透性 ± s, n=8)。与对照组相比,**P < 0.01。图3 小鼠直肠温度和空肠毛细血管渗透性Note. A. The rectal temperature of epicutaneously sensitized mice 15 min after OVA challenge (i.g.). B. The jejunal capillary permeability of epicutaneously sensitized mice 3.5 h after OVA challenge (i.g.). Error bars represent means and SDs (n=8 mice per group). Statistical significance was calculated relative to the control group. **P < 0.01.Figure 3 The rectal temperature and jejunal capillary permeability of the mice
模型组小鼠在攻击后15 min时直肠温度较对照组下降约1.2°C,且有统计学差异(P< 0.01)(图3A)。模型组空肠毛细血管渗出的伊文思蓝的相对含量较对照组显著增加(P< 0.01),约为对照组的2倍(图3B)。
2.4 经皮致敏方式对攻击前后小鼠血浆中tIgE和mMCP-1的影响
在末次经皮致敏之后,灌胃OVA攻击之前,对照组和模型组小鼠血浆中mMCP-1的含量很低,而此时模型组小鼠血浆中tIgE水平较对照组已显著升高(P< 0.01)。攻击后1 h,模型组小鼠血浆中mMCP-1的含量大幅度增加(P< 0.01),而tIgE水平较攻击之前没有显著变化(P> 0.05)。攻击后24 h,模型组小鼠血浆mMCP-1下降至略高于基础水平,而tIgE含量仍维持高水平(图4)。
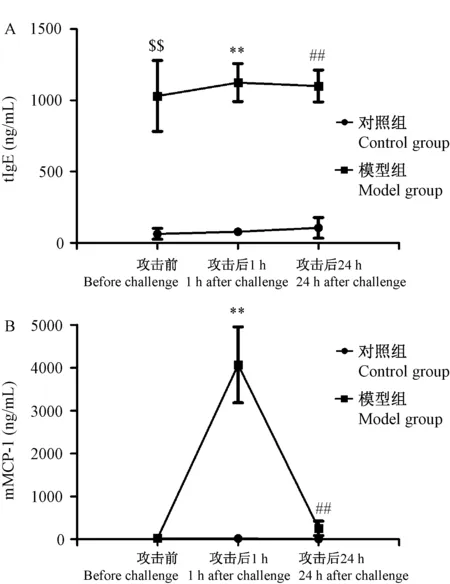
注:A. 经皮致敏小鼠灌胃OVA攻击前、肠道攻击后1 h及24 h血浆IgE水平;B. 经皮致敏小鼠灌胃OVA攻击前、肠道攻击后1 h及24 h血浆mMCP-1水平 ± s, n=8)。模型组与对照组在攻击前、攻击后1 h,攻击后24 h同一时间点的比较分别为:$$ P < 0.01, **P < 0.01, ##P < 0.01。图4 小鼠灌胃OVA攻击前后血浆 tIgE 和 mMCP-1 水平Note. A. Plasma tIgE levels of epicutaneously sensitized mice before, 1 h and 24 h after OVA challenge (i.g.). B. Plasma mMCP-1 levels of epicutaneously sensitized mice before, 1 h and 24 h after OVA challenge (i.g.). Error bars represent means and SDs (n=8 mice per group). Statistical significance was calculated relative to the control group at the same time point. Before challenge, $$ P < 0.01. 1 h after challenge, **P < 0.01. 24 h after challenge, ##P < 0.01.Figure 4 Plasma tIgE and mMCP-1 levels of mice before and after OVA challenge (i.g.)
2.5 经皮致敏肠道攻击小鼠空肠病理改变
经皮致敏灌胃OVA攻击后的小鼠,其空肠下端HE切片显示,对照组小鼠的肠黏膜结构清晰,肠绒毛排列整齐,无明显损伤,无炎症细胞浸润;模型组小鼠与对照组相比,肠黏膜出现轻度糜烂,肠绒毛损伤,排列紊乱、断裂或缺失,呈现炎症细胞浸润的现象(图5A)。
甲苯胺蓝染色后,对照组小鼠的肠黏膜固有层可见少量的肥大细胞,结构完整,轮廓清晰,无脱颗粒现象;模型组小鼠肠黏膜固有层可见较多肥大细胞聚集,伴随胞膜破裂、轮廓不清,细胞周围有明显的紫红色颗粒(图5B)。对照组与模型组小鼠空肠粘膜固有层肥大细胞每十个高清视野下的数目分别为(7.3 ± 1.9)和(37.4 ± 7.0),两组比较有统计学差异(P< 0.01)(图5C)。
3 讨论
在传统的食物过敏动物模型中,致敏途径通常为灌胃[15]或通过腹腔注射过敏原以及免疫佐剂[16]。然而这些模型在肠道缺乏明确的免疫介导的过敏反应,显示的肠道病理证据含糊不清[17]。临床上发现,系统性接触性皮炎会明显增加肠道食物过敏的风险[18]。如特应性皮炎患儿可对很多食物抗原产生过敏反应[19],大多数特应性皮炎个体对花粉过敏并对花粉相关的食物过敏[20]。实际上,食物过敏原通过皮肤接触方式使机体致敏的概率远高于经口摄入途径,前者主要通过Th2细胞介导的免疫反应途径实现,也阻碍机体后期对致敏食物产生耐受性,并引发IgE介导的食物过敏的发生[12]。
本研究发现,采用经皮致敏方式(耳部和背部皮肤)在灌胃OVA攻击后能够引起小鼠血浆tIgE和mMCP-1水平显著升高,且与传统的腹腔致敏方式比较具有显著差异(图1)。意味着经皮致敏的方式能够提高造模的成功率,并且具有不依赖免疫佐剂的优势。由于耳部相较于背部的致敏方式更简便易行,且两组小鼠在灌胃OVA攻击后血浆tIgE和mMCP-1水平没有显著差异,故在后续研究中均采用经由耳部皮肤致敏的方法。卡泊三醇是维生素D的类似物。在小鼠研究中,外用卡泊三醇给药于耳部和背侧皮肤,导致角质形成细胞产生上皮细胞源性细胞因子胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin, TSLP)剂量依赖性增加,并在高浓度下引发特应性皮炎[21]。本研究中将卡泊三醇软膏和OVA溶液均匀混合制成霜剂涂于小鼠耳部,能保留较长时间,较好的模拟了特应性皮炎患者经皮接触过敏原的致敏途径。
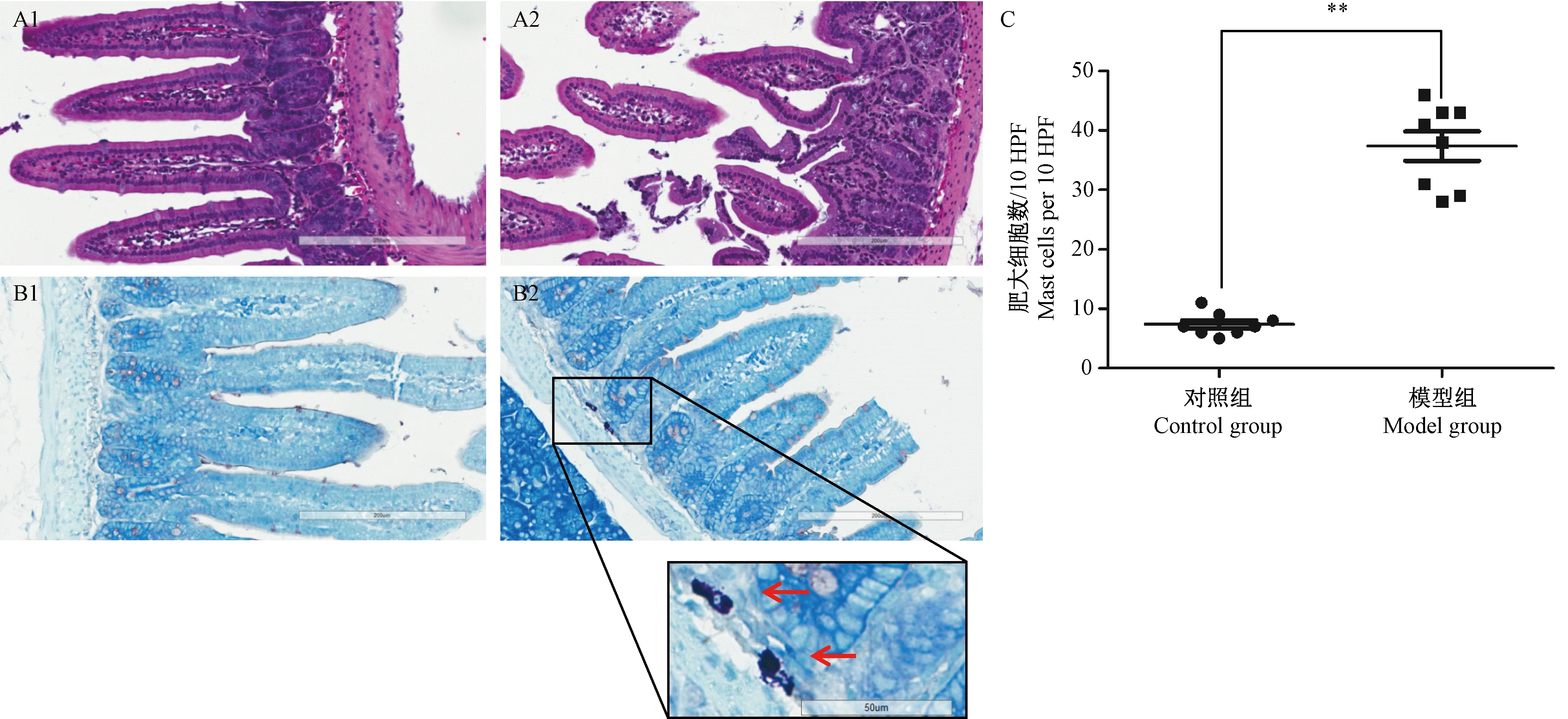
注:A. 经皮致敏小鼠灌胃OVA攻击后空肠组织HE染色(标尺200 μm,× 200),A1代表对照组, A2代表模型组;B. 经皮致敏小鼠灌胃OVA攻击后空肠组织甲苯胺蓝染色(标尺200 μm,× 200;插入图标尺50 μm,× 400),B1代表对照组,B2代表模型组,红色箭头所指为肥大细胞脱颗粒;C. 经皮致敏小鼠灌胃OVA攻击后空肠组织每10个高清视野下肥大细胞数目与对照组相比,**P < 0.01。图5 小鼠肠道攻击后空肠组织病理变化Note. A. Hematoxylin-eosin (HE) staining of mouse jejunum after epicutaneous sensitization (scale bar=200 μm). A1 represents the control group and A2 represents the model group. B. Toluidine blue staining of mice jejunum after epicutaneous sensitization (scale bar=200 μm; inset scale bar=50 μm). B1 represents the control group and B2 represents the model group. Red arrows indicate the degranulation of mast cells. C. The number of mast cells per 10 HPF. Error bars represent means and SDs (n=8 mice per group). Statistical significance was calculated relative to the control group. **P < 0.01. HPF, high-power field.Figure 5 Histological changes of the mouse jejunum after epicutaneous sensitization
经皮致敏的小鼠在灌胃OVA攻击后1 h 内出现明显的肠道过敏症状,包括快速搔抓和摩搓鼻周围及挠头(> 10次)、弯成弓状及腹泻(图2), 表明经皮致敏是一种生理上可行的方式。由于Kawasak等[11]观察到经皮致敏小鼠在灌胃OVA攻击后15 min时直肠温度下降到最低点。因而,我们在研究中以灌胃OVA攻击后15 min的时间点测定小鼠直肠温度,并且发现模型组小鼠直肠温度较对照组小鼠直肠温度下降约1.2°C(图3A)。对灌胃OVA攻击前后血浆中tIgE和mMCP-1水平测定时发现,模型组小鼠血浆中tIgE水平保持较对照组显著升高的水平且没有明显变化(图4A),而血浆中mMCP-1水平在攻击后1 h大幅度的升高(图4B),随后又逐渐降回略高于基础水平(24 h),提示经皮致敏小鼠灌胃OVA攻击后1 h时间点的血浆mMCP-1可作为该模型的代表性指标[22]。
大量研究发现,食物过敏性疾病的发生与肠道屏障功能损伤有关,在食物过敏患者中肠道通透性显著增加,进一步加强了抗原吸收[23]。经皮致敏肠道攻击的小鼠,空肠下端HE染色表明其肠黏膜屏障受到了明显损坏(图5A),并伴有炎性细胞浸润。同时模型组小鼠空肠毛细血管炎性渗出增加(图3B),而变应原和炎性因子等可以通过影响细胞间紧密连接的完整性而增加肠粘膜的通透性。说明经皮致敏肠道攻击的方式能够增加肠道血管的炎性渗出,导致肠道通透性增加,吸收抗原增多,进一步加重过敏反应。
肥大细胞在过敏反应性炎症的发病机制中起核心作用。经致敏后,表面接有IgE抗体的肥大细胞再次接触过敏原时,释放组织胺、5-羟色胺、白三烯等大量炎性介质,作用于靶器官和组织,引起局部或全身过敏反应[24]。运用药理学手段去除致敏小鼠的肥大细胞后,血浆中检测不到mMCP-1水平,小肠组织毛细血管通透性显著减小,小鼠不再出现腹泻,表明肥大细胞是口服过敏原诱导腹泻所必须的[13]。本研究结果显示,相较于对照组,经皮致敏肠道攻击的小鼠空肠组织肥大细胞数目和脱颗粒程度均出现明显的变化(图5B、C)。
综上所述,本研究成功建立了经皮致敏肠道攻击的小鼠肠道过敏模型,该模型相比于传统的腹腔致敏模型可诱导更高的血浆tIgE和mMCP-1水平,能够明显导致小鼠出现快速抓挠、弓背、腹泻等肠道过敏症状,引起小鼠直肠温度下降和肠道通透性增加,导致肠道的功能改变和肥大细胞相关的病理改变。该模型代表了临床人体皮肤暴露过敏原的经皮致敏食物过敏发病机制,为相关研究提供了一种新的研究工具。