甲型流感病毒H1N1 pdm09与PR8感染C57BL/6小鼠诱生特异性CD8+T细胞免疫应答的比较研究
2019-10-31王超刘洋秦波音任晓楠谭丹杨华李顺周晓辉
王超,刘洋,秦波音,任晓楠,谭丹,杨华,李顺,周晓辉
(复旦大学附属公共卫生临床中心,上海 201508)
甲型流感病毒(influenza A virus, IAV)几乎每年都会发生一定范围的流行,是引起人类和动物急性呼吸道传染病的主要病原体之一。由于流感病毒基因组的分节段结构,使其之间交换遗传物质成为可能,而且HA(血凝素)和NA(神经氨酸酶)具有高突变性,因此可能产生高流行性潜力的新病毒株[1]。2009年源自人类、猪和禽类的流感病毒发生基因重组产生的新病毒,获得了感染人类并在人群中传播的能力并引起了21世纪的第一次流感大流行[2-4]。该流感病毒对人类的致死率相对较低,其主要的感染群体为年轻人和中年人(18 ~ 59岁),可引起感染者严重的肺炎。鉴于IAV是危害人类健康和生命的重大公共卫生威胁之一,深入研究其致病与免疫机制以及开发相应的防治策略至关重要。
研究表明,CD8+T细胞在流感入侵宿主后所激活的免疫应答对保护宿主和清除流感病原体发挥着重要的作用[5-6]。CD8+T细胞能够分泌细胞因子如IFN-γ、TNF-α、IL-2等,它们能够促进NK细胞和细胞毒T淋巴细胞(CTL)的增殖分化;此外,CD8+T细胞还能够直接分泌穿孔素(perforin)和颗粒酶(granzyme)直接杀伤感染的靶细胞[7-8]。机体通过这些分子机制实现抑制流感病毒扩增并清除病毒的功能。
目前,对于CD8+T细胞在pdm09的感染免疫中尚不清楚[9]。本研究在比较了pdm09和PR8感染C57BL/6小鼠后其致病性、肺组织病理学变化和病毒载量的基础上,初步分析了两种病毒感染后效应阶段的CD8+T细胞的免疫应答的差异。
1 材料与方法
1.1 材料
1.1.1 实验动物
实验选用SPF级8周龄C57BL/6小鼠,体重18 ~ 20 g,均为雌性,购于上海西普尔-必凯实验动物有限公司【SCXK(沪)2018-0006】,饲养于上海市(复旦大学附属)公共卫生临床中心实验动物部SPF区域【SYXK(沪)2015-0008】中。在实验前3 d将小鼠转移到生物安全二级实验室进行分组、标记、称重。实验共分为两部分,第一部分分为两大组:生存曲线组和解剖组。生存曲线组共20只(PR8组10只,pdm09组10只),解剖组共30只(PR8组15只,pdm09组12只,对照组3只),第二部分只有解剖组共23只(PR8组10只,pdm09组10只,对照组3只),分笼后正常饲养。所有操作均符合上海市公共卫生临床中心实验动物伦理要求(公卫伦审2018-A60-02号)。
1.1.2 病毒
H1N1病毒株A/Puerto Rico/8/34(PR8),为上海兽医研究所李泽君研究员惠赠,本实验室扩增保存。A/Shanghai/37T/2009(H1N1)(pdm09)为本院临床分离株,流感病毒经鸡胚和MDCK细胞培养滴定后,分装于1.5 mL EP管中,-80℃冰箱储存备用。所有病毒感染及取材等实验操作均在上海市(复旦大学附属)公共卫生临床中心实验动物部生物安全二级实验室(ABSL-2)中开展(注册备案号:金字第022006005号)。
1.1.3 实验试剂
四聚体Flu.NP366[ASNENMETM,H-2D(b)](广州好芝生物科技有限公司,HG08T7030),异氟烷(上海雅培制药有限公司,B506),Total RNA抽提试剂盒(Qiagen GmbH,52906),One-Step TB Green PrimeScriptTMPLUS RT-PCR kit(Perfect Real Time,RR096 A),DMEM培养液(Gibco,1868707),多聚甲醛固定液(武汉谷歌生物科技有限公司,163307),流式抗体(上海优宁维科技生物股份有限公司,Biolegend),BD Cytofix/Cytoperm Plus固定破膜试剂盒(BD,555028)。
1.1.4 实验仪器
微量移液枪(Eppendorf,德国),博日LineGene 9600 Plus荧光定量PCR仪(FQD-96,BIOER,杭州博日科技有限公司,中国),流式细胞仪(LSR Fortessa,BD公司,美国),CO2培养箱(3111,Thermo,美国),冷冻离心机(Micro 17R,Thermo,美国),精密高温干燥箱(DHG-9070C,上海之信仪器有限公司,中国),超微量分光光度计(K5600,北京凯奥科技发展有限公司,中国)。
1.2 方法
1.2.1 感染方案及样本制备
感染方案分为两部分,两部分用到的病毒量不同。第一部分两株病毒都用9.85 × 106TCID50的病毒量攻毒,该部分可得到生存曲线、肺指数、肺组织病理切片、病毒载量的数据。第二部分进行CD8+T细胞的功能实验,均用0.25倍LD50的病毒量攻毒。
小鼠经异氟烷气麻,当其尾巴自然下垂静止不动后,用移液枪吸取相应剂量的病毒,缓慢滴入到小鼠鼻腔中,尽量避免小鼠吞咽和喷嚏,以保证攻毒量,攻毒完成后将小鼠放入独立送风隔离笼具(IVC)中正常饲养。之后每日观察小鼠状态,记录体重和生存情况。第一部分实验分别在第1天和3天解剖小鼠,取其肺称重,左叶肺用4%甲醛固定,剩余部分分装后速冻于液氮中,后转移到-80℃冰箱储存备用。第二部分实验在感染后第8天解剖小鼠取脾,制备单细胞,后续进行流式实验。
1.2.2 肺组织病理检测
取小鼠肺左叶,经4%多聚甲醛溶液固定,常规石蜡包埋,H&E染色后,扫描全片,使用CaseViewer软件进行数据处理。
1.2.3 qRT-PCR 检测肺病毒载量
按照0.01 g肺组织/100 μL PBS的比例匀浆。按照说明书使用Total RNA抽提试剂盒(QIAGEN,德国)抽提肺组织中总RNA,提取的RNA用超微量分光光度计(K5600,中国)检测其浓度和吸光度值(A260/280为2.0 ~ 2.24)。将提取的样本RNA的浓度稀释为100 ng/μL,使用One-Step TB Green PrimeScriptTMPLUS RT-PCR kit进行肺病毒载量检测。扩增体系为20 μL:TB Green 10 μL,Ex Taq HS Mix 1.2 μL,Plus RTase Mix 0.4 μL,上下游引物各0.8 μL(10 μmol/L),RNA模板1 μL,水(无RNA酶)5.8 μL,按照该体系加样后放入荧光定量PCR仪中进行扩增。扩增程序为:42℃ 5 min;95℃ 10 s;95℃ 5 s;60℃ 30 s,40个循环。根据2-ΔΔCt的方法计算肺组织总RNA中的相对病毒载量。
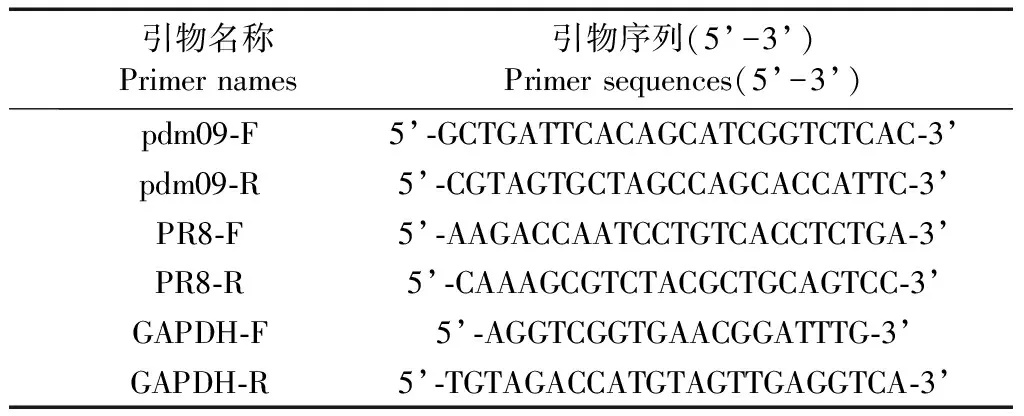
表1 本实验中所用引物Table 1 Primers used in this experiment
1.2.4 流式细胞术(FACS)检测细胞因子表达
流感感染小鼠第8天解剖小鼠取其脾,制备单细胞。每个样本表面染色用5 × 105~ 1 × 106个细胞,染色抗体包括CD8-FITC、CD44-APC-Cy7、Flu.NP366-PE、CCR7-BV421、PD-1-Percp-cy5.5、Tim-3-PE-cy7、LAG3-APC、CTLA4-BV605,4℃避光染色45 min,PBS清洗2次,200 μL染色buffer重悬后等待上机;细胞内细胞因子染色时细胞铺96孔板,每孔2 × 106个细胞,将制备好的单细胞与流感肽段NP366-374(ASNENMETM)和PA224-233(SSLENFRAYV)按照各2.5 μg/mL的浓度与之混匀,按照1 mL/μL的比例加入高尔基体阻断剂,37℃细胞培养箱中放置5 h,按照各抗体以及BD Cytofix/Cytoperm Plus固定破膜试剂盒使用说明书的建议进行染色,流式抗体包括CD4-APC、CD8-FITC、CD44-APC-cy7、TNF-α-PE-cy7、IFN-γ-PE、Granzyme B-PB、IL-2-BV605。染色结束后PBS清洗2次,200 μL染色buffer重悬细胞,过滤后等待上机。后续实验数据通过Flowjo(V10)软件进行分析。
1.3 统计学分析
2 结果
2.1 pdm09和PR8流感感染后对小鼠生存率变化的影响
用9.85 × 106TCID50的PR8和pdm09分别滴鼻感染C57BL/6小鼠,两组小鼠各10只。感染后第2天PR8组小鼠较pdm09组体重下降明显;第3天两组小鼠均出现活动量减少,精神萎靡的症状,且伴随食量下降,竖毛蜷缩等现象;攻毒后第4天PR8组小鼠开始出现死亡且到第5天小鼠全部死亡,而pdm09组小鼠则第7天开始出现小鼠死亡(图1);持续观察至第14天,pdm09组小鼠生存率(67%)显著高于PR8组小鼠(0%)(P< 0.01)。

图1 9.85 × 106 TCID50的PR8和pdm09攻毒后小鼠生存曲线Figure 1 Survival curves of the mice after 9.85 × 106TCID50 PR8 and pdm09 challenge
2.2 pdm09和PR8流感感染后对小鼠肺指数和病毒载量的影响
在流感感染后第1天和第3天分别对两组小鼠进行解剖取材。取小鼠整肺测得肺指数,用肺匀浆上清提取病毒RNA进行病毒载量测定(图2)。肺指数结果显示,与对照组相比,感染后的小鼠肺指数均有升高,且第3天较第1天肺指数均升高明显(P< 0.01),提示第3天的炎症较第1天严重。感染第1天肺指数,PR8组(1 ± 0.061)%,与pdm09组(0.68 ± 0.055)%相比显著升高(P< 0.01)。同样,感染第3天肺指数,PR8组(1.5 ± 0.22)%,相比pdm09组(0.92 ± 0.095)%,也显著升高(P< 0.01)。病毒载量的结果显示,PR8组在第1天和第3天的病毒载量均高于pdm09组(P< 0.05)。综上结果提示,感染相同的病毒量情况下,PR8相比pdm09可能在小鼠肺中造成更严重的炎症,且PR8的复制速度快于pdm09或者宿主能够更有效的抑制pdm09的复制。
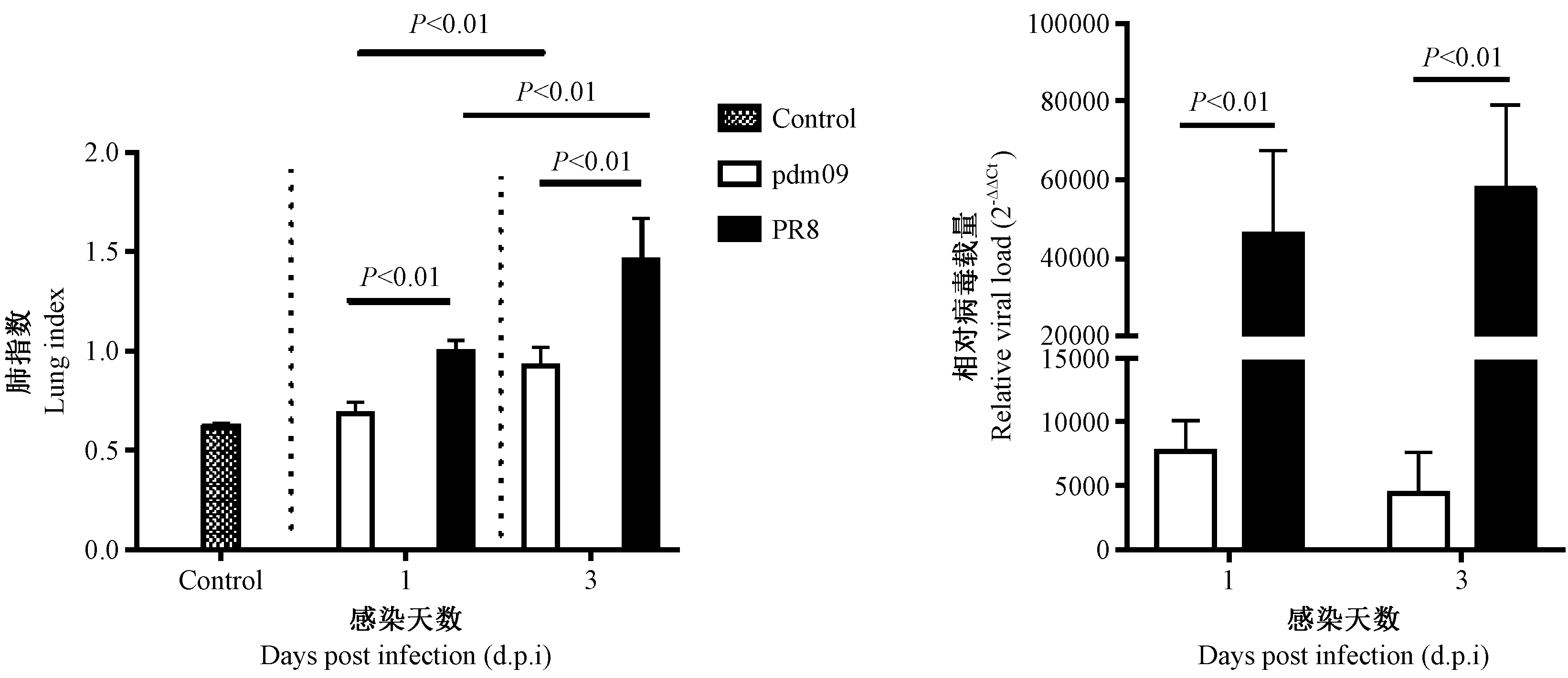
图2 9.85 × 106 TCID50的PR8和pdm09攻毒1天和3天小鼠的肺指数和相对病毒载量Figure 2 Lung index and relative viral load of the mice after 9.85 × 106 TCID50 PR8 and pdm09 challenge on the 1st day and 3rd day
2.3 pdm09和PR8流感感染后H&E染色观察小鼠肺部的病理损伤
在流感病毒感染后第1天和第3天分别对两组小鼠进行解剖取材,解剖时肉眼可见其肺组织出现不同程度的病理改变,尤其PR8组小鼠,肺充血明显。感染后第1天,pdm09组小鼠无明显病变,PR8组小鼠病变面积达15%;感染后第3天,两组小鼠肺充血现象较第1天明显加重,PR8组小鼠病变面积已达60% ~ 70%,而pdm09组病变仅10% ~ 15%左右。H&E染色后镜下观察(图3),两组小鼠第3天的病变程度均比第1天严重,肺间隔增宽增厚,炎症浸润加重,血细胞渗出变多。相同取材时间点,PR8组小鼠肺病理损伤程度比pdm09组严重,表现在感染后第1天,PR8组肺泡壁增厚,炎症浸润增加;感染第3天,PR8组肺泡壁进一步增厚,肺泡结构完全破坏,发生肺实质化,气体交换功能严重受损,炎症细胞浸润加重,血管扩张,血细胞渗出增多。组织病理结果显示,PR8与pdm09相比可在小鼠肺部造成更加严重的病理损伤。
2.4 相同LD50的pdm09和PR8流感感染后小鼠的体重变化及肺部病理损伤
为进行免疫应答分析,本研究继而用相同的LD50量(0.25倍LD50)的pdm09和PR8分别滴鼻感染C57BL/6小鼠。感染后每天固定时间观察小鼠状态并进行称重,持续观察14天,制作体重变化曲线(图4)。从感染后第3天开始,两组小鼠体重均开始明显下降,此前二者体重变化并无显著差异,但是第4天开始至第13天,对比每天两组小鼠体重下降率发现,PR8组小鼠体重下降率均显著高于pdm09组,第8 ~ 9天两组小鼠体重开始回升。攻毒后8天对两组小鼠进行解剖,取其肺进行病理检测,通过H&E染色可以发现PR8组相对pdm09组小鼠发生了更严重的病理损伤:肺泡壁增厚发生实质化,炎症浸润明显,这也和小鼠的体重变化具有一致的趋势。提示相同LD50病毒量的PR8相比pdm09能够对小鼠造成更严重体重损失和肺部病理损伤。
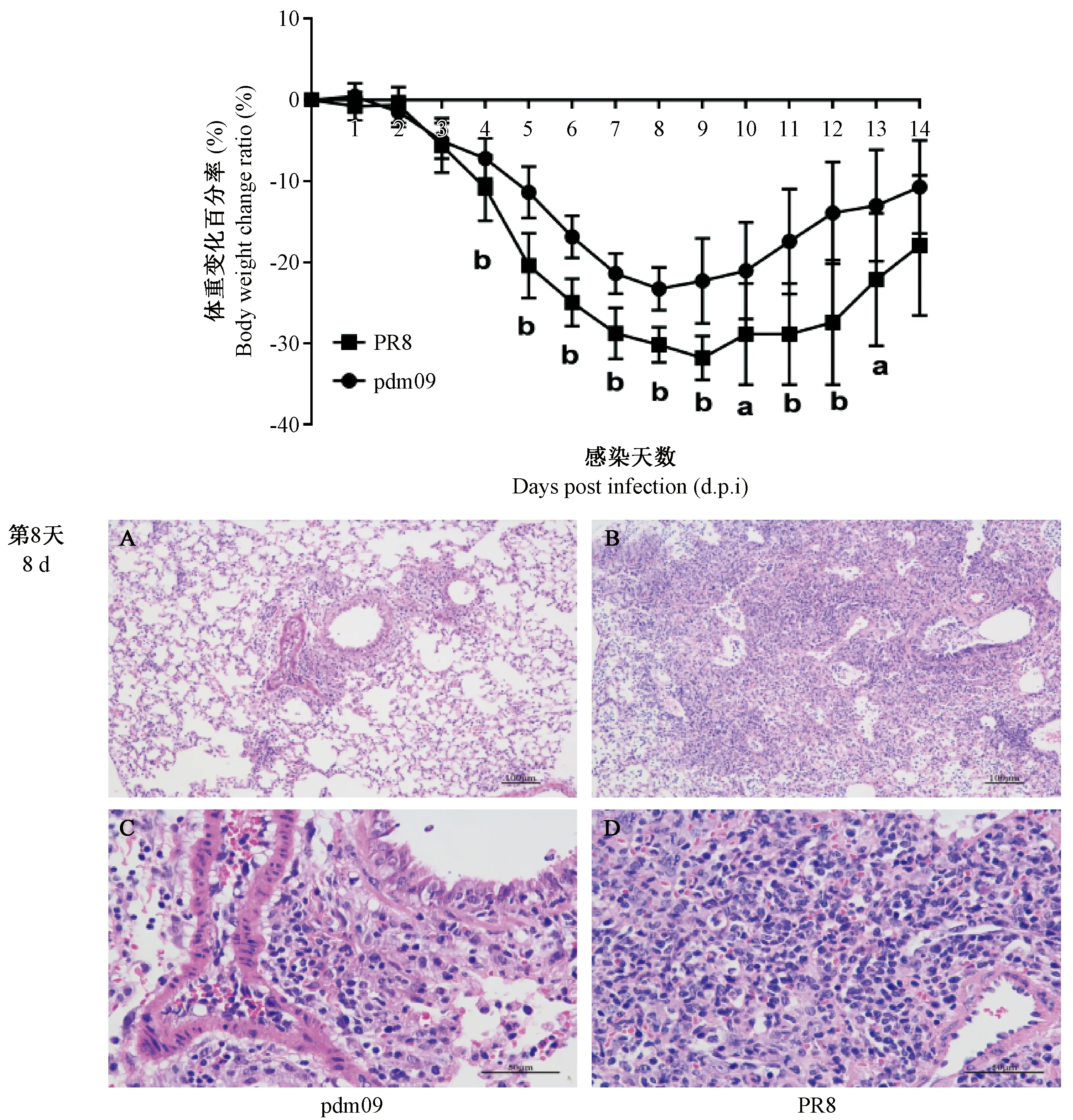
注:a: P< 0.05, b: P< 0.01。 A, C: pdm09 感染后。 B, D: PR8 感染后。图4 0.25倍LD50攻毒后小鼠体重变化和肺部病理改变Note. a:P< 0.05, b: P< 0.01. A, C: After pdm09 infection. B, D: After PR8 infection.Figure 4 Changes of body weight and pathological changes in lung tissues after 0.25 times LD50 challenge
2.5 相同LD50的pdm09和PR8流感感染小鼠后比较两株病毒诱生病毒特异性CD8+T细胞的能力
用相同LD50量的两病毒分别对小鼠进行滴鼻感染,攻毒后第8天解剖取其脾制备成脾细胞悬液,通过流式细胞术检测其中病毒特异性CD8+T细胞的比例(图5)。对CD8+T细胞亚群设门分析,PR8组诱生的病毒特异性CD8+T细胞的比例(0.6 ± 0.3)%,显著高于pdm09(0.1 ± 0.07)%(P< 0.05)。结果显示,相对于pdm09感染组,PR8流感病毒感染小鼠后其脾能够诱生较高比例的病毒特异性CD8+T细胞。

注:数据圈门于CD8+T细胞群。图5 0.25倍LD50攻毒8天小鼠脾中病毒特异性CD8+T细胞数量比较Note. Data gated on CD8+T cell population.Figure 5 Comparison of the numbers of virus-specific CD8+T cells in mouse spleen tissues at day 8 after 0.25 times LD50 challenge
2.6 两株病毒感染小鼠后比较CD8+T细胞分泌细胞因子的能力
在两株病毒感染小鼠后第8天分离脾细胞,通过流式细胞术检测CD8+T细胞中效应性细胞CD8+CD44HighT亚群分泌IFN-γ、IL-2和TNF-α的比例(图6)。IFN-γ属于II型干扰素,其主要功能是参与免疫调节,可增强中性粒细胞的吞噬作用和NK细胞的细胞毒作用。本实验中,pdm09组小鼠活化的CD8+T细胞分泌IFN-γ的比例(5.75 ± 1.24)%显著高于PR8组(1.44 ± 0.582)%(P< 0.01)。IL-2可活化巨噬细胞,诱导CTL增殖分化,促进杀伤细胞分泌IFN-γ、TNF-α等,是免疫系统中重要的细胞生长因子,结果显示pdm09组IL-2的比例(1.95 ± 0.623)%显著高于PR8组(0.344 ± 0.0859)%(P< 0.01)。TNF-α对于免疫反应的调控和炎症的诱导等起着重要作用,pdm09组CD8+T细胞产生的TNF-α的比例(1.92±0.519)%,虽然与PR8组(1.81 ± 0.394)%相比无显著差异,但是其平均值仍略高于pdm09组,可见pdm09攻毒后活化的CD8+T细胞能够产生较多的细胞因子来抵御病毒。

注:数据圈门于CD8+CD44High T细胞群。图6 0.25倍LD50攻毒8天小鼠脾中CD8+CD44High 亚群分泌IFN-γ、TNF-α、IL-2比较Note. Data gated on CD8+ CD44High T cell population.Figure 6 Comparison of IFN-γ, TNF-α, IL-2 secretion by CD8+ CD44High T cell subpopulation in mouse spleen tissues at day 8 after 0.25 times LD50 challenge
2.7 两株病毒感染小鼠后比较CD8+T细胞分泌颗粒酶的能力
当流感病毒感染宿主后,CD8+T细胞在保护机体的过程中除了分泌细胞因子促进免疫细胞增殖分化和表达Fasl诱导靶细胞凋亡外,还会通过释放穿孔素和颗粒酶直接杀伤靶细胞。因此我们检测了granzyme B的表达情况(图7)。从CD8+CD44High亚群进行画门得到granzyme B阳性的细胞,结果显示pdm09组颗粒酶(granzyme B)的比例(6.02 ± 1.11)%和PR8组(3.88 ± 2.28)%虽然无显著差异,但是仍然呈现出pdm09组高于PR8组的趋势。
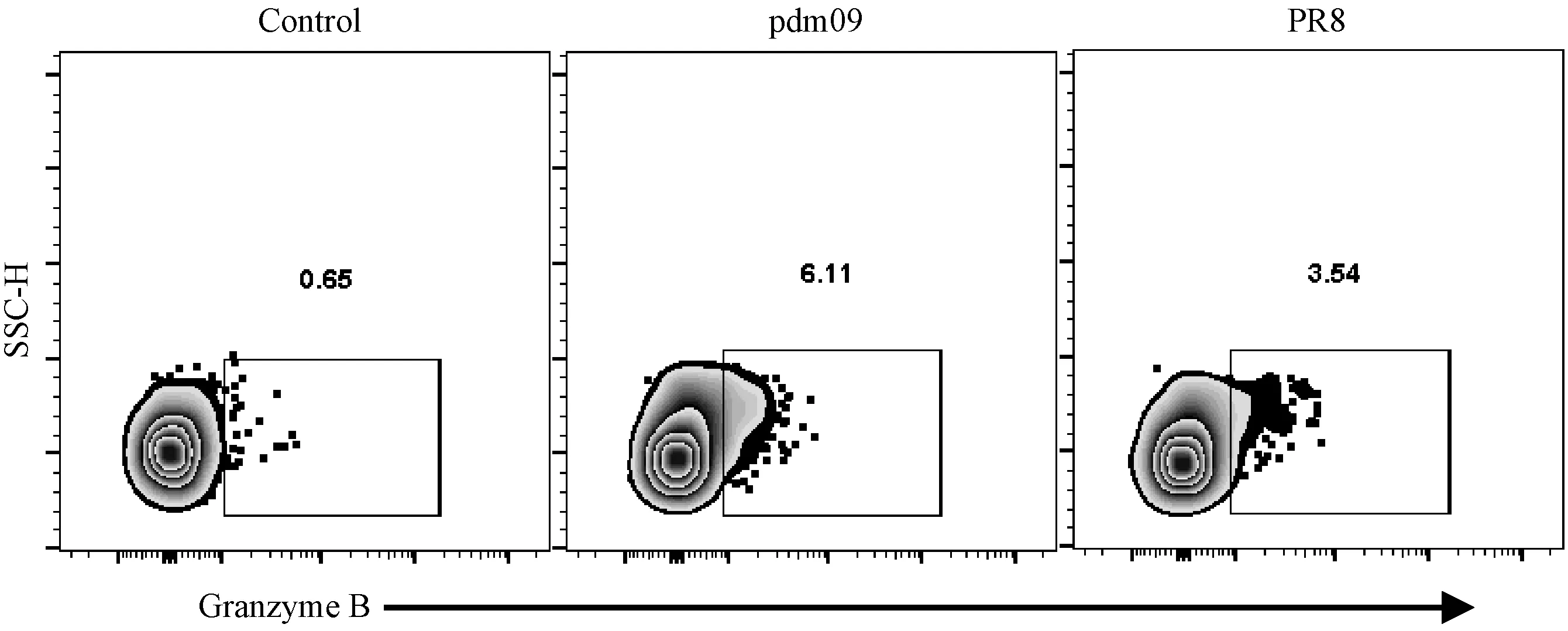
注:数据圈门于CD8+CD44High T细胞群。图7 0.25倍LD50攻毒8天小鼠脾中CD8+CD44High亚群分泌granzyme B的比较Note. Data gated on CD8+CD44High T cell population.Figure 7 Comparison of the granzyme B secretion by CD8+CD44High T cell subpopulation in mouse spleen tissues at day 8 after 0.25 times LD50 challenge
2.8 两株病毒感染小鼠后比较CD8+T细胞耗竭指标的表达差异
从前面的结果中,我们看到流感病毒特异性CD8+T细胞的比例PR8组高于pdm09组,理论上其适应性免疫更具优势,但是效应性细胞因子的表达总体上是pdm09组较多,所以我们对pdm09组和PR8组中CD8+CD44High亚群表达的耗竭分子进行比较(图8),结果发现PR8组表达PD-1的比例(15.4 ± 1.33)%显著高于pdm09组(9.39 ± 1.93)%(P< 0.05),同时LAG-3的表达上,PR8组(8.6 ± 0.741)%也是显著高于pdm09组(4.85 ± 1.63)%(P< 0.05)。结果表明,相对于pdm09感染组,PR8感染组小鼠其活化的CD8+T细胞(CD8+CD44High亚群)会出现更高功能耗竭分子表达,显示其效应性免疫力呈现耗竭状态。
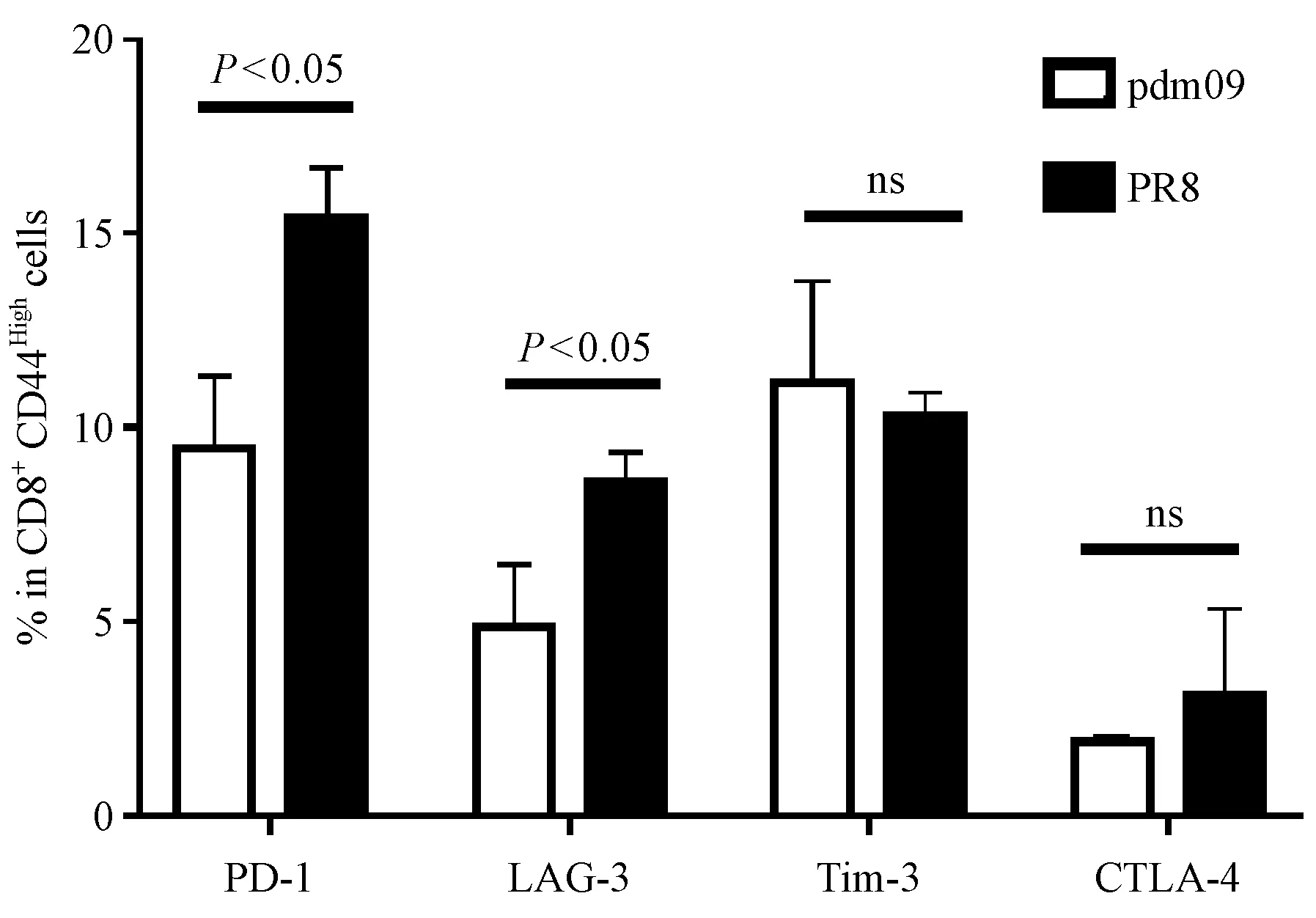
图8 0.25倍LD50攻毒8天小鼠脾中CD8+CD44High亚群免疫抑制检查点分子表达比较Figure 8 Comparison of molecular expression of CD8+CD44High T cell subpopulation immunosuppressive checkpoints in the mouse spleen tissues at day 8 after 0.25 times LD50 challenge
3 讨论
A(H1N1)pdm09病毒与季节性流感相似之处是造成的死亡率相对较低,然而不同在于大约64%的严重病例发生在年轻人和中年人的群体中,而非免疫力比较弱的孩子和老年人[2]。虽然其中具体的致病机制尚不清楚,但是各种流感病毒对机体造成损伤的原因无外乎包括两方面:病毒特有的毒力因子和宿主对感染的免疫应答能力。
当病原体入侵机体时需要突破皮肤黏膜屏障、天然免疫屏障和特异性免疫应答三道防线。对于流感病毒而言,第三道防线中的特异性细胞免疫应答在保护机体和清除病毒中发挥至关重要的作用[10]。机体尚未接触流感病毒时,初始T细胞(naïve T cells)富集在次级淋巴器官(如脾、淋巴结等)通过血液循环和淋巴循环执行免疫监视功能[11]。流感病毒入侵机体后,树突状细胞(dendritic cell,DC)在感染部位吞噬抗原,迁移至淋巴结,通过主要组织相容性复合体(major histocompatibility complex,MHC)提呈抗原短肽段,与T细胞抗原受体(TCR)第一信号和共刺激分子第二信号协同刺激激活T细胞[12-13]。活化后的T细胞不断增殖,进入效应阶段,产生效应T细胞(effector T cells),然后迁移到感染部位执行功能,迁移过程受到多种趋化因子(如CCL5和CXCL10)和自身受体的严格调控[14]。本实验研究CD8+T细胞功能于感染后第8天取材,即处于效应阶段。随着流感抗原被效应T细胞不断清除,其增殖达到高峰,T细胞开始进入收缩期[15]。此时绝大多数的特异性效应T细胞发生凋亡,只有5% ~ 10%的效应细胞作为记忆T细胞(memory T cells)长期存活[16-18]。研究表明,当流感入侵宿主后所诱生的特异性CD8+T细胞免疫应答是保护宿主和清除流感病原体的关键[19]。
Meunier等[9]将大流行病毒的人类分离株H1N1/A/California-like/2009在小鼠上进行适应得到其小鼠适应株(MAP2009),用10PFU的MAP2009和PR8分别滴鼻感染18 ~ 20 g的C57BL/6小鼠。结果显示,MAP2009组与PR8组相比具有高死亡率和高病毒载量[20-21],表明MAP2009病毒具有更高的致病性和复制能力;同时他们也发现在小鼠肺中病毒特异性CD8+T细胞的数目MAP2009组显著低于PR8组,但是在脾中无显著差异,表明MAP2009组感染后适应性免疫可能受到损伤。Lv等[22]研究者用5 × 105PFU的H1N1/A/Beijing/501/2009(BJ501)临床株和PR8分别滴鼻感染6 ~ 8周的BALB/c小鼠,结果显示其存活率和体重没有显著差异,但是PR8组的病毒载量显著高于BJ501组,提示BJ501病毒的复制效率低于PR8;ELISPOT实验检测到感染后第8天BJ501组肺中IFN-γ的比例显著高于PR8组,IL-2表达无显著差异,总之PR8对小鼠造成的损伤比BJ501更加严重。
实验动物本身的性质(性别、年龄、品系及来源厂商)及其生物学效应的复杂性、病毒株本身性质的差异性等原因,均可能造成不同实验室的动物实验结果的差异。Meunier等[9]使用的毒株是在小鼠肺中经过培养的适应株,而Lv等[22]及本研究使用的是临床分离株,攻毒剂量也存在差异,取材的组织也不尽相同,所以得到的结果也存在一定的差异。实际上,研究表明A(H1N1)pdm09病毒的不同临床分离株造成的发病率和死亡率也是各不同[23-24]。
本研究用9.85 × 106TCID50的pdm09和PR8滴鼻感染C57BL/6小鼠,pdm09组小鼠较PR8组呈现死亡率低、肺部病理损伤轻微、病毒载量较低特性;当用0.25倍LD50的pdm09和PR8分别攻毒小鼠后呈现出相同的趋势,pdm09组小鼠体重损失程度和肺病理损伤较PR8组缓和。我们的研究结果与Lv等[22]的报道基本一致,但我们进一步对两种病毒感染后CD8+T的耗竭状态作了比较分析。
pdm09组虽然感染后脾中病毒特异性CD8+T细胞的数量少,但是由于活化的CD8+T细胞表达免疫抑制性分子PD-1和LAG-3少,所以其分泌IFN-γ和IL-2的能力强于PR8组,促进了CD8+T细胞的增殖分化,有利于病原体的清除。反之,PR8组可能是由于功能耗竭的原因导致适应性免疫受损,从而缺乏快速有效的T细胞应答,因此导致病毒载量增加、肺部病理严重和高死亡率。当然,T细胞功能耗竭是一个复杂的现象,可能涉及多个抑制受体、共刺激受体的协同调节,甚至可能存在其他未知的机制,许多病毒已经发展出许多干扰适应性免疫并导致T细胞耗竭的的策略[25]。流感病毒感染后的CD8+T细胞耗竭的具体分子机制,还有待进一步深入的研究探索。
鉴于解除病毒特异性CD8+T细胞的耗竭状态可挽救特异性T细胞免疫功能[26],这一策略在肿瘤性疾病的临床治疗实践中已被应用。本研究结果提供的线索提示,在严重的甲型流感病毒感染的情况下,逆转CD8+T细胞的耗竭状态也可能是未来的一个新的潜在治疗靶标。