L-精氨酸在实验室果蝇扩繁中的应用
2019-10-31赵国栋陈晖邵建翔马晨阿依先木米吉提艾则孜阿布都克依木李晓斌
赵国栋,陈晖,邵建翔,马晨,阿依先木·米吉提,艾则孜·阿布都克依木,李晓斌
(新疆农业大学 动物遗传育种与繁殖实验室,新疆 乌鲁木齐 830052)
果蝇属动物界,节肢动物门,六足亚门,昆虫纲,有翅亚纲,双翅目,环裂亚目,果蝇科。果蝇易于饲养、繁殖快、生活史短,作为理想的动物遗传学研究材料而著称。在本科动物遗传学果蝇的杂交实验中,需要大批量的处女蝇,因此,如何在短时间内扩繁大量的果蝇对顺利开展实验具有重要的意义。精氨酸是机体内代谢的必需氨基酸之一,也是合成蛋白质的重要组分,在哺乳动物中研究表明,精氨酸在胚胎发育、着床[1-2]及减少胚胎死亡等方面具有显著作用[3-4]。Bayliak等[5]和Kraaijeveld等[6]研究结果显示,L-精氨酸可以促进果蝇的生长与繁殖。在实际教学中,果蝇繁殖大部分基于普通培养基自然繁殖,而通过改变培养基以提高果蝇繁殖力和缩短繁殖时间的研究鲜见。因此,基于精氨酸在提高繁殖力等方面的相关研究,本实验以白眼、残翅、野生型果蝇为研究对象,通过培养基中添加L-精氨酸,探究L-精氨酸对果蝇繁殖性能的影响。
1 材料与方法
1.1 材料
白眼(w1118)、残翅(CyO)、野生型黑腹果蝇(由新疆农业大学动物科学学院动物遗传育种与繁殖实验室提供);电热炉;2 cm × 20 cm试管;棉花;纱布;石棉网;烧杯(200、100、5 mL各一个);玻璃棒;称量纸;琼脂条;玉米面;酵母粉;苯甲酸;蔗糖;95%酒精;乙酸。
1.2 方法
1.2.1 培养基的配制
果蝇培养基主要成分见表1。配制100 mL培养基方法:①对照组:用100 mL容量瓶取纯净水定溶后,分为70 mL和30 mL分两个烧杯装备用;实验组:称取1 gL-精氨酸在5 mL烧杯内溶解,转入100 mL容量瓶内,用纯净水定溶至100 mL,分为70 mL和30 mL分两个烧杯装备用。②将玉米粉10 g、酵母粉1.6 g转入100 mL烧杯内加水30 mL溶解;③将苯甲酸0.15 g溶于2 mL 95%酒精中备用。
称取琼脂条1.5 g加入200 mL烧杯内加①中70 mL水垫石棉网后加热煮沸溶解,待琼脂充分溶解后,加入蔗糖8.5 g充分溶解,依次加入上述②和③中的溶液,煮沸后加入0.6 mL丙酸,混匀后将培养基分装于12支试管内(22 mm × 200 mm),将试管倾斜冷凝做出斜面,冷却后用脱脂棉球擦干试管内壁水蒸气,用纱布棉塞封口备用。
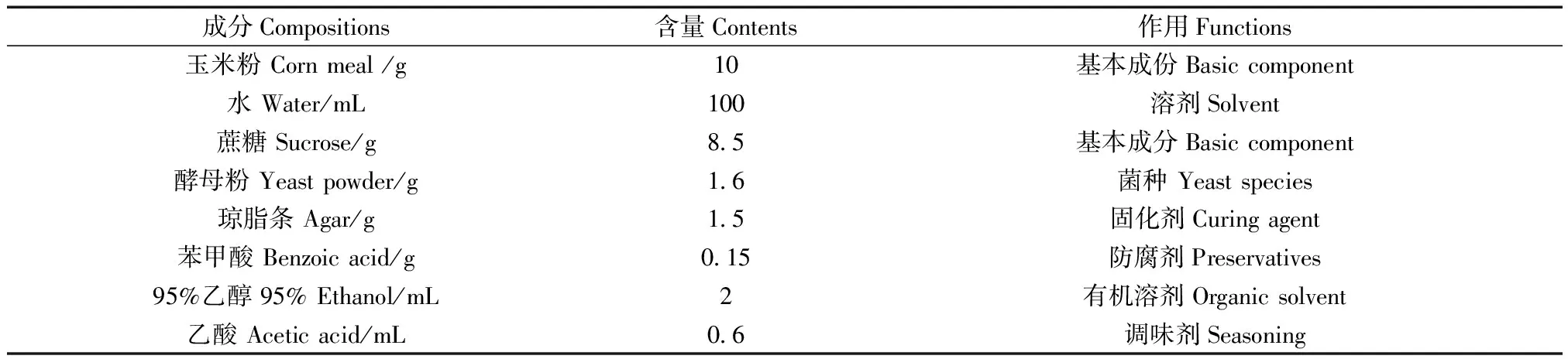
表1 玉米培养基的成分含量(100 mL)Table 1 Composition of the corn meal agar medium (100 mL)
1.2.2 实验设计
实验中分别用白眼、野生型和残翅三个品系的果蝇为研究对象,每个品系分别分为对照组和实验组,每组12管培养基,分别1-12编号后注明日期和品系。取24 h内羽化的果蝇,转入空管用乙醚棉塞麻醉后将雌雄分开,然后随机(雌∶雄=1∶1)取出7对移入培养基,每组12个重复,以转入亲本计为0 h,在23℃恒温培养箱中培养72 h后移除亲本。
1.3 统计学分析
观察培养基,待培养基中有3龄幼虫时,每天12:00观察一次,出现第一个蛹时,记为化蛹第1天,分别统计各管F1化蛹时间,按编号统计各管F1化蛹数,连续统计10 d结束。化蛹后每天14:00按编号统计F1羽化数,以出现第一只羽化果蝇计为羽化第1天,按编号将F1羽化的果蝇转至空管麻醉鉴别雌雄,连续统计10 d各管中F1雌、雄只数。实验结果均以平均数±标准差(Mean ± SD)表示。所得数据在Excel表格中整理后,采用SPSS 19.0软件进行独立样本t检验分析。
2 结果
2.1 L-精氨酸对实验室白眼果蝇繁殖性能的影响
由表2可知,在培养基中添加1%的L-精氨酸后,白眼果蝇的化蛹数、羽化数、雌蝇只数和雄蝇只数分别比对照组提高313.64%、303.53%、266.46%和356.62%(P< 0.01)。羽化率和雌雄比例实验组与对照组差异不显著(P> 0.05)。

表2 L-精氨酸对实验室白眼果蝇繁殖性能的影响(n=12)Table 2 Effects of L-arginine on the reproductive performance of the white eye Drosophila melanogaster (n=12)
注:同行数据肩标不同小写字母表示差异显著(P<0.05),肩标相同小写字母或无字母标注表示差异不显著(P>0.05);同行数据肩标不同大写字母表示差异极显著(P<0.01),下同。
Note:In the same row, values with different lowercase superscripts mean significant difference(P<0.05), while with same lowercase or no letter superscripts mean no significant difference(P>0.05).Values with difference capital letter mean difference was extremely significant(P<0.01). The same as below.
2.1.1L-精氨酸对实验室白眼果蝇化蛹数的影响
由图1可知,实验组果蝇化蛹时间比对照组提前2 d,且第10天化蛹数比对照组高313.36%。实验组化蛹数目时间在1 ~ 7 d呈直线上升,在第5天化蛹数达到最大值。对照组化蛹时间主要集中在3 ~ 8 d,第6天化蛹数达到最大值,化蛹数最大值时实验组比对照组提高342.86%。
2.1.2L-精氨酸对实验室白眼果蝇羽化数的影响
由图2可知,实验组果蝇羽化数在1 ~ 4 d呈直线上升,在第4天达到最大值;对照组在第5天达到最大值,在最大值时实验组比对照组提高700%。
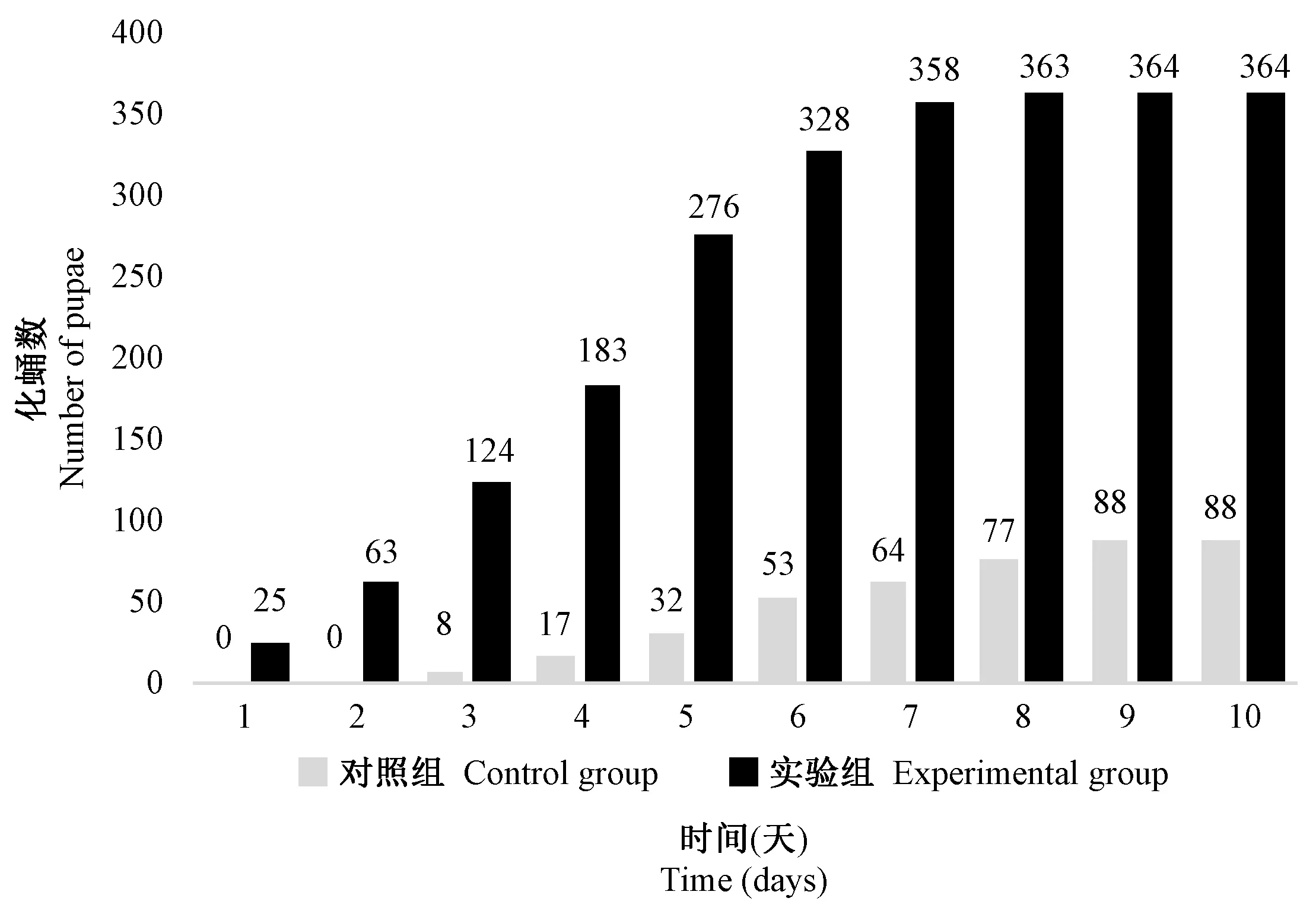
图1 L-精氨酸对实验室白眼果蝇化蛹数的影响Figure 1 Effect of L-arginine on the number of pupae of the white eye Drosophila melanogaster
2.2 L-精氨酸对实验室残翅果蝇繁殖性能的影响
由表3可知,实验组残翅果蝇化蛹数、羽化数、雌蝇只数和雄蝇只数分别比对照组提高157.09%、182.76%、320%和90.38%(P< 0.01),雌雄比例实验组比对照组提高113.88%(P< 0.05),羽化率实验组有所提高,但与对照组相比差异不显著(P> 0.05)。
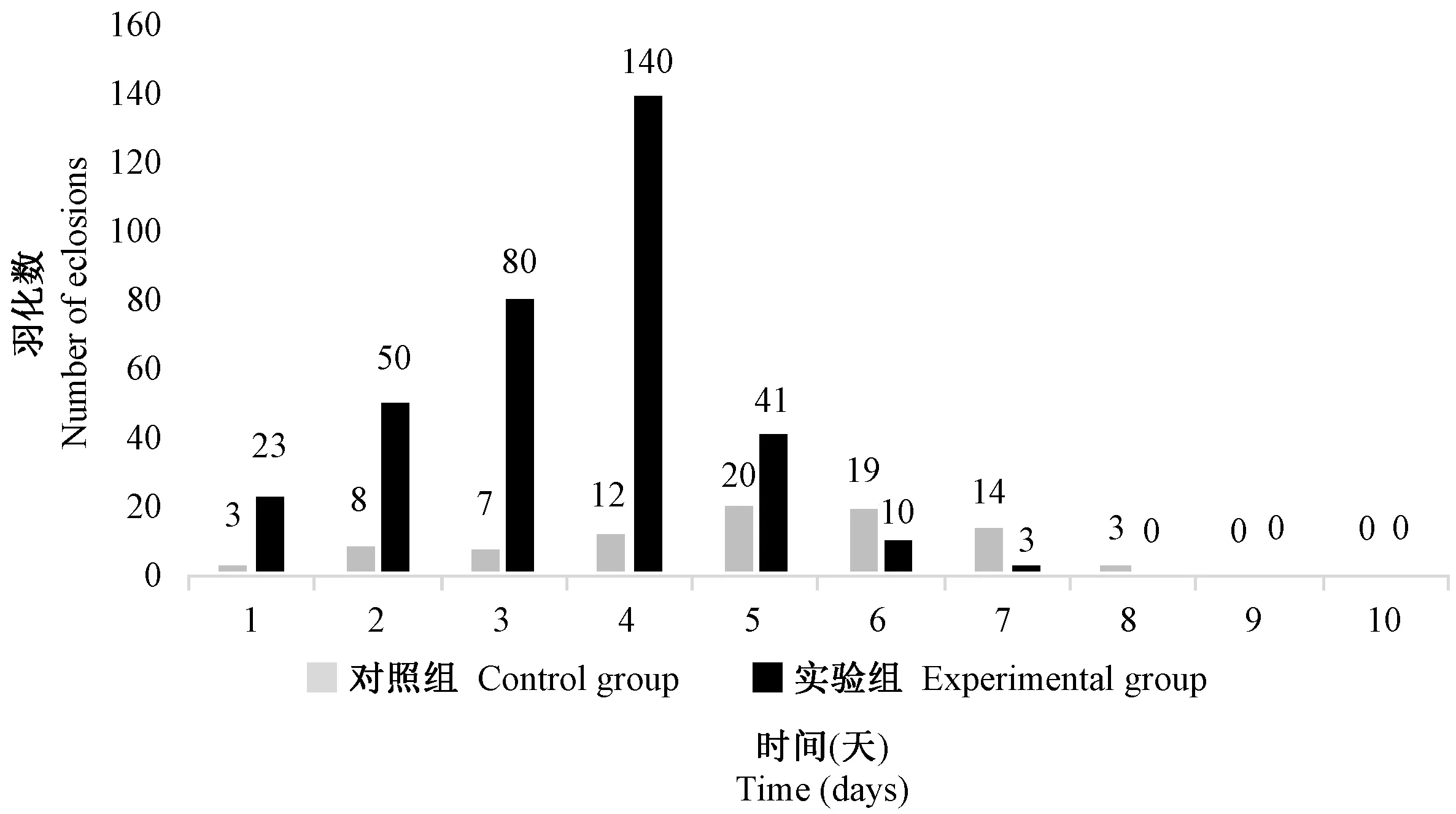
图2 L-精氨酸对实验室白眼果蝇羽化数的影响Figure 2 Effect of L-arginine on the number of eclosions of the white eye Drosophila melanogaster

组别Groups化蛹数(个)Number of pupae羽化数(只)Number of eclosions雄蝇(只)Number of male flies羽化率(%)Eclosion rate (%)雌雄比例(%)Female/male ratio (%)对照组Control group24.75 ± 9.05B21.75 ± 9.25B13.00 ± 6.07B86.35 ± 12.7575.19 ± 30.75b实验组Experimental group63.63 ± 8.82A61.50 ± 9.58A24.75 ± 7.19A96.56 ± 4.03160.82 ± 56.30a
2.2.1L-精氨酸对实验室残翅果蝇化蛹数的影响
由图3可知,实验组与对照组同一天开始化蛹,对照组化蛹时间主要集中在1 ~ 4 d,第3天达到最大化蛹值;实验组化蛹时间主要集中1 ~ 6 d,第5天达到最大化蛹值。最大化蛹值时实验组比对照组提高175.71%。第10天实验组化蛹数比对照组提高157.07%。
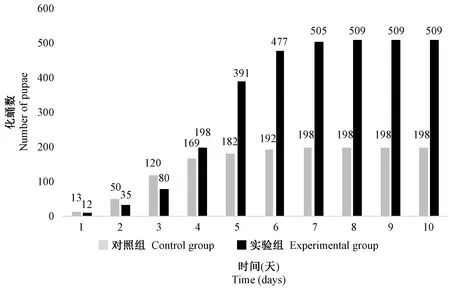
图3 L-精氨酸对实验室残翅果蝇化蛹数的影响Figure 3 Effect of L-arginine on the number of pupae of the residul wing (CyO) Drosophila melanogaster
2.2.2L-精氨酸对实验室残翅果蝇羽化数的影响
由图4可知,实验组与对照组残翅果蝇同一时间开始羽化,对照组在第3天达到羽化最大值,实验组在第5天达到羽化最大值,在羽化最大值时实验组比对照组提高132.84%。
2.3 L-精氨酸对实验室野生型果蝇繁殖性能的影响
由表3可知,实验组野生型果蝇化蛹数、羽化数、雌蝇只数和雄蝇只数分别比对照组提高233.33%、239.03%、263.24%和209.82%(P< 0.01),羽化率和雌雄比例实验组有所提高,但与对照组相比差异不显著(P> 0.05)。

图4 L-精氨酸对实验室残翅果蝇羽化数的影响Figure 4 Effect of L-arginine on the number of eclosions of the residual wing (CyO) Drosophila melanogaster

组别Groups化蛹数(个)Number of pupae羽化数(只)Number of eclosions雌蝇(只)Number of female flies雄蝇(只)Number of male flies羽化率(%)Eclosion rate (%)雌雄比例(%)Female/male ratio (%)对照组Control group36.00 ± 13.55B33.33 ± 12.28B18.17 ± 8.84B15.17 ± 3.92B93.52 ± 5.06131.70 ± 42.81实验组Experimental group120.00 ± 9.27A113.00 ± 13.83A66.00 ± 10.92A47.00 ± 7.35A94.17 ± 8.80143.64 ± 32.97
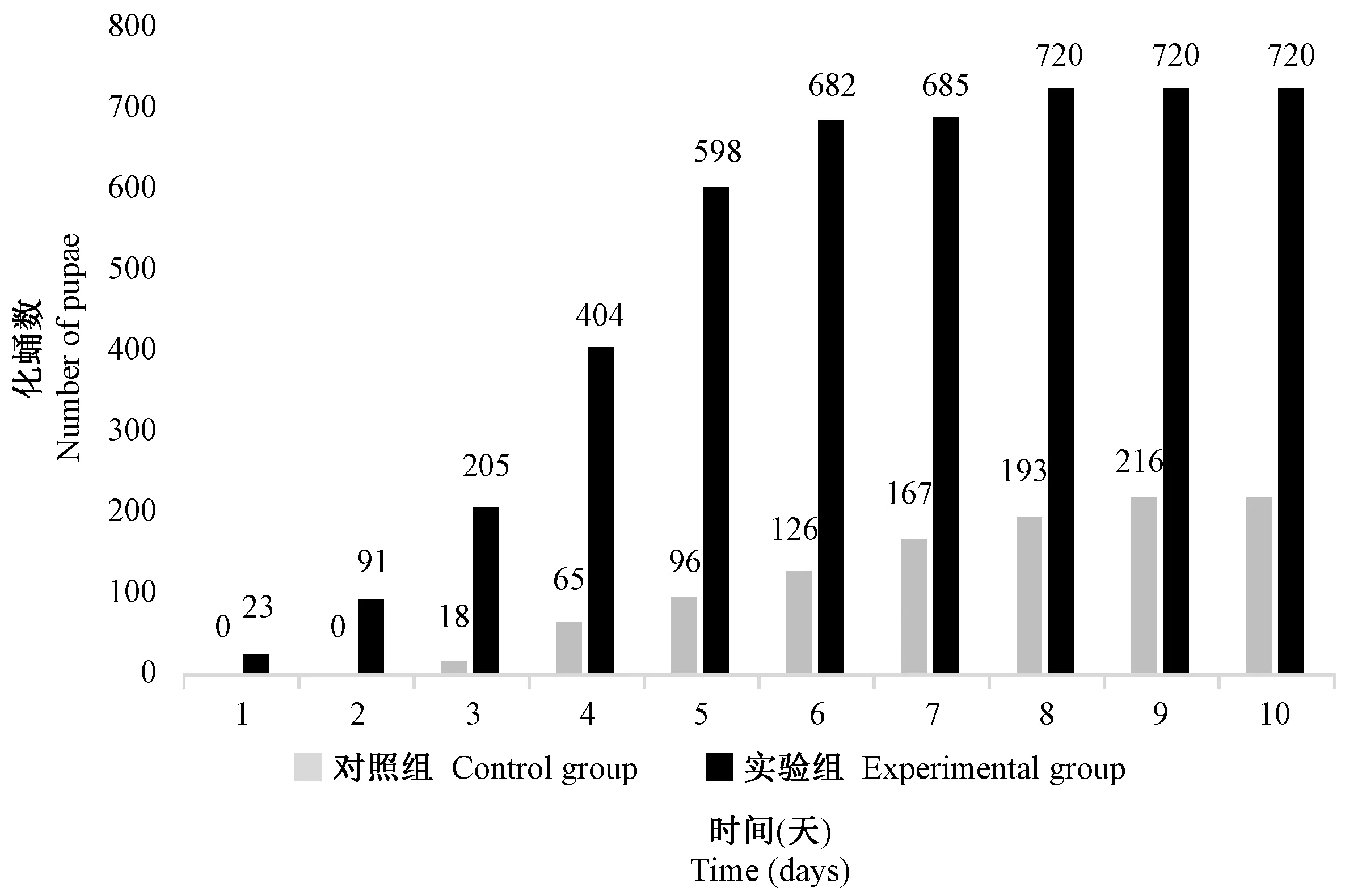
图5 L-精氨酸对实验室野生型果蝇化蛹数的影响Figure 5 Effect of L-arginine on the number of pupae of the wild type Drosophila melanogaster
2.3.1L-精氨酸对实验室野生型果蝇化蛹数的影响
由图5可知,野生型果蝇实验组化蛹时间比对照组提前2 d,实验组化蛹时间主要集中在1 ~ 6 d,在第4天化蛹数达到最大值199个;对照组化蛹时间主要集中在3 ~ 8 d,在第4天化蛹数达到最大值47个,在化蛹数达到最大值时实验组比对照组提高323.40%,在第10天实验组化蛹数比对照组高233.33%。
2.3.2L-精氨酸对实验室野生型果蝇结蛹数的影响
由图6可知,实验组羽化时间比对照组提前1 d,在第4天时对照组和实验组羽化数达到最大值,实验组比对照组提高324.56%。
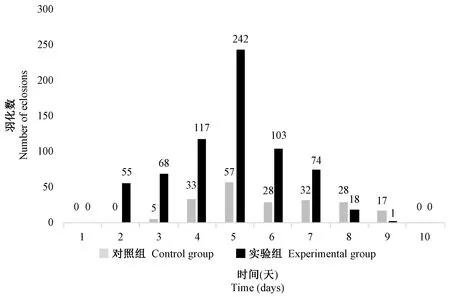
图6 L-精氨酸对实验室野生型果蝇羽化数的影响Figure 6 Effect of L-arginine on the number of eclosion of the wild type Drosophila melanogaster
综上所述培养基中添加1%的精氨酸均可提高果蝇的化蛹数、羽化数、雌雄只数,化蛹数和羽化数增加最明显的依次是白眼、野生型、残翅。各品系间羽化率均有所提高,其中羽化率最高的是残翅果蝇。培养基中添加1%的L-精氨酸后白眼果蝇和野生型果蝇化蛹时间均比对照组提前2 d。
3 讨论
精氨酸是机体必需氨基酸之一,具有较广泛的生物学作用,主要表现在提高生殖能力、预防疾病、提高免疫力、保健等[7]。Bayliak等[5]研究结果显示,低剂量的L-精氨酸可促进果蝇的生长发育,对果蝇三龄幼虫无显著影响,高剂量的L-精氨酸可抑制果蝇的羽化率,缩短果蝇的寿命,Kraaijeveld等[6]在培养基中添加不同剂量L-精氨酸,对果蝇的生存、发育和大小均无影响,但可提高果蝇的幼虫数和化蛹数。本实验中在实验室果蝇扩繁时,培养基中添加1%的L-精氨酸,白眼、残翅、野生型果蝇化蛹数、羽化数、羽化率均有所提高,与Kraaijeveld等[6]研究结果基本一致。果蝇的化蛹数与体内血细胞数息息相关[8],在培养基中添加L-精氨酸,可提高果蝇幼虫的免疫应答和血细胞数[9],说明果蝇幼虫血细胞数对果蝇的化蛹率至关重要[10]。
昆虫的生长发育受环境信号和内分泌信号的调节[11],精氨酸在哺乳动物中可促进胰岛素、生长激素等多种激素的释放[12]。研究表明保幼激素对昆虫的生殖发育有重要的影响,保幼激素的缺乏可引起昆虫成虫的滞育[13-14],同时保幼激素参与昆虫卵母细胞的成熟[15],激活插头转录因子FOXO的表达,促进卵黄原蛋白的合成,进而促进昆虫的繁殖力[16]。在本实验中培养基中添加L-精氨酸后,果蝇繁殖力提升的主要原因可能与L-精氨酸对果蝇激素分泌的调节有关。
NO是微生物中重要的活性分子物质[17],培养基中添加L-精氨酸后,果蝇幼虫血细胞产生大量的NO[6],可能会影响到果蝇幼虫肠道微生物变化。研究表明清除果蝇肠道细菌后,可引起果蝇的代谢失衡[18],给无菌处理后的果蝇接种肠道优势菌群,可很快恢复果蝇幼虫的生长发育[19],优势肠道细菌也可调节果蝇激素信号,促进果蝇的生长发育[20]。Lee等[21]研究表明,伯克霍尔德菌(Burkholderia)可通过hexamerin-α、hexamerin-β和vitellogenin-1三种血淋巴蛋白调控点蜂缘蝽的产卵和生长发育。用生物碱DNJ(1-脱氧野瓦霉素)处理桑叶,发现家蚕(Bombyxmori)GII-ɑ(ɑ-葡萄糖苷酶II)转录水平提高[22]。同时基因水平的变化也会影响到昆虫的生长发育,研究表明斜纹夜蛾采食芥菜或其它含有黑芥子苷和芸苔苷植物时,中肠内GSTepison1表达量显著上升,敲低GST(谷胱甘肽硫转移酶)epison1表达量可降低斜纹夜蛾采食量和延缓生长发育[23]。本实验中添加1%的L-精氨酸,果蝇化蛹数、羽化率均有所提高,但L-精氨酸提高果蝇繁殖性能的机理有待研究。
在本实验条件下,培养基中添加1%的L-精氨酸,可提高果蝇的化蛹数和羽化率,可用于实验室果蝇的扩繁。