术前外周血血小板/淋巴细胞比值和血小板相关指标对晚期下咽鳞癌的预后价值*
2019-10-31刘会勤陈琦薛继尧周梁张明
刘会勤,陈琦,薛继尧,周梁,张明
200031 上海,复旦大学附属眼耳鼻喉科医院 耳鼻喉科(刘会勤、陈琦、薛继尧、周梁、张明);200040 上海,上海市静安区中心医院 耳鼻喉科(陈琦)
头颈部鳞状细胞癌占全身恶性肿瘤的10%,全球每年新发病例约65万例。尽管治疗模式及理念的不断进步,近30年来该病患者的5年生存率仍维持在60%左右[1]。下咽鳞癌是一种侵袭性高的头颈部鳞状细胞癌,发病位置隐匿且症状不典型,约60%患者就医时就被诊断为晚期。临床上,美国癌症联合会(American Joint Committee on Cancer,AJCC) TNM分期系统依然是临床医生判断预后的主要手段,且目前尚无针对下咽鳞癌特异性高的生化指标来判断预后。近年来,随着系统性炎症的深入研究,人们发现外周血中的相关比值,如中性粒细胞/淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、血小板/淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)、淋巴细胞/单核细胞比值(lymphocyte-to-monocyte ratio,LMR)等与机体炎症高度相关[2-3],且被应用于多种恶性肿瘤的预后判断。本研究拟在前期针对喉鳞癌预后研究基础上,探讨术前外周血PLR和血小板(platelet,PCT)相关指标[血小板平均体积(mean platelet volume,MPV)、血小板分布宽度(platelet distribution width,PDW)]对晚期(TNM Ⅲ/Ⅳ)下咽鳞癌患者长期预后的影响。
1 资料与方法
1.1 临床资料
自2003年1月至2012年12月共计377例在我院耳鼻喉科接受手术治疗的下咽鳞癌患者,经过纳入排除标准后,将176例晚期下咽鳞癌患者纳入本研究。入选患者需符合:(1)经病理检查确诊为晚期下咽鳞癌,即AJCC TNM Ⅲ期或IV期(AJCC 7版);(2)患者或其家属自愿签署知情同意书、临床信息授权及随访资料;(3)临床信息、随访资料相对完整。201例排除病例包含:(1)病理不属于下咽鳞癌(n=2);(2)慢性炎症包括胃炎、肝炎、肾炎及系统性炎症如梅毒等病变(n=40);(4)有术前放化疗史(n=41);(5)临床信息及随访缺失(n=76);(6)伴有其他部位癌症(n=12);(7)伴活动期免疫性、血液性疾病患者(n=1);(8)长期服用抗凝药物史(n=4);(9)TNMⅠ期或Ⅱ期(n=53)。另外,收集我院眼科资料库随访的近视及白内障患者250例作为对照,年龄38~85岁,排除相关慢性炎症(包括胃炎、肝炎、肾炎)、系统性炎症(如梅毒)、伴活动期免疫性与血液性疾病患者,无长期抗凝药物使用史。
1.2 信息采集
入组下咽鳞癌患者均以手术为第一次治疗方式,回顾性收集自2003年1月至2012年12月患者的临床资料,包括年龄、性别、肿瘤原发部位、病理类型、分化程度、浸润深度、肿瘤最大直径、淋巴结转移情况。此外收集患者术前2周内的外周血常规指标,包括血小板计数、淋巴细胞计数、平均血小板体积、血小板分布宽度。我院下咽鳞癌手术患者住院前常规行喉镜、胃镜、腹部B超、颈/胸部CT等检查。相关外周血标本(血小板计数、淋巴细胞计数、PDW、MPV)等均使用全自动血细胞分析仪器(Mindary BC-5500)进行计数分析。所有患者数据均受到复旦大学附属眼耳鼻喉科医院伦理委员会监督。
1.3 随访
本研究选择总生存期(overall survival,OS)和无病生存期(disease-free survival,DFS)作为预后分析。自第一次手术治疗为观察起点,OS定义至随访终点存活时间段。DFS定义为患者为第一次治疗至患者出现复发,转移,或在随访期内死亡时间段。所有患者术后前两年每1~3月定期我院复诊,2年后半年复查一次。本研究末次随访日期为2017年12月30日。
1.4 统计学方法
采用SPSS 22.0软件统计分析。将患者治疗一开始的外周血PLR、血小板及其参数,用X-tile软件分高低2组,对分组的病人参数,如临床病理、性别、年龄、发病部位、肿瘤大小、术后转移等关系采用Pearson卡方检验或Fisher精确概率法分析。应用单因素及多因素Cox回归模型分析长期预后(5年OS及DFS)的相关独立影响因素。检验水准α=0.05,P<0.05代表具有统计学差异。应用Kaplan-Meier 法对相关独立影响因素计算生存率,不同分组患者生存率的比较采用 log-rank检验。
2 结 果
2.1 患者临床特征
176例患者中,男性172例,女性4例;年龄最小38岁,最大85岁[平均(58.74±9.91)岁];吸烟138人(78.4%),饮酒118人(67%);按下咽原发肿瘤部位分类:梨状窝型142例(80.7%)、咽后壁型23例(13.1%)、环后型11例(6.3%)。TNMⅢ期49例,Ⅳ期127例,伴淋巴结转移者152例,其中淋巴结融合67例,淋巴结数量≥3个97例,淋巴结外侵犯84例,有血管癌栓25例,颈部血管侵犯56例,出现术后转移病人95例(表1)。按原发灶手术方式:全喉全下咽手术24例,全喉部分下咽手术117例,部分下咽手术14例,部分喉部分下咽手术21例。平均随访时间是47.81±30.48月(4~147月)。总随访率为80%。5年总生存率为29.5%,术后复发及转移占54%。
表1 176例晚期下咽鳞癌患者基本情况
Table 1. Demographic Data of 176 Patients with Hypopharyngeal Squamous Cell Carcinoma

CharacteristicNumber(Ratio)Gender Male/female172 (97.7%)/4 (2.3%)Age (years) <60/≥6099 (56.3%)/77 (43.8%)Hypertension No/Yes130 (73.9%)/46 (26.1%)Diabetes mellitus No/Yes169 (96.0%)/7 (4%)Smoking history No/Yes38 (21.6%)/138 (78.4%)Drinking history No/Yes58 (33%)/118 (67%)Tumor location Pyriform sinus/Post-cricoid/Posterior pharyngeal142 (80.7%)/11 (6.3%)/23 (13.1%)Differentiation grade Good and moderate/Poor155 (88.1%)/21 (11.9%)Platelet (x±s,109/L)208.86±61.12Lymphocyte (x±s,109/L)1.803±0.486Platelet-to-lymphocyte ratio(x±s) 123.74±45.91Mean platelet volume x±s, fL 10.011±1.31Platelet distribution width (x±s,%)14.952±2.4

CharacteristicNumber(Ratio)TNM stage Ⅲ/Ⅳ49 (27.8%)/127 (72.2%)Tumor classification T1/T2/T3/T4A/T4B9 (5.1%)/37 (21%)/82 (46.6%)/46 (26.1%)/2 (1.1%)Lymph node dissection No/Yes10 (5.7%)/166 (94.5%)Node classification N0/N1/N2a/N2b/N2c/N324 (13.6%)/41 (23.3%)/4 (2.3%)/79 (44.9%)/9 (5.1%)/19 (10.8%)Vascular embolus No/Yes151 (85.8%)/25 (14.2%)Metastasis No/Yes81 (46%)/95 (54%)Follow-up time (x±s,month)47.81±30.48
2.2 晚期下咽癌患者与健康对照组PLR、MPV、PDW比较
将250例对照组与本研究176例晚期下咽癌患者血液中PLR、MPV、PDW进行t检验,并得出如图1A~C。从中发现晚期下咽鳞癌患者平均PLR (123.7±3.46)及PDW(14.95±0.18)均较健康对照组平均PLR(108.6±2.52)及PDW(11.77±0.15)升高,且二者差异有统计学意义(P<0.001),进一步分析MPV,发现晚期下咽鳞癌患者外周血平均MPV(10.01±0.099)较健康对照组MPV(10.54±0.024)降低,两者间差异有统计学意义(P<0.05)。

图1 比较晚期下咽癌及健康对照组PLR、MPV、PDW分布
Figure1.PLR,MPV,PDWDistributioninAdvancedHPSCCandHealthyControls
A: Compared with the healthy controls, advanced HPSCC patients exhibit higher PLR (P<0.001); B: Compared with the healthy controls, advanced HPSCC patients exhibit lower MPV (P=0.032); C: Compared with the healthy controls, advanced HPSCC patients exhibit higher PDW (P<0.001). PLR: Platelet-to-lymphocyte ratio; MPV: Mean platelet volume; PDW: Platelet distribution width; HPSCC: Hypopharyngeal squamous cell carcinoma. PLR, MPV, and PDW in healthy controls and advanced HPSCC patients were analyzed throught-test.
2.3 X-tile分组后的PLR和血小板相关参数与患者相关临床因素的关系
X-tile软件(Chicago,Rim实验室)查找外周血指标PLR、PLT、MPV、PDW的最佳截点,该截值点选择依据最高卡方值及最低P值。对5年OS分析中得出各截点:PLR为170.8,PLT为260×109/L,MPV为8.2fL,PDW为16.5%,血小板分布宽度/血小板计数(mean platelet volume to plateler count ratio,MPV/P)为0.036,和血小板分布宽度/血小板计数(platelet distribution width to platelet count ratio,PDW/P)为0.0634。对5年DFS分析中得出各截点:PLR为139.6,PLT为271×109/L,MPV为11.1fL,PDW为16.5%,MPV/P为0.036,PDW/P为0.0634,AUC及P值分别列于表2、表3。依截点将PLR、MPV、PDW分成高低2组,Pearson或精确卡方检验对其可能影响下咽癌生存预后的临床危险因素如抽烟、喝酒、糖尿病、高血压、T分级、N分级以及病理提示的颈内静脉侵犯、癌栓、术后转移等进行组内探查,分析OS时,癌栓、饮酒史在高PLR组间差异有统计学意义(P<0.05),癌栓则在高MPV分组间差异有统计学意义(P<0.05;表4);分析无病生存期时,发现升高PLR与术后转移的发生相关,升高的PDW与较高肿瘤分期相关,差异具有统计学意义(P<0.05;表5);此临床意义提示癌栓可能影响总生存率,而高肿瘤分期及术后转移提示可能与无病生存期相关,为了探查生存时间与各组之间的关系,进一步验证发现,高PLR组在OS及DFS均有较差的平均总生存期,差异有统计学意义(P<0.05)。
表2 5年OS最佳cut-off值选择及其曲线下面积(AUC)
Table 2. Optimal Cut-off Points Chosen and Their AUCs in 5-year OS

VariableAUC(%)P 95%CICut-off pointSensitivity(%)Specificity(%)PLR70.70.0010.634-0.773170.875.8662.59PLT75.20.0010.682-0.81426096.9742.66MPV64.40.0350.568-0.7158.262.8265.00PDW62.90.0060.553-0.70016.597.2226.43
OS: Overall survival; AUC: Area under the curve; CI: Confidence interval; PLR: Platelet-to-lymphocyte ratio; PLT: Platelet; MPV: Mean platelet volume; PDW: Platelet distribution width.
表3 5年DFS最佳cut-off值选择及其曲线下面积 (AUC)
Table 3. Optimal Cut-off Points Chosen and Their AUCs in 5-year DFS

VariableAUC (%)P 95%CICut-off pointSensitivity(%)Specificity(%)PLR65.70.0010.581-0.726139.672.1353.04PLT78.60.0010.718-0.84427180.0069.54MPV60.50.0470.528-0.6788.266.6755.00PDW61.50.0160.539-0.68716.597.2224.29
DFS: Disease-free survival; AUC: Area under the curve; CI: Confidence interval; PLR: Platelet-to-lymphocyte ratio; PLT: Platelet; MPV: Mean platelet volume; PDW: Platelet distribution width.
表4 分析5年总生存期时PLR、MPV分组与各临床因素的关系
Table 4. Variables in Different PLR and MPV Groups When Doing 5-Year Overall Survival
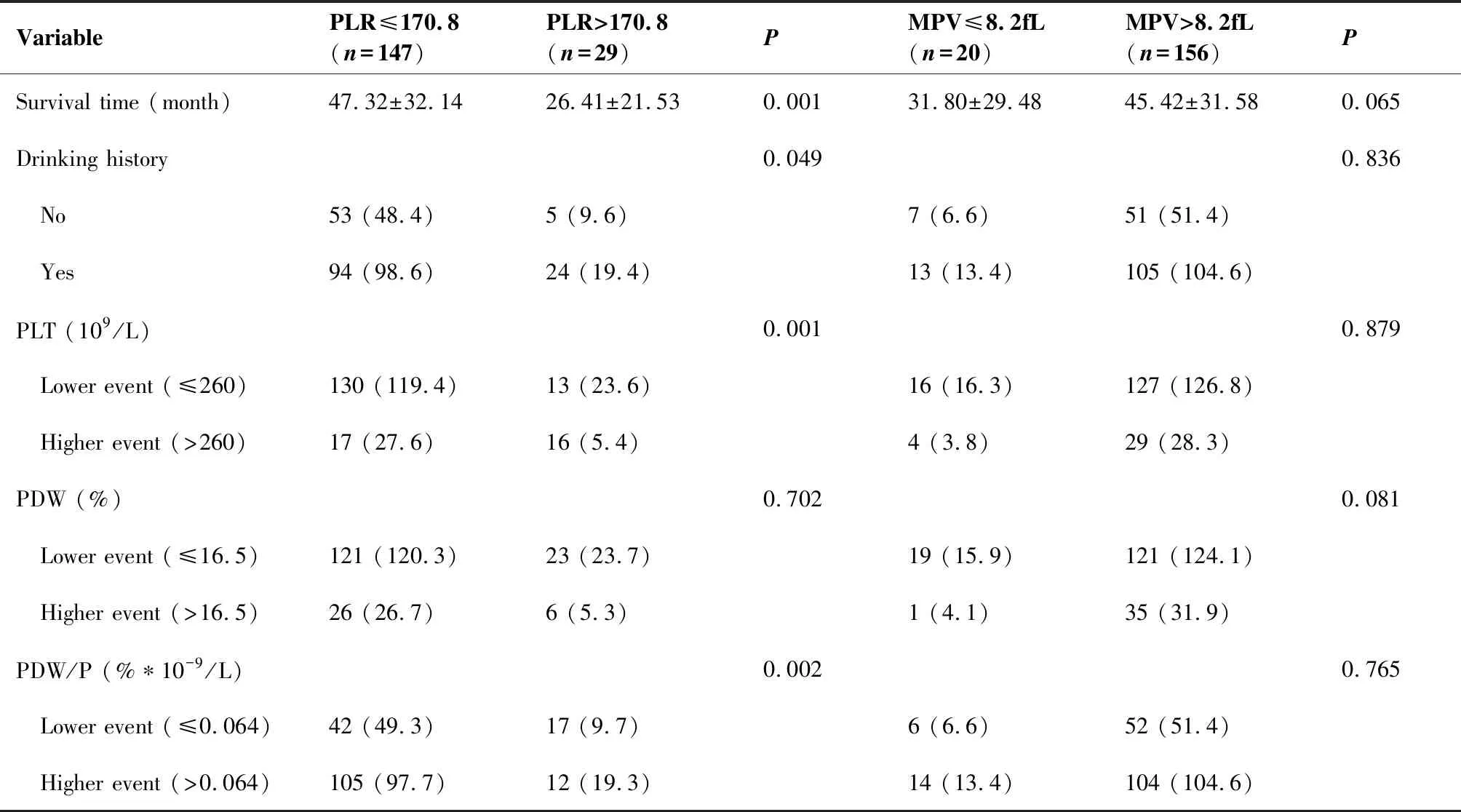
VariablePLR≤170.8(n=147)PLR>170.8(n=29)PMPV≤8.2fL(n=20)MPV>8.2fL(n=156)PSurvival time (month)47.32±32.1426.41±21.530.00131.80±29.4845.42±31.580.065Drinking history0.0490.836 No53 (48.4)5 (9.6)7 (6.6)51 (51.4) Yes94 (98.6)24 (19.4)13 (13.4)105 (104.6)PLT (109/L)0.0010.879 Lower event (≤260)130 (119.4)13 (23.6)16 (16.3)127 (126.8) Higher event (>260)17 (27.6)16 (5.4)4 (3.8)29 (28.3)PDW (%)0.7020.081 Lower event (≤16.5)121 (120.3)23 (23.7)19 (15.9)121 (124.1) Higher event (>16.5)26 (26.7)6 (5.3)1 (4.1)35 (31.9)PDW/P (%∗10-9/L)0.0020.765 Lower event (≤0.064)42 (49.3)17 (9.7)6 (6.6)52 (51.4) Higher event (>0.064)105 (97.7)12 (19.3)14 (13.4)104 (104.6)

VariablePLR≤170.8(n=147)PLR>170.8(n=29)PMPV≤8.2fL(n=20)MPV>8.2fL(n=156)PTNM stage0.0650.406 Ⅲ45 (40.9)4 (8.1)4 (5.6)45 (43.4) Ⅳ102 (106.1)25 (20.9)16 (14.4)111 (112.6)Tumor classification0.4650.902 T1-T240 (38.4)6 (7.6)5 (5.2)41 (40.8) T3-T4107 (108.6)23 (21.4)15 (14.8)115 (115.2)Node classification0.9790.715 N020 (20.0)4 (4.0)2 (2.7)22 (21.3) N+127 (34.2)25 (6.8)18 (17.3)134 (134.7)Vascular embolus0.0240.032 No130 (126.1)21 (24.9)14 (17.2)137 (133.8) Yes17 (20.9)8 (4.1)6 (2.8)19 (22.2)Metastasis0.1550.423 No82 (78.5)12 (15.5)9 (10.7)85 (83.3) Yes65 (68.5)17 (13.5)11 (9.3)71 (72.7)
t-test was used to analyze mean survival time; Pearson’s chi-squared test or Fisher exact test were used to verify other clinical variables in different PLR and MPV groups when doing 5-year OS. Components of this table: Observed values (predicted values). PLR: Platelet-to-lymphocyte ratio; MPV: Mean platelet volume; PLT: Platelet; PDW: Platelet distribution width; PDW/P: Platelet distribution width to platelet count ratio.
表5 分析5年无病生存期时PLR、PDW分组与各临床因素关系
Table 5. Variables in Different PLR and PDW Groups When Doing 5-Year Disease Free Survival

VariablePLR≤139.6(n=115)PLR>139.6(n=61)PPDW≤16.5%(n=144)PDW>16.5%(n=32)PSurvival time (month)50.36±31.6331.63±24.90<0.00147.05±33.1031.50±20.810.008Differentiation grade0.7240.622 Good and moderate102 (01.3)8 (7.3)18 (17.2)3 (3.8) Poor13 (13.7)53(53.7)126 (126.8)29 (28.2)PLT (109/L)0.0010.200 Lower event (≤271)110 (98.7)41 (52.3)121 (123.5)30 (27.5) Higher event (>271)5 (16.3)20 (8.7)23 (20.5)2 (4.5)MPV0.0330.001 Lower event (11.1)86 (91.5)54 (48.5)125 (114.5)15 (25.5) Higher event (11.1)29 (23.5)7 (12.5)19 (29.5)17 (6.5)MPV/P (fL∗10-9/L)0.0010.061 Lower event (≤0.036)12 (26.1)28 (13.9)37 (32.7)3 (7.3) Higher event (>0.036)103 (88.9)33 (47.1)107 (11.3)29 (24.7)PDW/P (%∗10-9/L)0.0010.001 Lower event (≤0.064)24 (38.6)35 (20.4)56 (47.5)2 (10.5) Higher event (>0.064)91 (76.4)26 (40.6)88 (96.5)30 (21.5)TNM stage0.1590.405 Ⅲ36 (32)13 (17)43 (37.6)3 (8.4) Ⅳ79 (83)48 (44)101 (106.4)29 (23.6)Tumor classification0.0750.015 T1-T235 (30.1)11 (15.9)42 (36.6)4 (9.4) T3-T480 (84.9)50 (45.1)98 (103.4)32 (26.6)
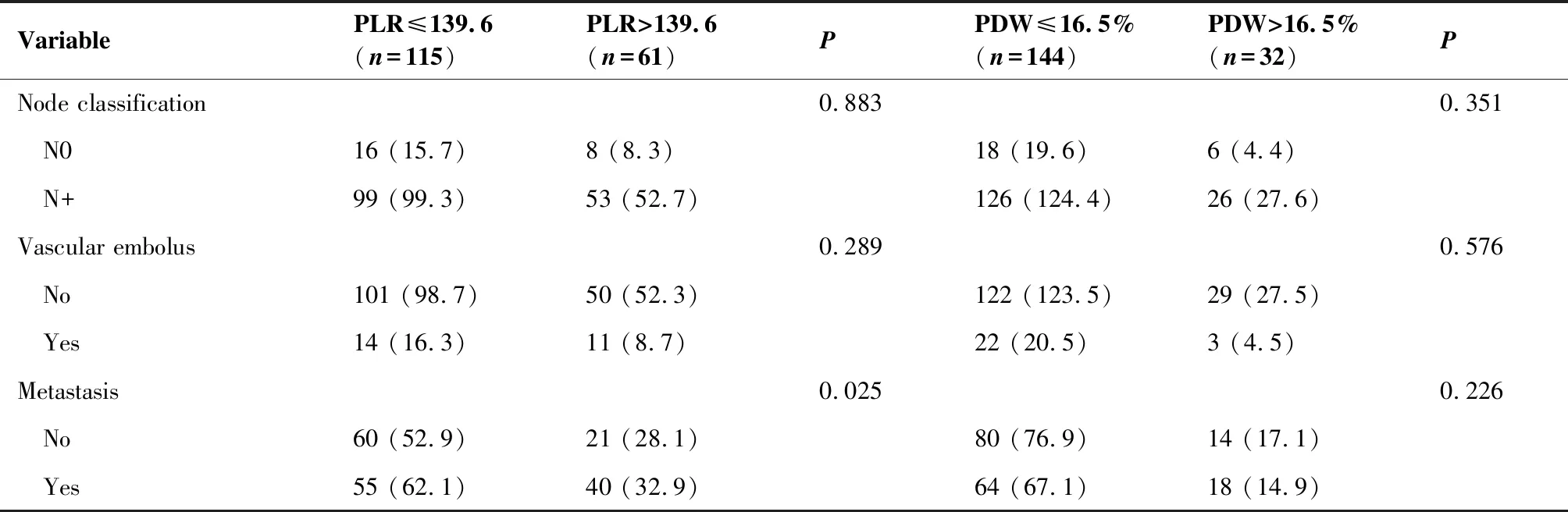
VariablePLR≤139.6(n=115)PLR>139.6(n=61)PPDW≤16.5%(n=144)PDW>16.5%(n=32)PNode classification0.8830.351 N016 (15.7)8 (8.3)18 (19.6)6 (4.4) N+99 (99.3)53 (52.7)126 (124.4)26 (27.6)Vascular embolus0.2890.576 No101 (98.7)50 (52.3)122 (123.5)29 (27.5) Yes14 (16.3)11 (8.7)22 (20.5)3 (4.5)Metastasis0.0250.226 No60 (52.9)21 (28.1)80 (76.9)14 (17.1) Yes55 (62.1)40 (32.9)64 (67.1)18 (14.9)
t-test was used to analyze mean survival time; Pearson’s chi-squared test or Fisher exact test were used to verify other clinical variables in different PLR and PDW groups when doing 5-year DFS. Components of this table: Observed values (predicted values). PLR: Platelet to lymphocyte ratio; PDW: Platelet distribution width; PLT: Platelet; MPV: Mean platelet volume; MPV/P: Mean platelet volume to platelet count ratio; PDW/P: Platelet distribution width to platelet count ratio.
2.4 Kaplan-Meier法进行单因素筛查、生存分析及log-rank检验
在5年OS中,对比低PLR组与高MPV组,术前高PLR组与低MPV组与长期OS的差异有统计学意义(P<0.001),其5年总生存率分别为10.3%(高PLR组)、 33.3%(低PLR组);31.4%(高MPV组)、 15.0%(低MPV组)(图2A-B);在5年DFS中,对比低PLR组与低PDW组,术前高PLR组与高PDW组与长期DFS的差异有统计学意义(P<0.001),其5年无病生存率分别为14.8%(高PLR组)、 32.2%(低PLR组);10.3%(高PDW组)、33.9%(低PDW组)(图2C-D),术后放化疗对5年OS及DFS,差异无统计学意义(P>0.05)(图3A-B)
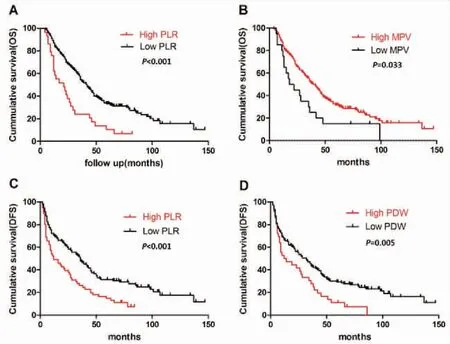
图2 Kaplan-Meier 生存分析比较不同PLR、MPV、PDW组生存率
Figure2.CumulativeSurvivalofDifferentPLR,MPVandPDWGroupsAnalyzedbyUsingKaplan-MeierMethod
Cumulative survival in different groups (PLR, MPV and PDW) were estimated by using Kaplan-Meier method, and log-rank test was used to evaluate corresponding differences. A: Compared to the lower PLR group, the higher PLR group indicates poor 5-year OS (P<0.05); B: Compared to the higher MPV group, the lower MPV group indicates poor 5-year OS (P<0.05); C: Compared to the lower PLR group, the higher PLR group indicates poor 5-year DFS (P<0.001); D: Compared to the lower PDW group, the higher PDW group indicates poor 5-year DFS (P<0.01). PLR: Platelet-to-lymphocyte ratio; MPV: Mean platelet volume; PDW: Platelet distribution width; OS: Overall survival; DFS: Disease free survival.

图3 Kaplan-Meier 生存分析比较术后放化疗组和术后无放化疗生存率 (OS, DFS)
Figure3.CumulativeSurvivalofPatientswithorwithoutPostoperativeChemoradiotherapyAnalyzedbyUsingKaplan-MeierMethod
Kaplan-Meier method was used to analyze cumulative survival (overall survival and disease free survival) of patients with or without postoperative chemoradiotherapy, and log-rank test was used evaluate corresponding differences. A: There is no statistically significant difference in the overall survival between patients with or without postoperative chemoradiotherapy (P>0.05). B: There is no statistically significant difference in the disease free survival between patients with or without postoperative chemoradiotherapy (P>0.05).
2.5 影响晚期下咽鳞癌患者OS及DFS的单因素及多因素Cox模型分析结果
将可能影响晚期下咽鳞癌预后的变量分别纳入Cox 单因素分析,如年龄、肿瘤大小、肿瘤分期、TNM分期、T分级、N分级、颈内静脉侵犯及相关外周血指标(PLR、PLT、MPV、PDW、MPV/P、PDW/P)等危险因素,得出影响5年OS的危险因素有:年龄、肿瘤直径、T分级、手术切缘、颈静脉侵犯、术后转移等临床因素以及外周血指标(PLR、PLT、MPV、PDW、MPV/P、PDW/P)纳入Cox多因素回归分析模型分析,得出影响患者5年OS的独立危险因素为高PLR组、高PLT组、低MPV组、术后转移、T分级(P<0.05)(表6)。依据同样方法得出影响5年无病生存率的独立危险因素有高PLR、高PDW、T分级、TNM分期(P<0.05)(表7)。
表6 Cox单因素及多因素分析(5年OS)
Table 6. Univariate and Multivariate Analysis of 5-Year OS

VariableOS(HR)P(95%CI)OS(HR)P(95%CI)Age (year)0.0130.088 <601(0.458-0.911)1(0.496-1.050) ≥600.6460.721Maximum diameter of tumor (cm)0.0040.124 ≤41(1.176-2.342)1(0.918-2.034) >41.6591.366TNM stage (AJCC)0.055N/AN/A Ⅲ1(0.992-2.108) Ⅳ1.446Tumor classification<0.0010.005 T1-T21 (1967-4.881)1(1.252-3.551) T3-T43.0982.108PLR<0.0010.026 Lower event (≤170.8)1(1504-3.545)1(1.072-2.963) Higher event (>170.8)2.3091.783PLT (109/L)<0.0010.004 Lower event (≤260)1(1.948-4.442)1(1.407-6.230) Higher event (>260)2.9412.961

VariableOS(HR)P(95%CI)OS(HR)P(95%CI)PDW (%)0.0040.246 Lower event (≤16.5)1(1.211-2.752)1(0.823-2.142) Higher event (>16.5)1.8261.328MPV (fL)0.0390.007 Lower event (≤8.2)1(0.359-0.973)2.227(0.252-0.800) Higher event (>8.2)0.5911PDW/P(%∗10-9/L)0.0060.363 Lower event (≤0.0635)1(0.434-0.870)1(0.743-2.252) Higher event (>0.0635)0.6141.293MPV/P (fL∗10-9/L)0.0040.432 Lower event (≤0.036)1(0.383-0.840)1(0.675-2.505) Higher event (>0.036) 0.5711.300Metastasis0.0010.001 No1(2.675-5.480)1(1.964-4.360) Yes3.8292.926IJVI0.0390.074 No1(1.018-2.054)1(0.967-2.097) Yes1.4461.424Surgical margin (cm)0.0250.438 ≥0.51(1.051-2.072)1(0.788-1.733) <0.51.4751.169
Five-year OS was analyzed by the Cox model. OS: Overall survival;CI: Confidence interval; AJCC: American Joint Committee on Cancer; PLR: Platelet to lymphocyte ratio; PLT: Platelet; PDW: Platelet distribution width; MPV: Mean platelet volume; PDW/P: Platelet distribution width to platelet count ratio; MPV/P: Mean platelet volume to platelet count ratio; IJVI: Internal jugular vein invasion.
表7 Cox单因素及多因素分析 (5年DFS)
Table 7. Univariate and Multivariate Analysis of 5-Year DFS

VariableDFS(HR)P(95%CI)DFS(HR)P(95%CI)Age (year)0.0020.004 <601(0.416-0.822)1.691(0.602-1.521) ≥600.5851Maximum diameter of tumor (cm)0.0270.709 ≤41(1.044-2.059)1(0.737-1.588) >41.4661.075TNM stage (AJCC)0.0450.023 Ⅲ1(1.099-2.135)1(1.066-2.340) Ⅳ1.4681.579Tumor classification<0.0010.003 T1-T21 (1.607-3.770)1(1.288-3.329) T3-T42.4622.071PLR0.0010.028 Lower event (≤139.6)1(1.303-2.595)1(1.046-2.778) Higher event (>139.6)1.8391.525
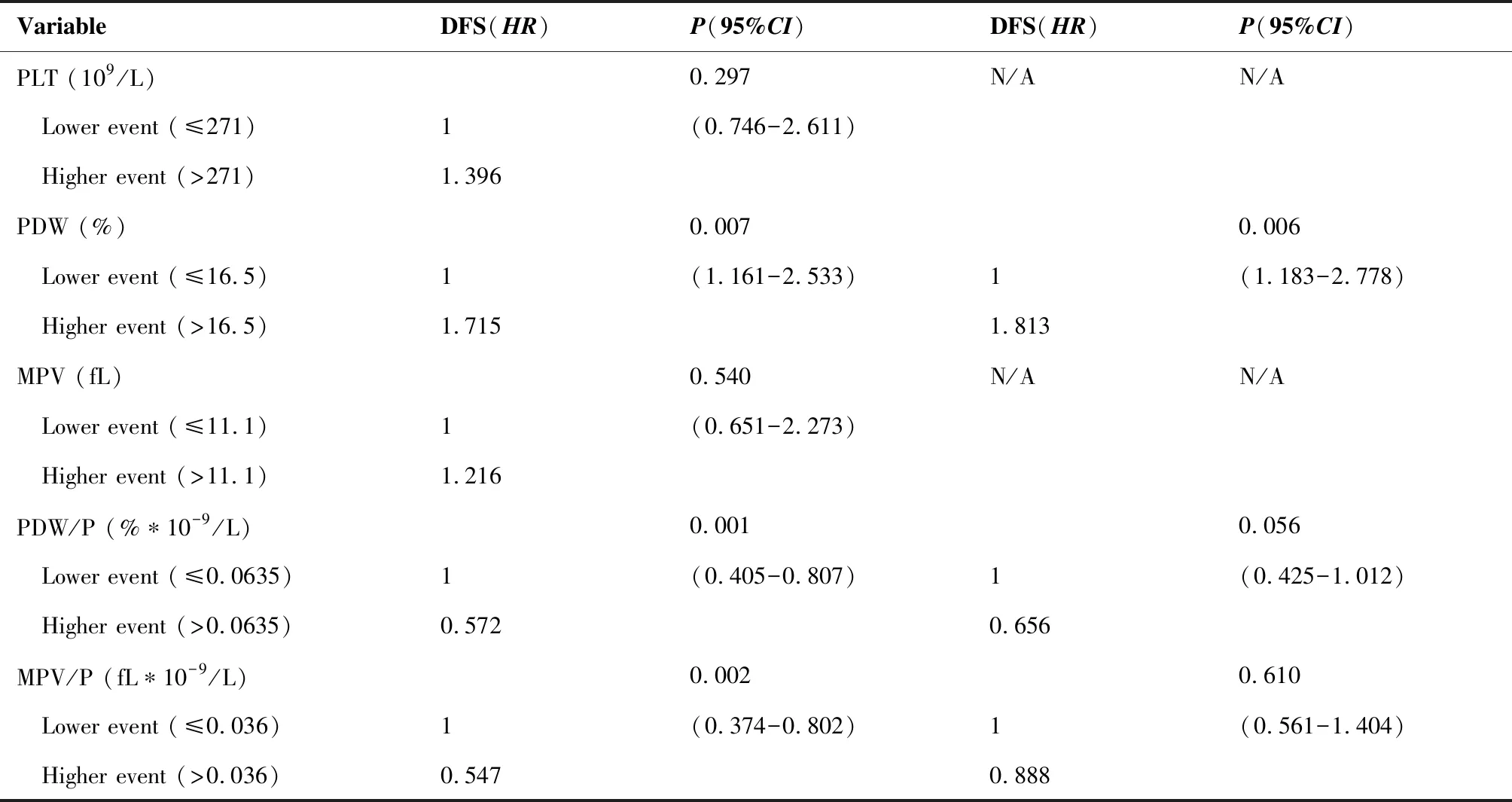
VariableDFS(HR)P(95%CI)DFS(HR)P(95%CI)PLT (109/L)0.297N/AN/A Lower event (≤271)1(0.746-2.611) Higher event (>271)1.396PDW (%)0.0070.006 Lower event (≤16.5)1(1.161-2.533)1(1.183-2.778) Higher event (>16.5)1.7151.813MPV (fL)0.540N/AN/A Lower event (≤11.1)1(0.651-2.273) Higher event (>11.1)1.216PDW/P (%∗10-9/L)0.0010.056 Lower event (≤0.0635)1(0.405-0.807)1(0.425-1.012) Higher event (>0.0635)0.5720.656MPV/P (fL∗10-9/L)0.0020.610 Lower event (≤0.036)1(0.374-0.802)1(0.561-1.404) Higher event (>0.036) 0.5470.888
Five-year DFS was analyzed by the Cox model. DFS: Disease Free Survival;CI: Confidence interval; AJCC: American Joint Committee on Cancer; PLR: Platelet to lymphocyte ratio; PLT: Platelet; PDW: Platelet distribution width; MPV: Mean platelet volume; PDW/P: Platelet distribution width to platelet count ratio; MPV/P: Mean platelet volume to platelet count ratio.
3 讨 论
下咽鳞癌是一种侵袭性高且症状隐匿的头颈部鳞癌,患者就诊时常被诊断为晚期(TNM III/IV)。尽管对晚期下咽鳞癌的治疗及理念不断改变[4],但不管是欧美提倡的高保喉率的同步放化疗或诱导化疗,还是中国抗癌协会临床肿瘤学协作专业委员会提倡以手术为主的综合治疗[5],远期总生存率并没有因此得到改善。目前AJCC TNM分期系统仍是指导临床医生判断肿瘤预后的重要参照,但仅通过解剖部位的分期在晚期肿瘤中仍存在局限性,尤其肿瘤的浸润、侵袭迁移、增殖信号传递、血管生成,均需要通过血液进行信号传递,因此有必要进一步深入探讨血液组分对肿瘤患者的影响,以补充临床上对晚期下咽鳞癌患者的总体认识。
随着肿瘤的深入研究,人们发现机体炎症、免疫反应都与肿瘤发生发展的相关,有研究者于1968年发现富含血小板能使TA3腹水瘤细胞发生转移,从而拓展了外周血细胞的认知[6]。近年来,IL-6信号通路被证实在系统性炎症出现时能进一步上调外周血细胞[7],且准确性高[8],但IL-6检测费用高昂,不适宜推广应用。因此,目前研究多着重使用快速、便宜、易获取的相关外周血比值NLR、PLR、LMR等作为预测肿瘤预后的指标,并在肺癌[9-10]、结直肠癌[11]、食管癌[12]、乳腺癌[13],头颈鳞癌[14]等中证实与预后密切相关。
对于血小板促进肿瘤进展、炎症及免疫反应的的假说与机制主要体现如下方面[6]:1)血小板能覆盖肿瘤细胞表面逃逸T细胞或NK细胞的免疫打击;2)释放黏附分子,如选择素P(P-selectin)、血管内皮生长因子等促进肿瘤在远处血管或内皮细胞进行桥接,实现循环中肿瘤细胞种植;3)血小板细胞因子IL-6、IL-1、G-CSF释放,促进血栓形成及血管重塑;4)肿瘤所处的炎症微环境能够聚集中性粒细胞、单核细胞等、同时肿瘤又促进炎症持续性的进展,导致肿瘤进一步发生侵袭转移[15]。淋巴细胞是机体参与免疫功能的重要细胞,能对抗外来感染及肿瘤侵犯,如果出现淋巴细胞减少,往往提示机体免疫变差,可导致肿瘤的发生发展,Liu等[16]在鼻咽癌研究中发现出现淋巴细胞缺乏往往提示较差的预后。
血小板的相关参数包含血小板数量(total platelet count,TPC)和体积(platelet volume index, PVI),TPC是由血小板在机体中生成及消耗中的动态平衡的总和,在恶性肿瘤细胞中TPC处于高生成及高消耗,然而Seretis等[17]在结肠癌研究中发现即使正常的血小板计数是也是可以掩盖患者高凝状态及促炎癌症表型。PVI包含MPV和PDW,主要用来推论血小板的大小,近年来研究显示MPV能反映炎症前期及血栓前期的情况[18];PDW能说明血小板的异质性及活动度[19]。目前多数研究认为MPV较低的患者预后更差,这可能源于高炎症反应下血小板大量的消耗,尤其MPV容易受到血小板细胞肿胀的影响,因此选择PDW似乎更为直观准确[20]。Fu等[21]对比喉良性肿物及正常空白对照发现216例喉癌患者中,外周血MPV是下调且PDW是上调的。但在Eryilmaz等[22]研究96例头颈肿瘤中却发现MPV升高才影响患者预后。目前在头颈部肿瘤中,PDW肿瘤预后研究的仍少,Zhang等[23]研究241例喉癌中发现高PDW组(>16.7%)有较差的预后;而Xie等[24]也发现高PLT(>266×109/L)和高PDW组(>16.3%)在鼻咽癌患者提示更差预后。此外,MPV/P及PDW/P等比值也被应用于肿瘤预后[25]、栓塞[26]等回顾性研究中,这些结论均为本研究分析提供了基础与思路。
分析对照组及晚期下咽癌患者外周血PLR、MPV、PDW得出,PLR及PDW可能是评估肿瘤发生发展预后的促进因素,而MPV则是拮抗因素。为了有效评价晚期下咽鳞癌患者术前外周血PLR,血小板相关参数与各临床因素对5年生存期(OS、DFS)的相关性,我们使用X-tile作为截点选择工具[27]。X-tile是芝加哥大学Rim实验室设计的一种可视化、与结果高度相关的截止点选择软件,目前已被应用在许多生化指标选择及回顾性研究中。本研究依照最高卡方值及最低的P值选择最佳截点,其优点在于此唯一值具备较好的评价能力。不过纳入分析后发现5年的OS和DFS两者截点稍有不同,其差异的原因可能在于晚期下咽鳞癌术后补充放化疗的应用,使得即使出现术后复发转移的患者也能有较长的总生存期。在分组后,用独立样本t检验分析总生存时间得出升高PLR有明显较差OS及DFS(P<0.05),由于PLR、MPV、PDW组内样本数量上有所差距,因此在F检验后本研究进一步探讨组内差异性研究,发现在癌栓的变化可能是引起总生存期OS差异的危险因素,而术后转移及高肿瘤分期可能是影响DFS的危险因素,其余无明显统计学差异(P>0.05),说明分组后组内成分应是均衡的。
针对影响预后的独立危险因素分析发现,5年的OS中,高PLR(>170.8)和高PLT(>260×109/L)、低MPV(<8.2fL)有较差的预后,而截止点不同的5年DFS分析中,高PLR(>139.6)和高PDW(>16.5%)则提示较差预后及肿瘤进展的可能,这些与目前头颈肿瘤外周血指标的相关文献报道是一致的。本研究进一步发现下咽鳞癌术后放化疗不能影响总体预后(P>0.05),反而因此侧面证实术前外周血指标具有提示预后的应用价值。
综上,外周血PLR升高是可以成为判断晚期下咽鳞癌长期预后(5年OS、DFS)共同的独立危险因素,但本研究仍仅是单一机构的回顾性研究,且X-tile选出唯一值容易出现样本量差异大的情况,同时本研究随访跨度较长,样本量仍偏少,因此需要多中心、大规模的前瞻性研究再进一步证实。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
