miR-199a-3p通过调控CBX7对肺癌细胞A549侵袭与迁移的影响*
2019-10-31龚娇芳胡娟鲁兵何元勇黄翠萍
龚娇芳,胡娟,鲁兵,何元勇,黄翠萍
437000湖北 咸宁,咸宁市第一人民医院 呼吸内分泌科(龚娇芳、胡娟、鲁兵、何元勇); 437000湖北 咸宁,湖北省科技学院(黄翠萍)
肺癌为临床常见的恶性肿瘤,发病率和死亡率均较高。随着分子生物学研究进展,新的肿瘤标记物和治疗靶点为肺癌的诊断和治疗提供了全新的方向[1]。
微小RNA(microRNAs, miRNA)是一类非编码RNA,能够在转录水平对所调控基因发挥抑制或促进其表达的作用。近年来,miRNA与肿瘤的发生、发展的相关研究成为热点[2]。研究显示,miRNA在不同组织中表达具有特异性,癌基因可高表达miRNA来发挥控制细胞分化和凋亡的作用,从而促进肿瘤的发生和发展。例如miR-372对抑癌基因LATS2的抑制作用[3];反之,抑癌基因在肿瘤中低表达miRNA,通过抑制癌基因或控制细胞分化和凋亡的基因来阻止肿瘤的发展,如let-7对原癌基因RAS的负调控。有研究证实,miR-199a-3p与非小细胞肺癌骨转移有明显的相关性[4]。本研究拟探讨miR-199a-3p在肺癌中的表达及临床意义,并在细胞学水平分析miR-199a-3p对肺癌细胞增殖、侵袭、迁移能力的影响。
大量研究证明,色素框同源蛋白7(pigment box homologous protein 7,CBX7)与肿瘤的发生、发展有密切的关系,但是CBX7与肿瘤恶性程度的关系在不同的肿瘤中表现不同。在前列腺癌中,前列腺癌细胞与正常细胞中均高表达CBX7[5];在膀胱癌以及甲状腺肿瘤中,随着肿瘤恶性程度的增加,CBX7的表达水平下调[6]。有学者在研究中证实,恢复CBX7表达能够增加人肺癌细胞对化疗药物治疗的敏感性[7]。 生物信息软件预测提示CBX7是miR-199a-3p可能作用的靶基因, 本研究探讨了CBX7与miR-199a-3p的调控关系,以及CBX7对肺癌发生发展的影响。
1 材料与方法
1.1 细胞及标本来源
肺癌细胞株NCI-H460、NCL-H1975、hLAMP、HCL-H358、A549、NCL-H1299及正常人肺支气管上皮细胞株BEAS-2B,购自美国典型培养物保藏中心(American Type Culture Collection,ATCC),液氮中保存。
组织标本来源于2015年12月至2018年6月咸宁市第一人民医院收治的非小细胞肺癌患者的肺癌组织及癌旁正常组织(距肿瘤边缘大于5cm),共134 例。其中男性72例,女性62例,平均年龄(60.07±13.56)岁,均经组织病理学检查证实。患者术前未接受化疗或放疗,均知情同意。TNM分期I期17例,II期20例,III期37例,IV期60例;肿瘤直径>5cm者79例,≤5cm者55例。所有组织标本采集后-80℃冰箱备用。
1.2 细胞复苏
取出冻存于液氮罐中的肺癌细胞株NCI-H460、NCL-H1975、hLAMP、HCL-H358、A549、NCL-H1299及正常人肺支气管上皮细胞株BEAS-2B,迅速放入37℃预培育箱中,融化后加入含10%胎牛血清的培养液(DMEM培养液)。
1.3 细胞培养
肺癌细胞株NCI-H460、NCL-H1975、hLAMP、HCL-H358、A549、NCL-H1299及正常人肺支气管上皮细胞株BEAS-2B放入DMEM培养液中培养(10%的胎牛血清、100 U/mL青霉素-链霉素)。
1.4 细胞传代
细胞融合85%左右时开始传代。PBS冲洗3次,加入胰蛋白酶(1mL 0.25%)消化后,置于37℃培养箱内2min,显微镜观察细胞突起消失后,终止消化,离心(1 000r/min, 5min)后弃上清液,重新加入培养液,制备单细胞悬液,计数,按照1:3比例在原培养环境下继续培养。重复上述步骤传代。
1.5 qRT-PCR检测miR-199a-3p、CBX7基因mRNA的表达
采用qRT-PCR检测肺癌患者癌组织、癌旁组织、各肺癌细胞株及正常人肺支气管上皮细胞株中miR-199a-3p、CBX7基因 mRNA的表达。RNA提取后合成cDNA,进行PCR反应(各实验步骤均严格按照试剂盒说明书进行)。每个样本重复3次。引物序列:
miR-199a-3p-F:5’-ACACCAGCTGGGTACAGT-AGTCTGCACA-3’
miR-199a-3p-R:5’-GTGTCGTGGAGTCGGCAATTC-3’
U6-F: 5’-CTCGCTTCGGCAGCACA-3’
U6-R: 5’-AACGCTTCACGAATTTGCGT-3’
CBX7-F: 5’-GCGTGCGGAAGGGTAAAGT-3’
CBX7-R: 5’-GCTTGGGTTTCGGACCTCTC-3’
GAPDH-F: 5’-AGAAGGCTGGGGCTCArTTG-3’
GAPDH-R: 5’-AGGGGCCATCCACAGTCTTC-3’
1.6 Western Blot检测CBX7蛋白的表达
Western Blot检测肺癌组织、癌旁正常组织、肺癌细胞株中CBX7蛋白的表达。细胞转染48h后,提取蛋白用于Western blot分析。40ug蛋白加入SDS-PAGE孔槽里,转于Hybond nitrecellulose膜(GE Healhcare)。5%脱脂牛奶封闭,anti-CAMKK2(兔抗,ab96531,稀释倍数1:150)或anti-β-actin(兔抗,sc-7210)一抗孵育。SuperSignal West PICO荧光显像试剂盒(pierce biotechnology)检测蛋白条带大小。
1.7 荧光素酶报告基因法检测miR-199a-3p 与靶基因CBX7的结合
利用microRNA靶基因数据库预测miR-199a-3p与CBX7可能的作用位点。构建CBX7野生型3’-UTR荧光素酶质粒pMIR-WT和突变型质粒pMIR-Mut。将pMIR-WT、pMIR-Mut与CBX7模拟物和negative control miRNA mimics共转染进A549细胞,转染24小时后,去除培养基,PBS清洗3次,弃净PBS,每孔加入100μL被动裂解液(passive lysis buffer,PLB),室温下将培养板置于平板摇床上,轻微晃动15分钟。待细胞裂解后,将20μL样本转移至发光用96孔板上,并置于超级酶标仪的检测板上,设置自动进样器1和2分别分装100μL的LARII和Stop&Glo试剂。测量时,使用1~2s延迟和5~10s读数。如此循环操作直至所有样本检测完毕。使用酶标仪配套软件进行结果分析。相对荧光素酶活性(relative luciferase activity)=萤火虫荧光素酶活性(firefly luciferase activity)/海肾荧光素酶活性(renilla luciferase activity)。
1.8 CCK8检测细胞增殖
用培养液配成单个细胞悬液,以每孔1 000~10 000个细胞接种到96孔板,每孔体积200μL。培养12h、24h、48h及72h后,每孔加CCK8溶液20μL。继续孵育4h,终止培养,离心后再吸弃孔内培养上清液。2×103个细胞培植于96孔板,培养24、48及72h后,细胞由20μL的CCK8溶液孵育4小时。采用酶标仪检测495nm波长的吸光光度值(optical density,OD),判定细胞的活力,采用均数±标准差表示细胞活力的相对表达水平。
1.9 流式细胞法检测细胞周期
采用直径为10厘米的培养皿收集细胞,70%乙醇固定,40摄氏度下过夜。染色前,重新收集细胞、PBS静置,propidium Iodide(PI)溶液染色细胞,37℃下孵育15分钟。采用流式细胞仪获取数据(BD FACSVerse TMSystem,BD Biosciences),软件分析数据(BD FACSuite TM software)。采用均数±标准差表示S期细胞比值。
1.10 Transwell实验
无血清培养基包被Transwell小室底部膜上室,风干,加入无血清培养基,制备细胞悬液,终止消化,无血清培养基重悬。调整细胞密度后加入Transwell小室中,应用含胎牛血清的培养基培养12h,接种后伊红染色。
1.11 平板克隆形成实验
收集处于对数生长期的各组细胞,调整其浓度至500/mL,接种于6孔细胞培养板,每孔2mL,即1 000个细胞/孔,培养板中预先加入经37℃预温的培养液,接种后轻轻转动培养板,使细胞分散均匀,置于37℃,5% CO2及饱和湿度的培养箱中继续培养7天,期间适时更换新的培养液。经常观察细胞克隆出现日期及细胞生长情况,去上清,终止培养,并用1×PBS漂洗3次,每孔加甲醇1mL,摇床振荡,固定10min,将培养板倒置,并铺一张带网格的透明胶片,用肉眼直接计数每个格的克隆数。克隆形成率计算公式为:(形成的克隆数/接种细胞数)×100%。
1.12 统计学方法
采用SPSS 22.0统计软件进行统计分析,非正态分布资料组间比较采用秩和检验,多组数值比较采用WILCOXON法,P<0.05为差异有统计学意义。
2 结 果
2.1 qRT-PCR检测miR-199a-3p的表达
肺癌组织中miR-199a-3p的相对表达量(1.45±0.20)显著高于癌旁正常组织(1.00±0.01),差异有统计学意义(P<0.01)。
2.2 不同临床特征患者肺癌组织中miR-199a-3p的表达比较
参考文献中的方法[8],将肺癌患者中位miR-199a-3p 表达水平设为分界值,低于平均水平为低表达,等于或高于平均水平为高表达。TNM分期III+IV期miR-199a-3p高表达的比率明显高于TNM分期I+II期,差异有统计学意义(P<0.05)(表1)。
表1 miR-199a-3p在肺癌中的表达量与临床特征的关系
Table 1. Relationship between MiR-199a-3p Expression in Lung Cancer and Clinical Characteristics of Patients
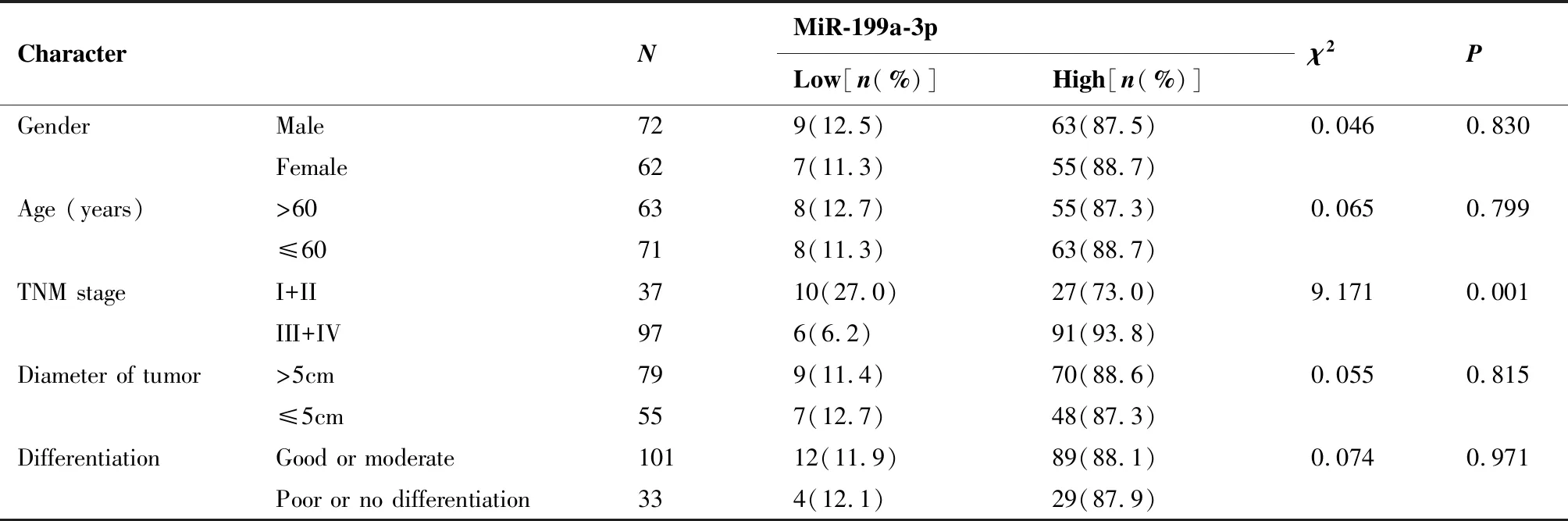
CharacterNMiR-199a-3pLow[n(%)]High[n(%)]χ2PGenderMale729(12.5)63(87.5)0.0460.830Female627(11.3)55(88.7)Age (years)>60638(12.7)55(87.3)0.0650.799≤60718(11.3)63(88.7)TNM stageI+II3710(27.0)27(73.0)9.1710.001III+IV976(6.2)91(93.8)Diameter of tumor >5cm799(11.4)70(88.6)0.0550.815≤5cm557(12.7)48(87.3)DifferentiationGood or moderate10112(11.9)89(88.1)0.0740.971Poor or no differentiation334(12.1)29(87.9)
2.3 肺癌组织和癌旁组织中CBX7 mRNA及蛋白的表达
qRT-PCR检测肺癌组织中CBX7 mRNA的相对表达量(0.58±0.06)显著低于癌旁组织(1.00±0.02),差异具有统计学意义(P<0.01)。通过Western blot检测肺癌组织中CBX7蛋白的表达水平比癌旁正常组织显著降低,差异有统计学意义(P<0.05)(图1)。

图1 Western blot检测肺癌肿瘤组织和癌旁正常组织中CBX7蛋白的表达
Figure1.ExpressionofCBX7inLungCancerTissueandNon-TumorTissueDetectedbyWesternBlot
2.4 荧光素酶报告结果
通过生物信息软件预测与miR-199a-3p相互作用的靶基因,发现CBX7的mRNA 3’UTR区域存在miR-199a-3p 可能互补结合的位点,提示CBX7是miR-199a-3p可能作用的靶基因。荧光素酶报告基因分析结果如图2,在肺癌细胞株A549中共转染CBX7野生型3’-UTR荧光素酶报告基因质粒pMIR-Wt或突变型报告基因质粒pMIR-Mut以及miR-199a-3p mimic或miR-NC,采用双荧光素酶报告基因实验验证miR-199a-3p是否能直接靶向作用于CBX7。结果显示,共转染pMIR-Wt和miR-199a-3p mimic时,荧光素酶活性明显降低(P<0.01),而共转染pMIR-Mut和miR-199a-3p mimic时,荧光素酶活性无明显变化,提示:CBX7的3’-UTR区域存在位点与miR-199a-3p互补结合。
2.5 qRT-PCR检测各株肺癌细胞系中miR-199a-3p、CBX7 mRNA的表达
各肺癌细胞株中miR-199a-3p的表达量均显著高于BEAS-2B,CBX7 mRNA的表达量均显著低于BEAS-2B,差异具有统计学意义(P<0.01)(图3、4)。
2.6 qRT-PCR检测A549 细胞中miR-199a-3p的表达
A549 细胞转染 miR-199a-3p mimics后miR-199a-3p的相对表达水平(11.26±1.15)显著高于阴性对照组(1.19±0.23),差异有统计学意义(P<0.01),A549细胞转染 miR-199a-3p inhibitor后miR-199a-3p的相对表达水平(0.32±0.05)显著低于阴性对照组(1.22±0.13),差异有统计学意义(P<0.01)。
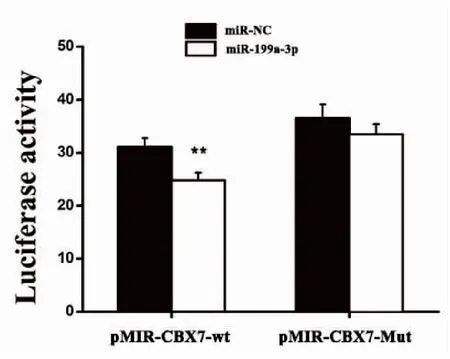
图2 荧光素酶报告分析实验检测miR-199a-3p与CBX7 mRNA 的作用位点
Figure2.ActionSitesofMiR-199a-3pandCBX7mRNAdetectedbyLuciferaseReporterAssay(ComparedwithmiR-NCgroup, **P<0.01)

图3 qRT-PCR各株肺癌细胞系中miR-199a-3p表达的比较
Figure3.ExpressionofMiR-199a-3pinEachLungCancerCellLineDetectedbyqRT-PCR(ComparedwithBEAS-2B, **P<0.01)

图4 qRT-PCR各株肺癌细胞系中CBX7 mRNA的表达比较(与BEAS-2B细胞株比较,**P<0.01)
Figure4.ExpressionofCBX7mRNAinEachLungCancerCellLineDetectedbyqRT-PCR(ComparedwithBEAS-2B,**P<0.01)
2.7 miR-199a-3p转染肺癌细胞A549中的CBX7 mRNA及蛋白表达情况
miR-199a-3p mimics转染组CBX7的mRNA表达水平明显低于阴性对照组[(0.61±0.08)vs(1.00±0.10)],CBX7蛋白表达水平也显著低于阴性对照组,差异有统计学意义(P<0.01)(图5)。

图5 Western blot检测过表达miR-199a-3p可抑制肺癌细胞A549中的CBX7蛋白表达
Figure5.WesternBlotShowingtheExpressionofCBX7inA549InhibitedbytheOverexpressionofMiR-199a-3p
2.8 CCK8实验检测miR-199a-3p抑制CBX7促进肺癌细胞A549增殖
CCK8实验检测结果显示,miR-199a-3p mimics转染组的OD值(2.45±0.30)显著高于正常对照组(1.72±0.22),差异有统计学意义(P<0.01);而miR-199a-3p mimics+CBX7转染组的OD值(1.41±0.16)显著低于miR-199a-3p mimics转染组(2.45±0.30),差异有统计学意义(P<0.01)(图6)。
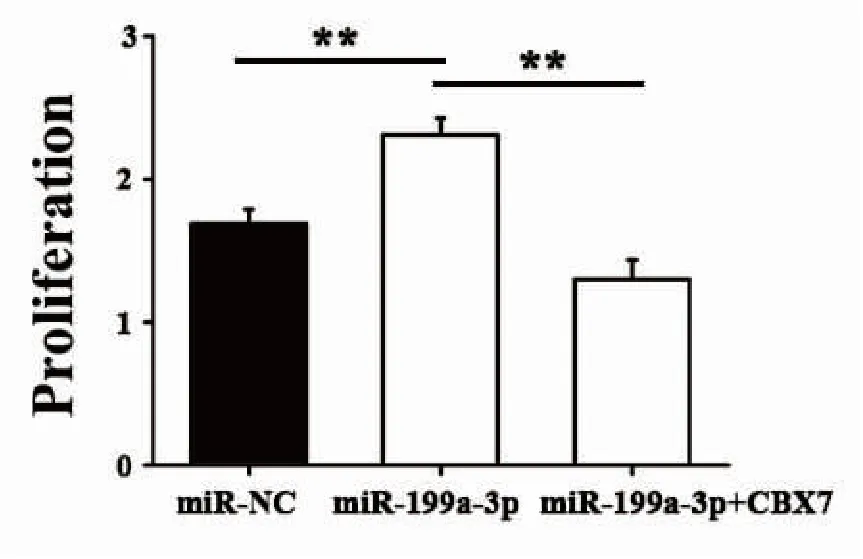
图6 CCK8实验检测miR-199a-3p抑制CBX7促进肺癌细胞A549增殖
Figure6.CCK8AssayShowingCBX7InhibitedandtheProliferationofA549PromotedbyMiR-199a-3p
2.9 流式细胞法检测miR-199a-3p抑制CBX7促进肺癌细胞A549周期S期的聚集
将培养好的肺癌细胞A549分为miR-NC组、miR-199a-3p mimics组、miR-199a-3p mimics+CBX7组,分别转染negative control miRNA mimics、miR-199a-3p mimics、miR-199a-3p mimics+CBX7。流式细胞法检测结果显示miR-199a-3p mimics转染组S期细胞比值(22.04±2.30)显著高于miR-NC组(16.03±1.77),差异有统计学意义(P<0.01);miR-199a-3p mimics+CBX7转染组S期细胞比值(7.85±0.82)显著低于miR-199a-3p mimics转染组(22.04±2.30)和miR-NC组,差异均有统计学意义(P<0.01)。
2.10 Transwell实验检测miR-199a-3p抑制CBX7促进肺癌细胞A549侵袭与迁移能力
将negative control miRNA mimics (miR-NC), miR-199a-3p mimics和CBX7转染进A549细胞,采用Transwell实验检测A549细胞侵袭与迁移能力的改变,结果显示,A549细胞中miR-199a-3p mimics转染组穿膜细胞数及迁移能力显著高于对照组,差异有统计学意义;而miR-199a-3p mimics+CBX7转染组穿膜细胞数及迁移能力显著低于miR-199a-3p mimics转染组,差异有统计学意义(图7)
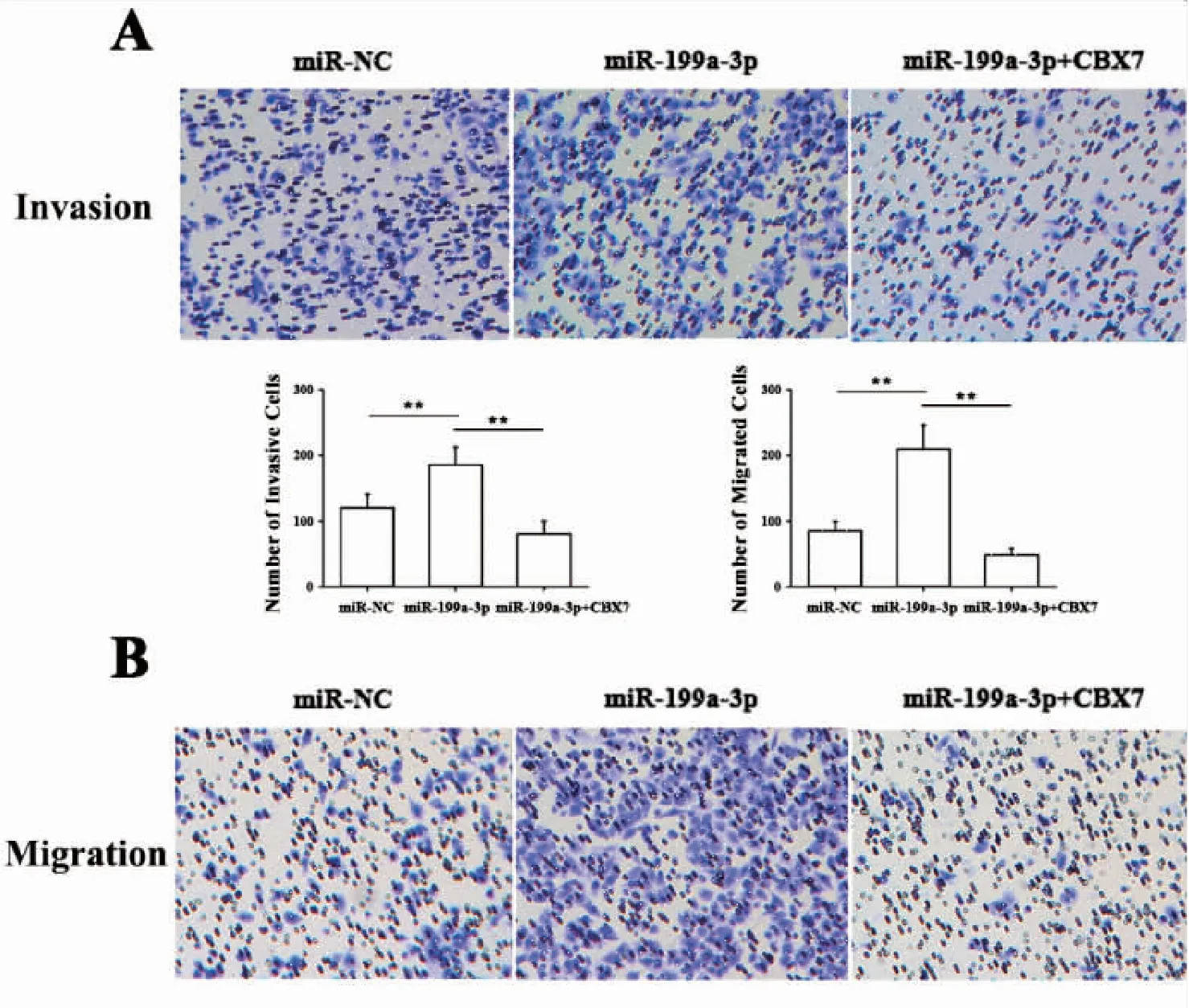
图7 Transwell实验检测miR-199a-3p抑制CBX7促进肺癌细胞A549侵袭与迁移能力(**P<0.01)
Figure7.TranwellAssayShowingCBX7InhibitedandtheInvasionandMigrationofA549PromotedbyMiR-199a-3p(**P<0.01)
Transwell cell invasion assay found that the invasion (Panel A) and migration (Panel B) ability of the miR-199a-3p mimics+CBX7 transfection group significantly decreased.
2.11 Western blot 检测CBX7蛋白表达水平
将培养好的肺癌细胞A549分为miR-NC组、CBX7组,分别转染negative control miRNA mimics+ miR-199a-3p inhibitor、CBX7 siRNA +miR-199a-3p inhibitor,使用Western blot 检测A549细胞中CBX7 蛋白表达水平,结果发现A549细胞中CBX7组CBX7 蛋白表达水平与miR-NC组相比显著降低[(0.42±0.05)vs(1.39±0.22)],差异有统计学意义(P<0.01)(图8)。
2.12 平板克隆形成实验检测细胞增殖能力
将培养好的肺癌细胞A549分为miR-NC组、CBX7组,分别转染negative control miRNA mimics+ miR-199a-3p inhibitor、CBX7 siRNA +miR-199a-3p inhibitor。通过平板克隆形成实验进行检测,检测结果显示,CBX7组细胞形成克隆相对数与miR-NC组相比显著升高[(3.34±0.32)vs(1.00±0.12)],差异具有统计学意义(P<0.01)。

图8 Western blot 检测CBX7蛋白表达水平
Figure8.ExpressionLevelofCBX7DetectedbyWesternBlot
3 讨 论
近年来随着新的生物信息学方法和技术的产生和发展,miRNA被更多的人关注和研究,使miRNA成为基因诊断和治疗研究的新热点。许多研究表明,miRNA与肿瘤的发生发展密切相关,具有重要的作用[9-13]。研究显示,肺癌组织中miR-21的表达水平明显高于癌旁正常组织,体外细胞实验也证实,miR-21能够对蛋白酪氨酸磷酸酶(phosphatase and tensin homolog deleted on chromosome ten,PTEN)基因发挥负调控作用,从而促进肿瘤细胞的侵袭和转移[14]。Liu等[15]在研究中发现,miR-31能够对抑瘤基因LATS2和PPP2R2A发挥负调控作用,促进肺癌细胞增殖和小鼠肺癌移植瘤成瘤,发挥类似原癌基因的效应。Kong 等[16]通过研究证实miR-155在肺癌中通过对转化生长因子(transforming growth factor, TGF)信号通路的促进作用,发挥诱导上皮细胞向间叶组织转化的效应,起到类似癌基因的功能。miRNA已成为一种新兴的肿瘤标志物,为研究恶性肿瘤的发病机制、治疗提供了新的靶点,因此对miRNA与肿瘤的关系进行深入广泛的研究,具有非常重要的临床意义。
研究证实十余种miRNA通过参与上皮间质转化、细胞凋亡、细胞程序性死亡、相关基因调控等环节,发挥促进或抑制肺癌发生发展的作用[17-18]。多种miRNA也成为肺癌诊断和治疗的新靶点。本研究发现肺癌组织中miR-199a-3p的相对表达量比癌旁正常组织显著升高,肺癌细胞株中miR-199a-3p的表达量均显著高于正常肺细胞。以上结果提示miR-199a-3p的高表达与肺癌的发生、发展有密切的关系。研究还发现miR-199a-3p高表达与患者肿瘤 TNM分期有一定关系。推测miR-199a-3p在临床上将有可能成为辅助肺癌的诊断和判断预后的重要因素。
miRNA通常在转录后水平调控靶基因的表达,在与靶基因结合时,成熟miRNA 一般与靶基因3′UTR结合,直接抑制或降解靶基因,使靶基因表达降低[19]。有研究报道,miR-199a可通过调控HIF-1α等抑制非小细胞肺癌的增殖[20];miR-199a-3p可以通过抑制SMARCA2表达,下调SMARCA4表达,抑制TGF-β表达,诱导恶性肿瘤细胞转移,TGF-β又可调控上皮间质转化参与肿瘤细胞转移[21];在非小细胞肺癌中,miR-199a-3p可调控表皮生长因子受体信号通路影响肺癌的转移[22]。本研究发现CBX7 mRNA 3’UTR的碱基存在miR-199a-3p可能互补结合的位点,提示CBX7是miR-199a-3p可能作用的靶基因。之后的研究也证实了miR-199a-3p可与CBX7的mRNA 3’UTR区域的碱基特异性互补结合,抑制荧光素酶活性的表达。A549细胞miR-199a-3p mimics转染组中CBX7 mRNA表达水平及蛋白水平均显著降低,提示miR-199a-3p能够通过抑制CBX7 的mRNA翻译,抑制CBX7 蛋白水平表达。
CBX7属于多梳蛋白(polycomb protein group,PcG)家族成员,在多梳蛋白复合物对靶基因的染色质进行转录后修饰的过程中,CBX7发挥介导靶基因的转录抑制的作用,从表观遗传学的角度沉默靶基因,并参与细胞的增殖、分化、衰老及肿瘤的发生等多个生物学过程。大量研究表明,CBX7作为PcG家族成员之一,参与调控细胞的衰老、凋亡等生理过程,其异常表达往往预示着癌症的发生[23-24]。本研究发现肺癌组织中CBX7 mRNA的相对表达量、CBX7蛋白的表达水平比癌旁正常组织显著降低,肺癌细胞株中CBX7 mRNA的表达水平均显著低于正常肺细胞。提示CBX7的低表达与肺癌的发生、发展有密切的关系。
本研究发现,转染miR-199a-3p的细胞体外增殖能力显著增强。提示miR-199a-3p能促进肺癌细胞A549的增殖能力。而转染了miR-199a-3p+ CBX7后,miR-199a-3p对肺癌细胞A549增殖能力的促进作用明显减弱。说明CBX7具有抑制肺癌细胞增殖的作用。
流式细胞法检测结果提示,miR-199a-3p能促进肺癌细胞A549周期S期的聚集能力,但CBX7同样抑制了该效果。本研究中, Transwell实验检测结果提示,在肺癌中miR-199a-3p表达上升,可能引起CBX7表达的降低,并最终促进了肺癌细胞A549的侵袭和迁移。
为了进一步验证miR-199a-3p的靶基因,本研究用miR-199a-3p inhibitor 封闭A549细胞内miR-199a-3p的表达,同时转染CBX7 siRNA 将CBX7的表达沉默。在细胞miR-199a-3p表达水平很低的情况下,利用CBX7 siRNA 封闭CBX7,通过Western blot和平板克隆形成实验检测细胞能否恢复A549细胞原有的功能。结果发现,细胞中CBX7蛋白表达水平与转染阴性对照相比明显降低。进而采用平板克隆形成实验,检测细胞形成克隆的能力,发现CBX7 siRNA与miR-199a-3p inhibitor转染A549细胞后,细胞形成克隆相对数与阴性对照相比明显增高。可见,miR-199a-3p inhibitor抑制了A549细胞中miR-199a-3p的表达,而CBX7 siRNA将CBX7 表达沉默后致A549细胞中CBX7表达降低的同时使A549细胞恢复了形成克隆的能力。这有力证明了 miR-199a-3p通过负调控CBX7促进肺癌细胞A549的增殖。
综上所述, miR-199a-3p能够通过对CBX7的负调控作用,促进肺癌细胞A549的增殖、侵袭和迁移过程,从而促进肺癌的发生与发展。推测miR-199a-3p可能成为未来肺癌诊断及治疗的新靶点。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
