硫辛酰胺对高糖条件下肾小管上皮细胞氧化应激及转化生长因子β激活酶1和核转录共抑制因子蛋白表达的影响
2019-10-29毛彦稳张小欢刘慧铭王圆圆汤磊郭兵
毛彦稳 张小欢 刘慧铭 王圆圆 汤磊 郭兵
贵州医科大学1病理生理学教研室,2重大疾病发病机制及药物防治特色重点实验室,3医药卫生管理学院(贵阳550025)
研究表明,由持续高血糖状态和晚期糖基化终末产物(advanced glycation end products,AGE)的增加引起的氧化应激是糖尿病肾病(diabetic nephropathy,DN)早期发病机制之一[1-5]。在DN 病理进程中,氧化应激的发生造成肾小球内皮细胞、基底膜细胞及系膜细胞发生氧化损伤,蛋白尿增多,最终使得肾功能受损[6-7]。硫辛酰胺(dl-alphalipoamide,ALM)对氧化损伤的保护作用更多的是作为一种间接抗氧化剂,同时刺激线粒体生物合成和诱导Ⅱ期抗氧化酶,且对糖尿病周围神经病变也有防治作用[8]。本课题组前期研究发现[9-11],高糖(high glucose,HG)条件下,核转录共抑制因子SonN(ski-related novel protein N,SnoN)具有抑制细胞外基质(extra-cellular matrix,ECM)的沉积和肾小管上皮细胞向间质细胞转分化(epithelial-mesenchymaltransition,EMT)发生的作用[12-13],表明SnoN 蛋白在延缓肾小管上皮纤维化进程中扮演重要角色。另有研究发现,活化的TAK1 可通过磷酸化SnoN 从而促进其泛素化并降解,降低SnoN 蛋白的稳定性[14],转化生长因子β激活激酶TAK1[transforming growth factor-β(TGF-β)-activated protein kinase 1,TAK1]活化后还可调节ECM的发生[15]。因此,本研究旨在探究ALM 降低高糖时肾小管上皮细胞氧化应激损伤的作用是否通过介导TAK1 及SnoN 蛋白的表达而实现的,为临床延缓DN 的病程提供实验理论依据。
1 材料与方法
1.1 主要材料及试剂硫辛酰胺(上海生工,中国),DMEM 细胞培养基(Hyclone 公司,美国),TAK1,p-TAK1(Thr184/187)(CST 公司,美国),SnoN(Santa Cruz 公司,美国),CollagenⅢ,Desmin(Sigma 公司,美国),β-actin 单克隆抗体(博士德公司,美国),胎牛血清(Gibco 公司,美国),一抗稀释液,TritonX-100,BCA(bicinchoninic acid)蛋白浓度测定试剂盒,ECL 显色剂(北京碧云天生物研究所),FITC-anti-α-SMA(abcam公司,美国),PE-anti-E-cadherin(BD 公司,美国),丙二醛(malondialdehyde,MDA)、总超氧化物歧化酶(Total Superoxide Dismutase,T-SOD)检测试剂盒(南京建成公司,中国)。
1.2 方法
1.2.1 细胞分组细胞随机分为:(1)正常糖(NG)组:2% FBS+DMEM+5.5 mmol∕L Glucose;(2)高糖(HG)组:2%FBS+DMEM+25 mmol∕L Glucose;(3)高糖+硫辛酰胺组(HG+ALM):2% FBS+DMEM+25 mmol∕L Glucose+ALM(200 μmol∕L),分别处理至6 孔板、培养皿及培养瓶中,48 h 后收取细胞蛋白,供各检测指标的进行(包括Western Blot 及氧化应激)。
1.2.2 细胞免疫荧光细胞接种至铺有盖玻片的6 孔板中,将生长状态良好,融合度达到70%的NRK-52E 细胞加入细胞静止液,置(37 ℃,5%CO2)培养箱16 h,使细胞同步化生长,PBS 37 ℃漂洗细胞3 次,5 min∕次,预冷细胞固定液固定20 min,PBS 37 ℃漂洗细胞3 次,5 min∕次,吸取多余封闭液,加入用细胞免疫荧光一抗稀释液分别配置的特异性一抗E-cadherin(1∶200),平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)(1∶100),4 ℃慢摇孵育过夜。室温下复温10 min,细胞漂洗液37 ℃漂洗细胞3 次,5 min∕次。按免疫荧光试剂盒说明书操作,把荧光标记二抗按1∶1 000 比例用试剂盒提供二抗稀释液进行稀释E-cadherin 孵育抗兔FITC,α-SMA 孵育抗小鼠Cy3,37 ℃避光孵育1 h,细胞漂洗液37 ℃避光漂洗细胞3 次,5 min∕次。DAPI 按说明书稀释后室温避光孵育10 min,细胞漂洗液37 ℃避光漂洗细胞3 次,每次5 min。用试剂盒提供的抗荧光淬灭封片液滴至载玻片上,盖上载玻片。OLYMPUS-DP72 倒置荧光显微镜观察并采集图像。
1.2.3 Western Blot 检测提取细胞蛋白,加入蛋白裂解液后离心、取上清用,BCA 试剂盒(碧云天)测定各组蛋白质浓度,按所测得浓度计算每泳道所需体积,加入加样缓冲液煮沸10 min。经10%SDS-PAGE 凝胶电泳分离,再转移至PVDF 膜上,脱脂奶粉室温封闭1 h,加入SnoN 及TAK1、p-TAK1(Thr184/187)、E-cadherin、α-SMA、Desmin、β-actin一抗,工作浓度分别为1∶800、1:600、1∶800、1∶800、1∶800、1∶800、和1∶1 000,4 ℃孵育过夜。次日用TBST 洗膜后,加入相应的辣根过氧化物酶标记的2 抗(浓度均为1∶6 000)室温孵育1 h,再加入ECL 化学发光试剂,曝光,Bio-Rad 凝胶成像系统扫描胶片,软件分析各条带的面积和灰度值,两者乘积为积分灰度值,每个样本重复操作3 次。一张胶上SnoN 及TAK1、p-TAK1(Thr184/187)、Ecadherin、α-SMA、Desmin 与相应的β-actin 条带所测积分灰度值的比值,即相应蛋白的相对表达量。
1.2.4 氧化应激氧化应激损伤指标丙二醛(malonaldehyde,MDA)及抗氧化应激指标总超氧化物歧化酶(total superoxide dismutase,T-SOD)检测胰酶消化细胞,10% FBS 培养基终止消化,12 000 r∕min离心15 min,弃上清。按说明书加入相应试剂,并在酶标仪上测各管的吸光度值并计算浓度。
1.2.5 流式细胞技术检测培养细胞,待其密度在1×106∕mL,胰酶消化细胞至于离心管中,用预冷的PBS 洗3 次,并加入适量PBS 重悬细胞,置于EP管中,将重悬好的细胞随机分组:对照组、PE 单染组、FITC 单染组、实验组(双染),向相应组别中加入0.1 ~10 μg∕mL的PE或者PITC标记的抗体,轻轻混匀,室温或者4 ℃避光孵育30 min,用预冷的PBS清洗细胞,400×g离心5 min,重复3 次,弃上清,加入500 μL 预冷的PBS 重悬细胞,上机检测,按照顺序:对照组、PE单染组、FITC单染组、实验组(双染)依次设门,进行阳性细胞计数,结果以百分数表示。
1.3 统计学方法实验数据以均数±标准差表示,采用SPSS 19.0 软件,多组比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 肾小管上皮细胞(NRK-52E 细胞株)表型鉴定细胞免疫荧光结果:NG 组NRK-52E 细胞胞浆中上皮细胞标志物E-cadherin 蛋白阳性染色较多,间充质细胞标志物α-SMA 蛋白的阳性染色较少;而HG 组E-cadherin 蛋白阳性染色减少,α-SMA 蛋白阳性染色增多,提示所培养的细胞为上皮来源细胞,其表型及生物学特性良好,高糖刺激之后细胞发生了EMT(图1)。
免疫印迹结果:培养NRK-52E 细胞发现,与NG 组比较,HG 组中上皮细胞标志物E-cadherin蛋白表达减少,而Desmin 蛋白(间充质细胞另一标志物)表达增高,差异具有统计学意义(P <0.05,图2),并与免疫荧光结果一致。
2.2 氧化应激水平的检测与NG 组相比,HG 组的氧化应激损伤指标MDA 的含量升高,抗氧化应激指标T-SOD 的含量降低;与HG 组相比,HG+ALM 组MDA 含量减少,T-SOD 含量增加,差异有统计学意义(P <0.05,表1)。
2.3 各组NRK-52E 细胞中p-TAK1(Thr184/187)、TAK1 和SnoN 蛋白的表达情况与NG 组相比,HG 组p-TAK1(Thr184/187)、TAK1 蛋白水平表达增加而SnoN 的表达降低;与HG 组相比,HG+ALM(200 μmol∕L)组p-TAK1(Thr184/187)、TAK1蛋白水平表达减少而SnoN 的表达增加,差异具有统计学意义(P<0.05,图3)。

图2 Western Blot 显示各组NRK52E 细胞中E-cadherin 及Desmin 蛋白的表达Fig.2 The expressions of protein E-cadherin and Desmin in NRK-52E cells showed by Western Blot
表1 氧化应激显示各组氧化应激水平的比较Tab.1 The comparison of oxidative stress levels in each group ±s

表1 氧化应激显示各组氧化应激水平的比较Tab.1 The comparison of oxidative stress levels in each group ±s
注:与NG 组比较,*P <0.05;与HG 组比较,#P <0.05
分组NG 组HG 组HG+ALM 组T-SOD(U∕mgprot)119.69±27.82 39.15±11.94*66.89±8.19#MDA(nmol∕mgprot)4.86±1.04 23.86±1.84*11.16±0.73#
2.4 各组NRK-52E 细胞中EMT 和ECM 蛋白指标的表达情况流式细胞术结果显示:采用FITC标记的α-SMA 抗体和PE 标记的E-cadherin 抗体,分别检测了NG 组、HG 组以及HG+ALM 组中荧光变化。与NG 组相比,HG 组中FITC 荧光值增加,PE 荧光值减少,即细胞中α-SMA 表达上调,E-cadherin 表达下调;而与HG 组相比,HG+ALM 组FITC荧光值减少,PE 荧光值增加,即α-SMA 表达下调,E-cadherin 表达上调,差异具有统计学意义(P<0.05,图4)。
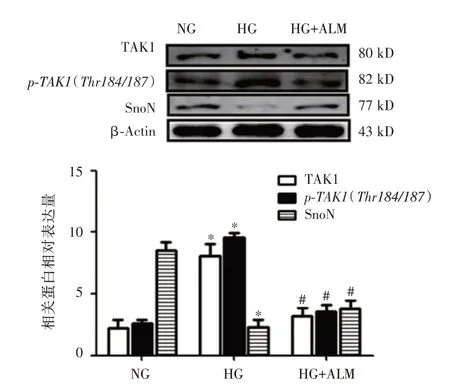
图3 Western Blot 显示各组NRK52E 细胞中p-TAK1(Thr184/187)、TAK1、SnoN 蛋白的表达Fig.3 The expressions of protein p-TAK1(Thr184/187),TAK1,SnoN in NRK-52E cells of each groups showed by Western Blot
2.5 Western Blot 结果与NG 组相比,HG 组CollagenⅢ蛋白水平表达增加而E-cadherin 的蛋白水平表达降低;与HG 组相比,HG+ALM 组CollagenⅢ蛋白水平表达减少,而E-cadherin 的蛋白水平表达增加,差异具有统计学意义(P<0.05,图5)。
3 讨论

图5 Western Blot 显示各组NRK-52E 细胞中CollagenⅢ、E-cadherin 蛋白的表达Fig.5 The expressions of proteinCollagenШ,E-cadherin in NRK-52E cells of each groups
高血糖时,糖基化终末产物异常增多,抗氧化酶活性及清除自由基能力降低,抗氧化系统防御能力下降,最终导致氧化应激的发生,氧化应激反应过度是促进肾纤维化发生EMT 和诱导ECM 沉积的主要环节之一[16]。TGF-β1 是促进肾脏纤维化发生的主要因子之一[17],TAK1 是TGF-β1 的下游因子,经TGF-β1 刺激后发生活化,进而调控下游靶基因的转录并发挥相应的生物学效应。研究发现[18],TAK1 可促进ECM 沉积,表明其在器官纤维化的进程中亦扮演重要色。SnoN 通过负性调控TGF-β1∕Smads 信号通路,抑制TGF-β1 致肾脏纤维化生物学效应,延缓肾纤维化的发生发展,达到保护肾脏的作用[19]。在肿瘤细胞中有研究发现[15],受TGF-β1 活化的TAK1 使得SnoN 发生多位点磷酸化,进而促进SnoN 发生泛素化水平修饰以降低SnoN 蛋白水平。ALM 具有抗氧化性能够清除氧自由基,研究发现[20],ALM 能够抑制EMT 的发生,并呈剂量依赖性,本课题组前期研究表明[21],对糖尿病肾病大鼠给予ALM 干预后,能够减轻肾脏组织的氧化应激损伤,改善肾脏病变。在肾纤维化的进程中,TAK1 对SnoN 蛋白的这种稳定性调节是否存在,及ALM 是否是通过影响TAK1∕SnoN 轴,抑制EMT 的发生,并减轻氧化应激损伤,不甚清楚。因此,本研究以体外高糖培养的NRK-52E 细胞为研究对象,检测ALM 对高糖时肾小管上皮细胞氧化应激及纤维化的效应。
本结果显示,高糖环境下,肾小管上皮细胞中的氧化应激指标水平增加,TAK1、p-TAK1(Thr184/187)及CollagenⅢ的表达增多,SnoN 与E-cadherin表达水平下降。给予ALM 干预后,氧化应激的水平降低,TAK1、p-TAK1(Thr184/187)及CollagenⅢ的表达下降,SnoN 蛋白表达增多。表明,高糖条件下,肾小管上皮细胞发生了氧化应激损伤,并伴有TAK1 的活化及高表达,SnoN 蛋白表达下降,胶原蛋白的沉积。ALM 干预后减轻了肾小管氧化应激损伤,下调了TAK1 的表达,上调了SnoN 蛋白的表达,并减少了胶原蛋白的表达。此结果与本课题组前期体内研究结果是一致的。如前所述,在肿瘤细胞研究中,TAK1 通过介导SnoN 的磷酸化进而促进SnoN 发生泛素化修饰,以调节SnoN 蛋白的稳定性。结合本研究及本课题组前期的发现,提示,高糖时,活化的TAK1 使SnoN 蛋白磷酸化,从而被泛素化降解,最终使SnoN 蛋白水平减少,促进肾纤维化病变。ALM 不仅减轻了高糖时细胞发生的氧化应激损伤,并通过影响TAK1∕SnoN 轴,恢复SnoN 蛋白水平,从而抑制EMT 的发生及ECM 的沉积,延缓了高糖诱导的肾纤维化进程。但是,TAK1 介导SnoN 发生磷酸化的具体位点及促进SnoN 发生泛素化水平修饰的机制,仍需进一步实验证明。
综上所述,抗氧化药物ALM 可能通过增加肾小管上皮细胞的抗氧化能力,减弱TAK1 对SnoN蛋白的负调节作用,上调SnoN 蛋白水平,从而抑制高糖环境下肾纤维化的发生发展,因此,深入探讨ALM 在DN 中的作用,这为临床防控及治疗DN提供了新的药物理论基础。
