不同SSRI类药物对氯吡格雷治疗脑卒中后抑郁患者的血小板及相关指标的影响
2019-10-28胡佳佳周伯荣李仕成
胡佳佳 周伯荣 李仕成
1广州医科大学附属第三医院精神医学科(广州510150);2广州医科大学附属肿瘤医院重症医学科(广州510095)
艾斯西酞普兰(escitalopram)是治疗脑卒中后抑郁(post-stroke depression,PSD)的首选抗抑郁药物之一。艾斯西酞普兰主要通过CYP2C19 代谢失活,因此CYP2C19 慢代谢者必须减量,防止血药浓度过高。目前临床治疗PSD 的方案中,艾斯西酞普兰联合氯吡格雷的比例较高,艾斯西酞普兰竞争CYP2C19 酶代谢,存在诱导氯吡格雷血小板高反应性(high platelet reactivity,HPR)发生,降低卒中二级预防疗效的风险,同时存在艾斯西酞普兰药物浓度过高,增加艾斯西酞普兰诱导心律失常的危险[1-2]。国内外的研究[3-4]提示CYP2C19 慢代谢基因型是导致氯吡格雷治疗心血管疾病时发生HPR 的原因,其进一步增加了出现心脑血管缺血性事件的风险。本研究旨在观察竞争CYP2C19代谢的选择性5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitor,SSRI)类药物对氯吡格雷治疗PSD 患者的血小板及相关指标的影响,以期指导该类患者的药物治疗。
1 资料与方法
1.1 一般资料选取2017年12月至2018年12月入院治疗的PSD 患者90 例,本研究经过广州医科大学附属第三医院伦理委员会审批(医伦专审[2017]第005 号),患者及家属签订知情同意书。纳入标准:(1)所有PSD 患者均符合2016年卒中后抑郁临床实践的中国专家共识中推荐PSD 诊断标准[5];(2)年龄35 ~85 岁;(3)血小板计数>150×109∕L,且<500×109∕L;(4)HAMD-17评分>18分;(5)首次服用氯吡格雷,且已停服其他药物至少2 周以上。排除标准:(1)对本研究的药物过敏者;(2)严重躯体疾病、酒精、药物滥用者;(3)心房纤颤、室间隔缺损患者;(4)严重心、肝、肾及癫痫病史;(5)近期服用过质子泵抑制剂的患者;(6)依从性差的患者。按随机抽样的原则,分为艾斯西酞普兰+氯吡格雷组(A 组)和氟西汀+氯吡格雷组(B组)各45 例,2 组患者在一般资料方面差异无统计学意义(P>0.05)。见表1。
1.2 方法所有患者均进行足量氯吡格雷[赛诺菲安万特(杭州)制药有限公司,进口药品注册证号:H20171237,国药准字J20180029]治疗,75 mg∕d,治疗3 周后,A 组加入艾斯西酞普兰(H.Lundbeck A∕S丹麦灵北药厂生产,进口药品注册证号H20150163)10 mg,B 组加入氟西汀(LILLY,SA.Avda.de Ia Industria 生产,进口药品注册证号:H20050463)20 mg,治疗3 个月。观察2 组患者的临床疗效、HPR 及其他相关的指标。
表1 两组患者的一般资料Tab.1 General data of the two groups of patients ±s

表1 两组患者的一般资料Tab.1 General data of the two groups of patients ±s
组别A 组B 组t∕χ2值P 值例数45 45年龄(岁)55.5±10.5 56.2±11.0-1.900 0.064男[例(%)]27(60.0)29(64.4)女[例(%)]18(40.0)16(35.6)0.189 0.664病程(年)5.71±3.24 5.82±3.37-0.335 0.740 HAMD 评分(分)25.8±4.7 25.3±4.8 1.331 0.190
1.3 评价指标
1.3.1 HPR 的评价指标采用LC-MS∕MS 测定[6]氯吡格雷代谢活性物质H4、流式细胞仪[7]测定血管扩张剂刺激磷蛋白(vasodilator-stimulated phosphoprotein,VASP)。
1.3.2 血小板聚集率测定采集2 组患者静脉血3 mL,采用光学比浊[8]法检测血小板聚集率。使用血小板聚集仪(上海博士仪器有限公司提供)检测,以乏血小板血浆为空白参照,将二磷酸腺苷诱导剂加入富含血小板血浆中得到最大血小板聚集率。
1.3.3 CYP2C19 基因分型采用实时荧光PCR法[9],48 h内检测,2 ~8 ℃保存,长期保存于-80 ℃。采集2 组患者空腹静脉血5 mL,严格按照全血基因组DNA 提取试剂盒(北京甘棠飞华生物科技有限公司提供)说明书进行操作,提取DNA。并将DNA 样本放置于-40 ℃保存,并及时进行检测,单冻融不超过3 次。PCR 产物使用限制性内切酶在37 ℃条件下水浴16 h 消化,消化后采用酶切产物经1.5%琼脂糖凝胶进行电泳检测,即得到CYP2C19基因的基因分型。主要对快代谢型、中间代谢型、慢代谢型的比例进行分析。
1.3.4 艾斯西酞普兰血浓度测定参考文献[10],采用HPLC-MS∕MS 测定艾斯西酞普兰血浓度。
1.3.5 HAMD 评分治疗后1、3、5 周和3 个月对2 组患者的HAMD 评分进行评价,采用汉密尔顿抑郁量表(HAMD-17)进行评估,主要从抑郁情绪、有罪感、自杀、入睡困难、睡眠不深、早醒、工作和兴趣、阻滞、激越、精神性焦虑、躯体性焦虑、胃肠道症状、全身症状、性症状、疑病、体重减轻、自知力17 个方面进行评估,总分超过24 分为严重抑郁,>17 分为轻或中度抑郁,<7 分无抑郁症状。
1.3.6 常规指标在治疗前和治疗后1、3、5 周及3 个月对2 组患者的血常规(检测出血情况如牙龈出血、大便潜血、消化道出血、颅内出血)、肝肾功能指标(检测肝肾功能衰竭情况)、心电图(检测不良心血管事件如心肌梗死、靶血管血运重建、死亡)等进行常规测定。
1.4 统计学方法采用SPSS 19.0进行处理,计量结果采用x ± s进行表示,并进行t检验,计数结果采用例(%)表示,并进行χ2检验,P<0.05 表示差异具有统计学意义。
2 结果
2.1 治疗前2 组患者的相关指标的结果由表2可知治疗前2 组患者CYP2C19 的3 个代谢型和氯吡格雷代谢活性物质H4、血小板聚集率、VASP 差异无统计学意义(P>0.05)。
表2 治疗前2 组患者的相关指标的结果Tab.2 Results of related indicators in the two groups before treatment ±s

表2 治疗前2 组患者的相关指标的结果Tab.2 Results of related indicators in the two groups before treatment ±s
组别A 组B 组t∕χ2值P 值例数45 45快代谢型[例(%)]12(26.7)14(31.1)中间代谢型[例(%)]18(40.0)16(35.6)慢代谢型[例(%)]15(33.3)15(33.3)0.271 0.873 H4(ng∕mL)10.2±4.4 10.4±4.3 0.493 0.624 VASP(ng∕L)215.2±64.7 215.3±63.4 0.019 0.985血小板聚集率(%)76.0±19.0 75.8±20.9 0.328 0.744
2.2 治疗后1 周2 组患者的相关指标的结果治疗1 周2 组患者无严重的不良心血管事件、出血及肝肾功能衰竭发生,而且A 组的H4、VASP 明显高于B 组(P<0.05),而HAMD 评分无差异(P>0.05)。见表3。
表3 治疗后1 周2 组患者的相关指标的结果Tab.3 Results of related indicators in two groups one week after treatment ±s
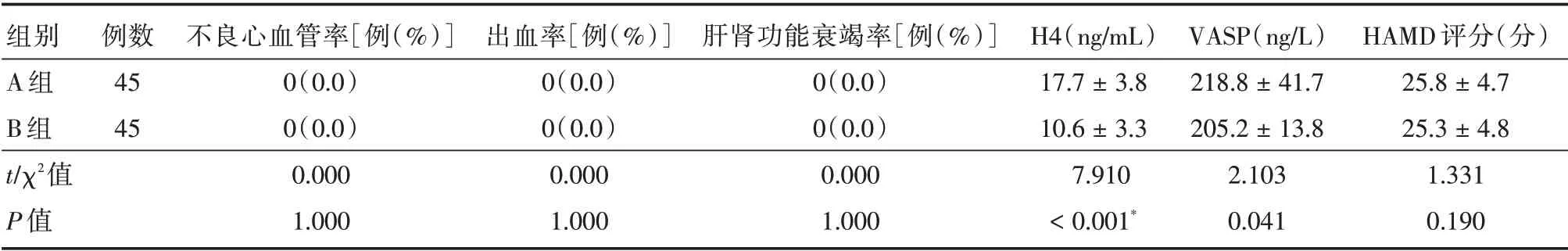
表3 治疗后1 周2 组患者的相关指标的结果Tab.3 Results of related indicators in two groups one week after treatment ±s
注:与A 组比较,*P<0.01
组别A 组B 组t∕χ2值P 值例数45 45不良心血管率[例(%)]0(0.0)0(0.0)0.000 1.000出血率[例(%)]0(0.0)0(0.0)0.000 1.000肝肾功能衰竭率[例(%)]0(0.0)0(0.0)0.000 1.000 H4(ng∕mL)17.7±3.8 10.6±3.3 7.910<0.001*VASP(ng∕L)218.8±41.7 205.2±13.8 2.103 0.041 HAMD 评分(分)25.8±4.7 25.3±4.8 1.331 0.190
2.3 治疗后3 周2 组患者的相关指标的结果治疗3 周2 组患者无严重的不良心血管事件、出血及肝肾功能衰竭发生,而且A 组的H4、VASP 明显高于B 组,而HAMD 评分明显低于B 组(P<0.05),A 组出现少量的艾斯西酞普兰浓度。见表4。
表4 治疗后3 周2 组患者的相关指标的结果Tab.4 Results of related indicators in two groups 3 weeks after treatment ±s
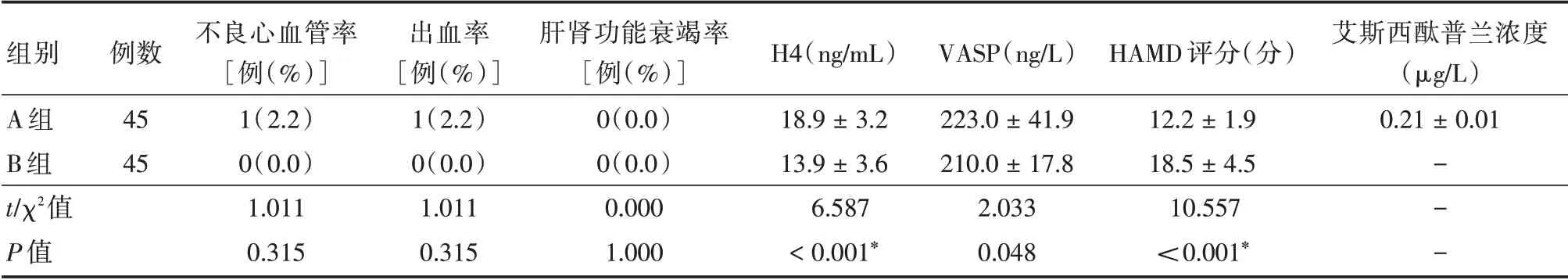
表4 治疗后3 周2 组患者的相关指标的结果Tab.4 Results of related indicators in two groups 3 weeks after treatment ±s
注:与A 组比较,*P<0.01
组别A 组B 组t∕χ2值P 值例数45 45不良心血管率[例(%)]1(2.2)0(0.0)1.011 0.315出血率[例(%)]1(2.2)0(0.0)1.011 0.315肝肾功能衰竭率[例(%)]0(0.0)0(0.0)0.000 1.000 H4(ng∕mL)18.9±3.2 13.9±3.6 6.587<0.001*VASP(ng∕L)223.0±41.9 210.0±17.8 2.033 0.048 HAMD 评分(分)12.2±1.9 18.5±4.5 10.557<0.001*艾斯西酞普兰浓度(μg∕L)0.21±0.01---
2.4 治疗后5 周2 组患者的相关指标的结果治疗5 周A 组患者不良心血管事件、出血及肝肾功能衰竭发生多于B 组,而且A 组的H4、VASP 明显高于B 组,而HAMD 评分明显低于B 组(P<0.05),A 组出现少量的艾斯西酞普兰浓度。见表5。
表5 治疗后5 周2 组患者的相关指标的结果Tab.5 Results of related indicators in two groups 5 weeks after treatment ±s

表5 治疗后5 周2 组患者的相关指标的结果Tab.5 Results of related indicators in two groups 5 weeks after treatment ±s
组别A 组B 组t∕χ2值P 值例数45 45不良心血管率[例(%)]5(11.1)1(2.2)2.857 0.091出血率[例(%)]3(6.7)1(2.2)1.047 0.306肝肾功能衰竭率[例(%)]1(2.2)1(2.2)<0.001 1.000 H4(ng∕mL)26.4±5.5 19.4±3.1 7.184<0.001*VASP(ng∕L)263.4±78.1 229.0±29.2 2.653 0.011 HAMD 评分(分)10.6±1.7 15.3±2.8 10.435<0.001*艾斯西酞普兰浓度(μg∕L)0.23±0.11---
2.5 治疗后3 个月2 组患者的相关指标的结果治疗3 个月A 组患者的不良心血管事件、出血及肝肾功能衰竭发生多于B 组,而且A 组的H4、VASP明显高于B 组,而HAMD 评分明显低于B 组(P<0.05),A 组出现少量的艾斯西酞普兰浓度。2 组患者的CYP2C19 的3 个代谢型无变化。见表6。
表6 治疗后3 个月2 组患者的相关指标的结果Tab.6 Results of related indicators in two groups 3 months after treatment ±s
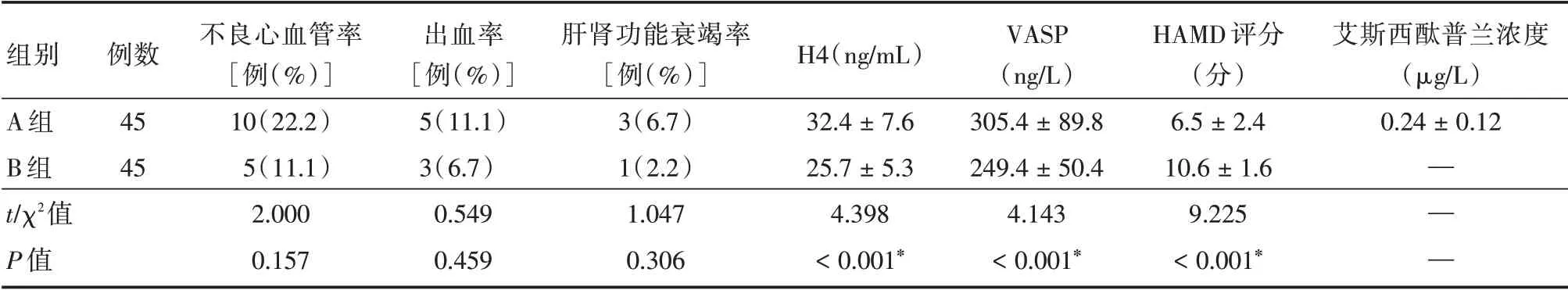
表6 治疗后3 个月2 组患者的相关指标的结果Tab.6 Results of related indicators in two groups 3 months after treatment ±s
注:与A 组比较,*P<0.01
组别A 组B 组t∕χ2值P 值例数45 45不良心血管率[例(%)]10(22.2)5(11.1)2.000 0.157出血率[例(%)]5(11.1)3(6.7)0.549 0.459肝肾功能衰竭率[例(%)]3(6.7)1(2.2)1.047 0.306 H4(ng∕mL)32.4±7.6 25.7±5.3 4.398<0.001*VASP(ng∕L)305.4±89.8 249.4±50.4 4.143<0.001*HAMD 评分(分)6.5±2.4 10.6±1.6 9.225<0.001*艾斯西酞普兰浓度(μg∕L)0.24±0.12——
3 讨论
氯吡格雷是目前动脉粥样硬化血栓性疾病的二级预防的首选抗栓药物,氯吡格雷需要在体内经过肝脏CYP450 同工酶系统CYP3A4、CYP3A5、CYP2C19 等二级酶联代谢,方能发挥具有生理活性的抗血小板聚集作用[11-13]。CYP2C19 为氯吡格雷代谢的关键酶,CYP2C19 慢代谢基因型是导致氯吡格雷抗血小板聚集失效,即HPR 的最主要原因[14-15]。本研究组首次揭示脑梗死患者进行氯吡格雷治疗后出现HPR 的动态发生特征,同时支持氯吡格雷治疗后发生HPR 存在多因素影响。随着近年的进一步研究,提示CYP2C19 基因位点突变是氯吡格雷治疗后发生HPR 恒定的因素和主要风险因子。
目前测试血小板功能的方法都存在诸多缺陷,并显示很大的变异性,较多因素都有可能会影响其结果,所以如何能够保证血小板聚集试验的稳定性及可靠性,已经成为本研究的关键。为此,笔者在2008-2012年期间的研究发现,有效控制实验的标本采集时间、操作时程、空腹与否、诱导剂的浓度、温度等因素,可以保证传统的LTA(透光率集合度测定,简称比浊法)方法在血小板聚集试验的稳定性及可靠性[16-17]。同时,结合本研究组近年已经应用的流式细胞仪测定VASP 方法,从而两种方法相互弥补,便于较准确监测血小板激活状态。对于近年出现的VerifyNow 测定方法,尽管简便易行,但是成本较高,同时多数报道其敏感性过高,易出现假阳性结果[18-19]。
根据国内外研究[20]显示氯吡格雷HPR 发生率为10% ~40%,中位数为25%,本研究组既往研究HPR 发生率平均为25%。如何更好地观察艾斯西酞普兰与氯吡格雷的相互作用,因两者代谢均通过关键酶CYP2C19,不仅可通过HPR 的发生来间接反映二者的相互作用,实验中通过直接测氯吡格雷代谢产物H4 及艾斯西酞普兰(或氟西汀)的血药浓度直接观察两种药物竞争关键酶CYP2C19 的情况。如何减少严重不良事件的发生,该实验密切监测患者血小板反应性,若HPR 发生明显,有卒中高风险,但是相对于氟西汀,艾斯西酞普兰更明显。艾斯西酞普兰与氯吡格雷联合更容易导致HPR 发生,而且长期使用容易导致不良心血管事件的发生,但是患者的HAMD 评分降低明显,对PSD 患者的治疗效果明显。
综上所述,相对于氟西汀联合氯吡格雷治疗,艾斯西酞普兰与氯吡格雷联用时相互竞争CYP2C19 酶,致CYP2C19 各基因型HPR 发生率均增高,而且慢代谢型显著,长期使用艾斯西酞普兰治疗PSD 疗效显著,但容易导致心律失常及心脑血管事件的发生,由于氯吡格雷以及艾斯西酞普兰均是需要长期使用药物,如能发现其代谢的相互影响,可有效指导患者使用药物,避免药物浪费,具有一定的经济效益。
