纳米刀消融联合胆道支架治疗不可切除肝门部胆管癌探讨
2019-10-28陈艳军程冰冰郜宇陈升阳周百中李晓勇
陈艳军 程冰冰 郜宇 陈升阳 周百中 李晓勇
郑州大学第五附属医院肝胆胰外科(郑州450052)
肝门部胆管癌占胆管恶性肿瘤的50%~60%[1]。由于解剖位置特殊,肿瘤极易侵犯二级甚至三级胆管,并累及周围的门静脉、肝动脉,因此根治性切除率低,有文献报道肝门部胆管癌的根治性切除率仅有20% ~30%[2]。既往对于无法手术切除的肝门部胆管癌的治疗大多以放化疗或者姑息性内外引流为主,但疗效欠佳。
纳米刀是一种新型消融技术,它利用不可逆电穿孔原理在肿瘤细胞膜上形成难以计数的纳米级小孔,继而导致肿瘤细胞调亡[3]。目前国内外有关该技术的文献大多聚焦于胰腺癌[4]、前列腺癌等实体肿瘤的治疗,而在肝门部胆管癌治疗中的应用鲜有报道,本研究回顾性分析了郑州大学第五附属医院肝胆胰腺外科采用纳米刀技术治疗的26 例不可切除肝门部胆管癌患者的临床资料,旨在为不可切除肝门部胆管癌患者的治疗提供新的选择。
1 资料与方法
1.1 纳入与排除标准纳入标准:(1)所有患者术前均行影像学检查、血清肿瘤标志物检验,结合典型的临床症状、体征等资料,以及术中探查确诊为不可切除肝门部胆管癌;(2)肝功能分级在B 级以上;(3)无心、肺、肾等重要脏器功能异常;(4)患者依从性好,能够坚持定期复查,并接受长期随访。排除标准:(1)一般情况差,伴有严重心肺肾等脏器功能障碍,无法耐受手术;(2)既往严重心肌梗死患者;(3)安装心脏起搏器患者;(4)依从性差,不能接受定期复查和随访患者。
1.2 一般资料回顾性分析郑州大学第五附属医院2016年1月至2018年6月收治的26 例不可切除肝门部胆管癌患者的临床资料,见表1。
1.3 手术过程及分组纳米刀消融治疗采用美国Angio Dynamics 公司生产的Angiodynamics Nanoknife System 开腹实施。主要步骤:(1)右侧肋缘下斜切口或上腹部反“L”型切口,常规切除胆囊并适当游离肝十二指肠韧带,充分显露肝门部结构;(2)术中超声再次确定肿瘤侵犯范围及Bismuth-Corlette 分型,精确测量肿瘤三个径向(左右、上下、前后)参数,将数据输入纳米刀消融系统,设计布针方案;(3)5 mL 注射器各进针点试行穿刺并抽吸再次确定进针径路上无血管,选用单极消融电极针主针1 根,辅针2~3 根精准布针,确保布针范围覆盖肿瘤区域,设置相邻电极针间距为1.5~2.5 cm,暴露消融电极1.5~2.0 cm;(4)按预设的消融针间组合及消融频次,采用直流(25A)高压(2 500 ~3 000 V)电脉冲依次消融,每两针间的消融由90 ~130 次电脉冲组成;(5)根据纳米刀仪器显示的消融前后电流变化趋势判断消融效果,若仪器显示消融后电流较消融前无明显上升,可适当调整脉冲次数后再次消融。消融完毕后观察穿刺点有无出血或胆汁渗漏,必要时缝扎;(6)消融原则:先深后浅,针与针之间平行等深,自左至右或自右至左逐步推进;(7)确定无活动性出血后纵行切开胆总管,按手术方案放置T 管∕胆道支架或胆道复合支架(胆道支架+放射性粒子链)。根据手术中具体方案的不同,将26 例患者分为A 组(常规消融组)、B 组(消融+胆道支架)、C 组(消融+复合支架组)3 组。其中A 组11 例,纳米刀消融术中未放置胆道支架,但其中4 例术中放置T 管;B 组11 例,纳米刀消融术中放置单纯胆道塑料支架;C组4 例,消融术中放置胆道复合支架(胆道塑料支架+放射性粒子链,其中放射性粒子链由术者自行制备),全部患者均未行胆肠吻合等内引流手术。术后适时经PTCD 管或T 管行胆道造影检查了解胆道再通情况。
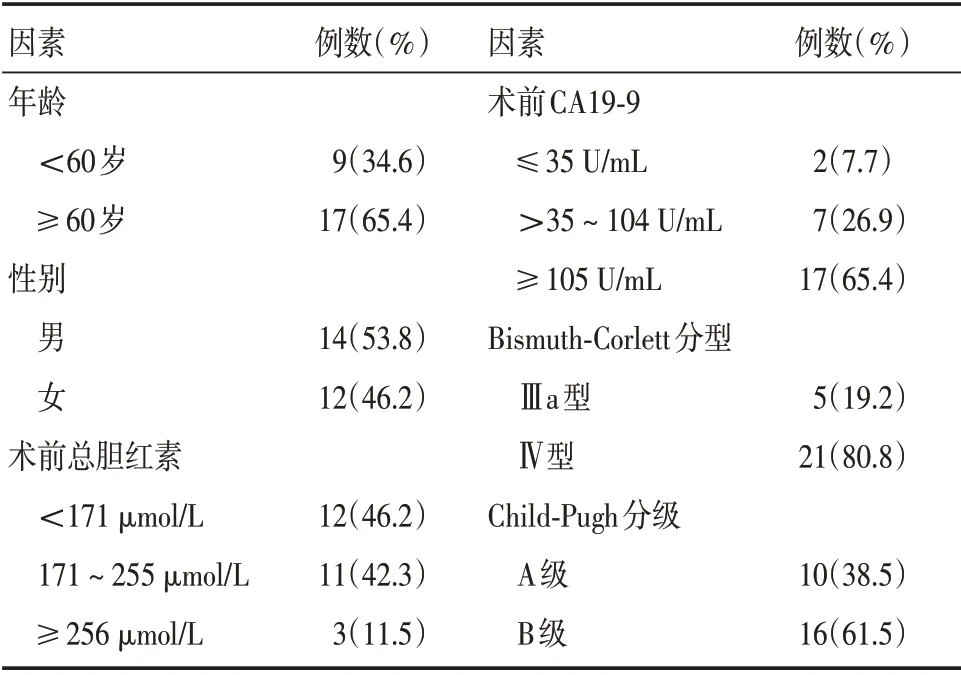
表1 26 例肝门部胆管癌患者的一般资料Tab.1 General data of 26 patients with hilar cholangiocarcinoma
1.4 统计学方法采用SPSS 17.0 软件包对所得数据进行统计分析,计量资料以(x ± s)表示,对术前术后相关指标比较采用配对t检验,对术后各组生存率的比较采用K-M 法进行分析,以P<0.05 差异有统计学意义。
2 结果
2.1 胆道再通情况术后2 周左右经T 管或PTCD管造影,结果显示:11 例患者术后2 周胆管再通,8 例术后1 个月胆管再通,3 例术后2 个月胆管再通,4 例始终未再通,胆管再通率84.6%(图1、2)。
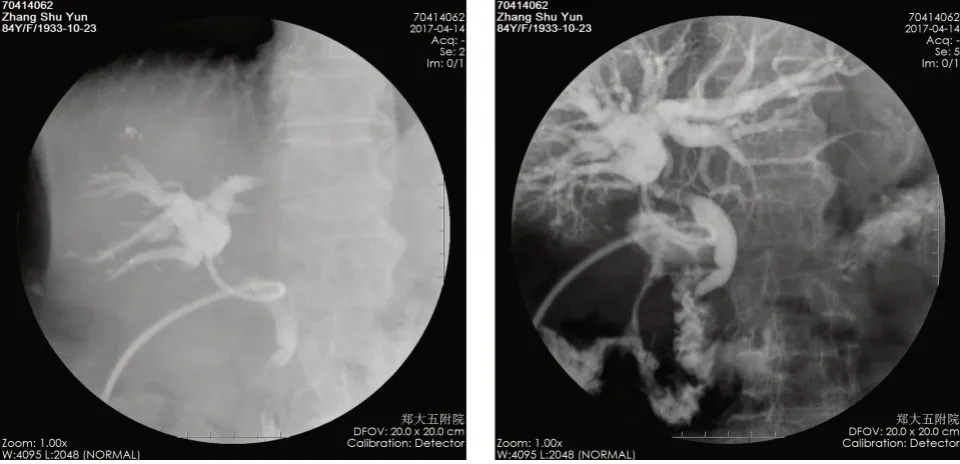
图1 纳米刀消融术后经T 管造影,肝内,外胆管依次显影Fig.1 The intrahepatic and extrahepatic bile ducts were developed successively by t-tube angiography after the nano knife ablation
2.2 术后随访
2.2.1 拔管时间18 例术前行PTCD 治疗患者,8例于术后2 周经PTCD 管造影检查证实胆道再通后予以拔除,4 例于术后1 个月拔除,1 例术后1 个月意外脱落,2 例于术后2 个月拔除,其余3 例术后胆红素下降不明显,未予拔除。
2.2.2 术后生存情况A 组11 例患者术中未行胆道支架置入,1 例术后因再次黄疸行内镜下逆行鼻胆管引流(endoscopic nasobiliary drainage,ENBD)治疗,另有1 例两次行内镜下胆道支架置入均未成功,其余9 例患者术后未再做其他治疗,此11 例患者术后总生存时间1.5 ~15 个月,平均(7.4 ± 1.2)个月。B 组11 例患者术中放置胆道支架,5 例术后再次出现黄疸时行内镜下治疗,其中1 例镜下历经困难取出术中支架并成功置入胆道金属支架,4 例镜下取出支架失败,遂行ENBD 治疗,其余6 例术后未再行其他治疗,11 例患者术后总生存时间4 ~24 个月,平均(10.9 ± 1.7)个月。C 组4 例患者术中放置胆道复合支架,3 例术后再次出现黄疸时成功于内镜下取出术中胆道复合支架并置入新支架(图3),其中2 例为金属支架,1 例未再行其他治疗,4 例患者术后总生存时间8 ~23 个月,平均(13.3±3.0)个月。各组间患者总生存时间差异无统计学意义(P= 0.155),但生存时间各组之间变化的趋势较为明显(表2)。26 例患者总生存时间1.5 ~24 个月,平均(9.8±5.6)个月。

图2 纳米刀消融术后经PTCD 管造影,左、右肝管及胆总管依次显影Fig.2 The left and right hepatic ducts and common bile duct were developed successively by PTCD angiography after the nano knife ablation
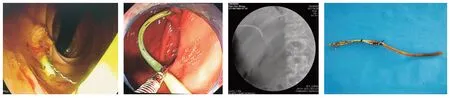
图3 术后内镜下取出并更换胆道支架Fig.3 Remove and replace the biliary stent under endoscope after surgery
表2 纳米刀消融术后生存情况Tab.2 Survival after ablation with nano knife ±s

表2 纳米刀消融术后生存情况Tab.2 Survival after ablation with nano knife ±s
组别A 组B 组C 组例数11 11 4生存期(月)7.4±1.2 10.9±1.7 13.3±3.0 P 值0.155
3 讨论
肝门部胆管癌恶性程度高,由于解剖位置的特殊性,且其生长方式具有纵向浸润及横向侵犯的特点[5],多数患者就诊时已失去根治性切除机会,预后较差。近年来,肝门部胆管癌的发病率呈上升趋势[6]。目前的治疗方法主要包括放化疗以及胆道内外引流、胆道支架植入、导管内射频消融等姑息性治疗,其目的在于缓解梗阻,改善胆汁引流,由于未对肿瘤本身进行干预,故患者的远期生存无明显改善,多数患者生存期不足1年[7]。
纳米刀消融技术是通过电极针将高压、低能、直流电脉冲施加于一定范围的肿瘤区域,从而在肿瘤细胞膜上产生无数的纳米级小孔[8],即不可逆电穿孔(irreversible electroporation,IRE),导致细胞内液外流,继而引起细胞稳态失衡最终导致肿瘤细胞死亡。基于其非致热损伤作用机制,IRE只破坏肿瘤细胞膜,不损伤细胞外基质成分[4,9],因此血管、胆管等脉管结构仍可保持正常的连续性而免受损伤,故而尤其适用于紧邻或浸润血管、胆管等重要结构的恶性肿瘤[10]。本研究发现纳米刀消融术后2 周左右经胆道造影证实胆管再通且连续性完好,表明纳米刀消融对胆管肿瘤细胞发挥明确的毁损作用的同时,确可维持胆管结构的连续性。
本研究中,A 组患者术后再次出现黄疸,考虑肿瘤复发导致胆道再次梗阻,1 例患者行ENBD 治疗,另有1 例两次试行内镜下胆道支架置入均未成功,表明对于肝门部胆管癌患者,内镜下胆道支架置入操作并非易事。国外的研究[11]将内镜下放置胆管支架的难易程度进行分级,分级越高则操作难度越大、放置支架的成功率越低且并发症发生率高。而术中放置胆道支架由于是在开腹直视下实施,容易克服支架通过胆道狭窄处时遇到的阻力,操作相对容易,成功率高。本研究中B 组11 例患者均于术中成功放置胆道支架。
支架闭塞是胆道支架常见并发症,当发生支架闭塞时,大多需要更换。塑料支架的远端如果位于胆管下段内,当发生支架堵塞时,再次干预会非常困难[2]。本研究中,B 组患者术后因再次黄疸考虑支架闭塞时有5 例接受内镜下支架更换,由于支架远端在胆管内,未通过十二指肠乳头进入肠腔,1 例历经困难于镜下取出胆道内支架,另有4 例未能成功取出,此种情况与国外的相关报道一致。文献报道,腔内放疗可延长支架通畅时间及生存时间[12]。本研究中,C 组患者术中放置胆道复合支架(胆道支架+放射性粒子链),粒子链由术者自行制备并与胆道支架牢固捆绑在一起,粒子链下端经十二指肠乳头置入十二指肠肠腔内。后期发生胆道支架堵塞需更换新支架时,该支架一方面可使取出原支架的操作难度较前明显降低,另一方面也为后续行内镜逆行胰胆管造影(endoscopic retrograde cholangiopancreatography,ERCP)治疗提供术中导向及置管“通道”,可大大提高ERCP下置管成功率。2 个半衰期后或患者再次出现黄疸时,行十二指肠镜检查通过镜下牵拉粒子链尾端取出“胆道复合支架”并置入新支架,使纳米刀消融的疗效进一步得到延伸。郑文恒等[13]的研究发现,单纯行经皮肝胆道支架置入术的患者,其中位生存期为9.6 个月。本研究中,纳米刀消融联合胆道复合支架治疗的患者,术后生存期平均为(13.3 ± 3.0)个月,最长可达23 个月,明显优于文献中单纯行胆道支架植入术患者,亦优于常规纳米刀消融组及胆道支架组患者,统计学分析未发现显著性差异考虑与C 组患者样本量过少、数据偏差较大有关。
在治疗不可切除的肝门部胆管癌方面,纳米刀消融可最大限度的毁损肿瘤细胞,同时保持胆道结构的连续性,无需胆管空肠吻合,不改变生理结构,损伤小。由于肝门部胆管癌具有“阶段性侵犯”、“跳跃性转移”的病理特点,因此难以达到根治的目的,完成R0 切除的病人术后复发几率仍然较高[5];即使是对经过严格选择的病人施行肝移植手术,其复发率也有20%[14]。因此,对于不可切除肝门部胆管癌的治疗,更需要结合胆道支架、放射性粒子链、内镜下更换支架等多种技术手段。
目前关于纳米刀消融在肝门部胆管癌治疗中应用的报道较少,本研究包含的样本量亦较小,尤其是C 组患者仅有4 例,在疗效尤其是术后生存率统计分析方面会有较大偏差。纳米刀消融治疗不可切除肝门部胆管癌尚面临诸多问题,比如术前肿瘤浸润深度的判断、消融边界的确定、术中消融效果的判断、最佳消融参数的确定等等,其确切疗效尚需进一步增加样本量、总结经验、改进技术并积极随访观察。荧光显影及三维重建技术近年来越来越多的应用于肝脏肿瘤手术中,如能将荧光显影或反向显影、三维重建技术应用于肝门部胆管癌纳米刀消融治疗中,用来确定肿瘤边界及消融范围,可大大提高肿瘤根治性毁损可能性,减少或延缓肿瘤的复发及进展,结合免疫治疗等最新的肿瘤治疗方式,有望使不可切除肝门部胆管癌的治疗取得更为显著的进展。
