MnSO4溶液的净化及制备电池级高纯硫酸锰
2019-10-28何银晖张海静
何银晖,张海静,熊 珊
(1.长沙有色冶金设计研究院有限公司,湖南长沙 410013;2.中电建环保科技有限公司,湖南长沙 410011)
硫酸锰在锰系产品中占有重要地位,是生产其他锰氧化物及锰盐的重要工业中间产品[1-2]。电池级高纯硫酸锰主要用于制备锂电池正极三元材料(镍钴锰酸锂)前驱体,也是制备电池级高纯四氧化三锰和高纯二氧化锰的基础原料。
目前,有关从硫酸锰溶液中深度去除铁、钙、镁、钾、钠和重金属等元素的研究较少[3-5],大部分研究都集中在对部分元素进行净化,如硫化除镍、钴,氟化除钙、镁[6-8];萃取分离锰与钙、镁、钾、钠等[9]。制备电池级高纯硫酸锰一直是硫酸锰工业要解决的难题。用工业级硫酸锰制备电池级硫酸锰,可采用MnS沉淀去除重金属,用MnF2去除钙、镁,再以Fe2(SO4)3去除K、Na,水解沉淀去除Fe、Al,以Al2(SO4)3去除F,最后浓缩、结晶得到电池级高纯硫酸锰[10]。也有以电解金属锰和工业硫酸为原料制得硫酸锰溶液,再经过BaS去除重金属,石灰调pH去除Fe,NaF去除Ca、Mg,制得一水硫酸锰[11],所得硫酸锰产品纯度为99.999 7%,其中Pb、Cd、Co、Fe、Zn等杂质质量分数均≤5×10-4%;以工业硫酸锰固体配制的硫酸锰溶液为原料,采用Fe2(SO4)3去除K、Na等杂质,然后用Mn2CO3调pH至4~7,加入吸附剂去除Fe,再以MnF2在pH为4~7条件下去除Ca、Mg等杂质,最后以BaS去除重金属,也可制得高纯硫酸锰[12],其中的K、Na、Ca、Mg等杂质质量分数均低于5×10-3%,重金属及铁杂质质量分数均低于1×10-3%。
试验采用分步沉淀法净化硫酸锰溶液。以工业级硫酸锰及电解锰为原料制备硫酸锰溶液并制备高纯硫酸锰已有专利报道,但有关硫酸锰溶液除杂净化及制备电池级高纯硫酸锰的工艺流程鲜见报道。
试验针对杂质较多的氧化锰矿石酸浸后的硫酸锰溶液,提出以高品位氧化锰矿石将亚铁离子氧化同时加入硫酸铁沉淀钾、钠—碳酸锰中和除铁—氟化锰除钙、镁—硫化钡除重金属—浓缩结晶生产电池级高纯硫酸锰,以期为电池级高纯硫酸锰的工业生产提供参考。
1 试验部分
1.1 试验试剂及设备
主要试剂:硫酸铁,碳酸锰,氟化锰,浓硫酸,均为分析纯;硫化钡,工业级,纯度高于60%;高品位氧化锰矿石为澳籽还原矿,取自西南能矿集团股份有限公司,粒度小于-100目大于95%,其中Mn、Fe质量分数分别为53.07%、7.01%。
主要设备:电感耦合等离子体发射光谱仪(ICP),SHB-Ⅲ型循环水式多用真空泵,精密pH计,恒温干燥箱,恒速搅拌器,电子天平,净水机。
电池级高纯硫酸锰的杂质含量要求[13]见表1,氧化锰矿石酸浸液组成及合格液要求见表2。浸出液中∑Fe、K+、Na+、Ca2+、Mg2+及Cu2+、Zn2+等杂质均高于合格液,需要净化去除。

表1 电池级高纯硫酸锰杂质含量要求 ×10-6
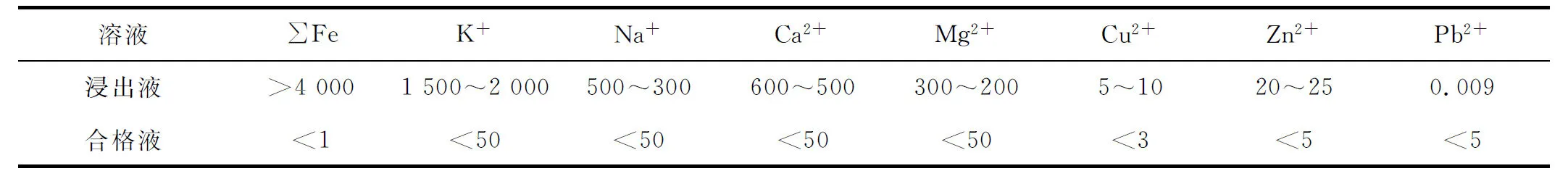
表2 氧化锰矿石酸浸液组成及合格液要求 mg/L
1.2 试验原理及方法
电池级硫酸锰的净化及制备过程包括5个步骤:氧化锰氧化Fe2+,硫酸铁去除K+、Na+,碳酸锰中和除Fe3+,MnF2去除Ca2+、Mg2+,BaS去除重金属Cu2+、Zn2+,浓缩结晶。涉及的主要化学反应为:

(1)

(2)

(3)

(4)

(5)

(6)
(7)
(8)
取一定体积浸出液,加入一定量高品位氧化锰矿石,使得溶液中Fe2+全部被氧化为Fe3+,经完全氧化的硫酸锰溶液,加入一定量硫酸铁,升温至一定温度,沉淀去除K+、Na+,待沉淀完全后加入碳酸锰调节溶液pH中和沉淀铁,中和铁的同时会生成无机絮凝剂氢氧化铁,同时絮凝沉淀除去溶液中剩余K+、Na+;待Fe3+、K+、Na+沉淀完全后过滤,取一定量滤液,加入氟化锰和添加剂,控制温度,沉淀去除Ca2+、Mg2+,待沉淀完全后加入一定量BaS去除Cu2+、Zn2+,待Cu2+、Zn2+沉淀完全后,过滤得合格硫酸锰溶液;合格硫酸锰溶液经浓缩结晶得硫酸锰,将硫酸锰在一定温度下烘干,得电池级高纯硫酸锰。
2 试验结果与讨论
2.1 氧化Fe2+及中和除Fe
采用高品位氧化锰矿石氧化Fe2+。因去除K+、Na+过程中需加入过量Fe2(SO4)3,以确保沉淀完全,过量的铁在去除K+、Na+之后用碳酸锰调节溶液pH进行中和去除。由于Fe2+不稳定,所以,考察高品位氧化锰矿石加入量对氧化Fe2+的影响时,在不影响氧化剂加入量前提下,将中和除Fe步骤提前。
2.1.1 氧化锰矿石加入量对氧化除铁的影响
取一定量硫酸锰溶液,加温至60 ℃,按式(1)加入高品位氧化锰矿石,反应1 h;氧化结束后,加入碳酸锰固体粉末使溶液pH维持在5.0以上,对Fe3+进行中和去除;中和反应结束后过滤并定性分析滤液中全铁质量浓度。高品位氧化锰矿石加入量对氧化除铁的影响试验结果如图1所示。
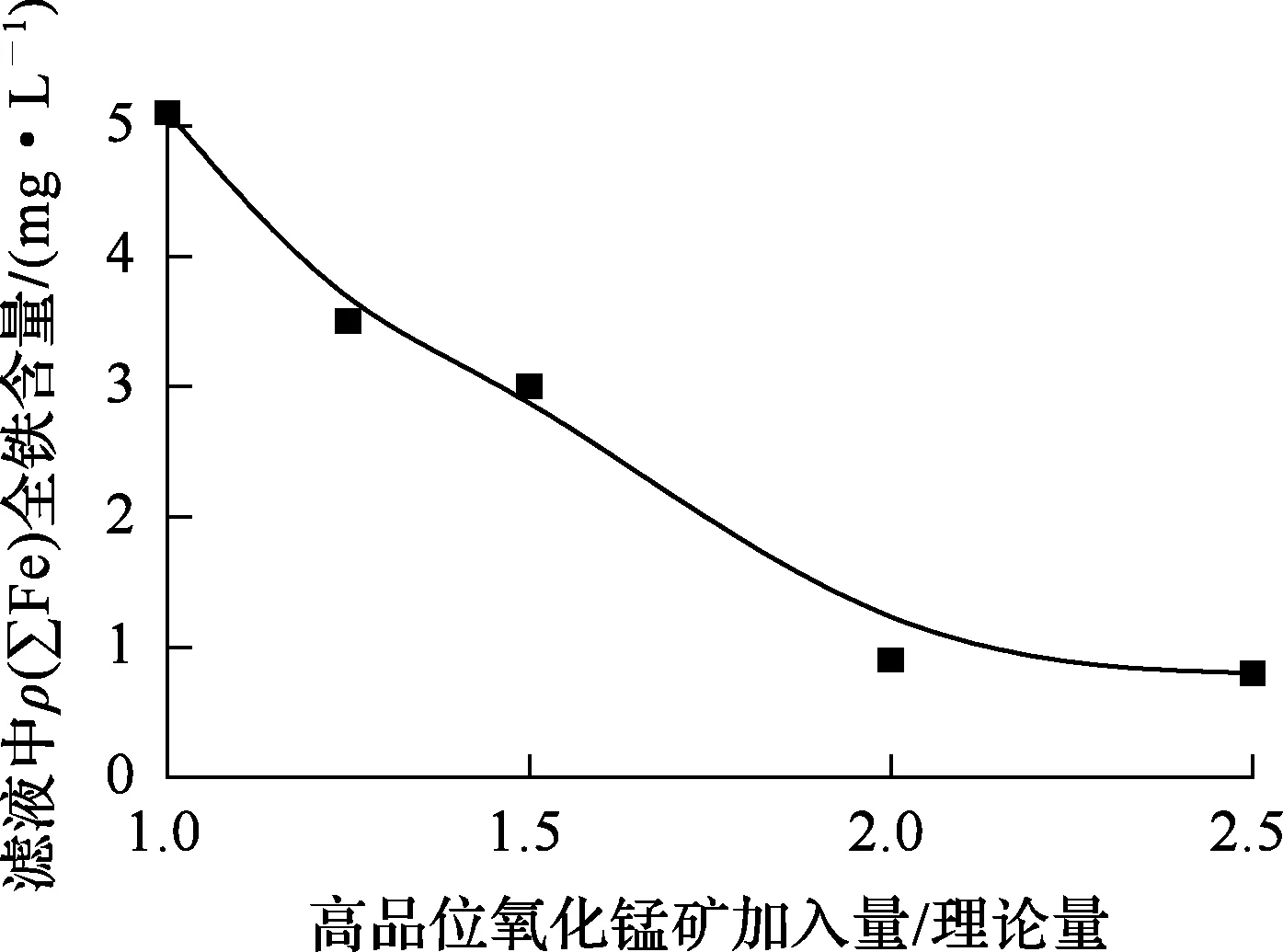
图1 高品位氧化锰矿石加入量对氧化除铁的影响
由图1看出:随氧化锰矿石加入量增加,溶液中Fe质量浓度下降;氧化锰矿石加入量为理论量的2倍时,溶液中Fe质量浓度低于1 mg/L,达到要求。考虑到氧化剂的利用率及生产成本,试验选择氧化锰矿石加入量为理论量的2倍。
2.1.2 温度对氧化除铁的影响
矿石浸出时温度多设定为50~95 ℃,所以试验选择45~95 ℃的温度范围。氧化锰矿石加入量为理论量的2倍,反应时间1 h。氧化结束后,加入碳酸锰固体粉末调节溶液pH在5.0以上,对Fe3+进行中和去除。温度对氧化除铁的影响试验结果如图2所示。
由图2看出,在试验温度范围内,温度对氧化锰矿石氧化亚铁离子及碳酸锰中和水解去除铁无明显影响。
2.2 碱金属K+、Na+的去除
探索试验结果表明:温度高于95 ℃后,溶液中Fe3+质量浓度高于化学配比(黄钠/钾铁矾化学式中Fe3+与碱金属的物质的量比)2倍以上;溶液pH控制在1.5~2.0之间,可以快速形成大量黄钾铁矾,并最终将K+、Na+脱除。试验考察硫酸铁加入量和温度对K+、Na+去除的影响。
2.2.1 硫酸铁加入量对K+、Na+去除的影响
取Fe2+完全氧化的硫酸锰溶液,加温至95 ℃,加入适量硫酸铁溶液,反应时间对K+、Na+去除效果的影响试验结果如图3所示。

图3 硫酸铁加入量对K+、Na+去除的影响
由图3看出:溶液中加入硫酸铁,K+与硫酸铁快速形成黄钾铁矾而被去除,当n(Fe3+)/n(K++Na+)=1/1时,K+质量浓度降至50 mg/L以下;Na+的去除难度较高,Fe3+质量浓度为化学配比的1倍时,即n(Fe3+)/n(K++Na+)=3/1时,溶液中Na+质量浓度仍有425.1 mg/L;Fe3+质量浓度为化学配比的2倍时,Na+质量浓度降至0.26 mg/L左右,而此时K+质量浓度为8.23 mg/L。因此,适宜的硫酸铁加入量为化学配比的2倍,即n(Fe3+)/n(K++Na+)=6/1。
2.2.2 温度对K+、Na+去除的影响
温度对铁矾的形成有明显影响,相同条件下,随温度升高,铁矾更易形成。温度对K+、Na+去除效果的影响试验结果如图4所示。
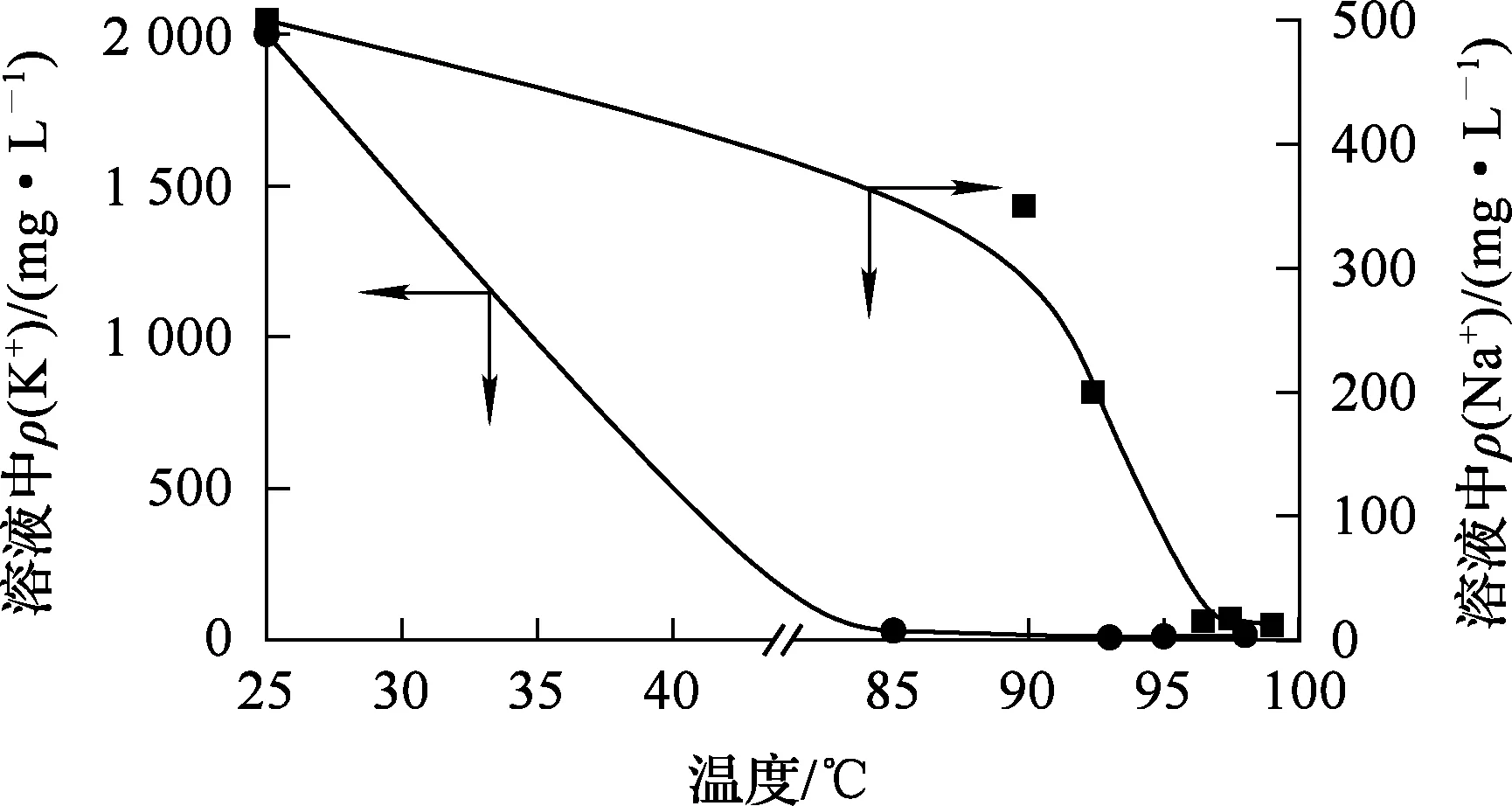
图4 温度对K+、Na+去除的影响
由图4看出:在硫酸铁加入量相同条件下,Na+、K+去除效果随温度升高而提高,但Na+质量浓度需在温度升至90 ℃时,才能达到要求,而K+质量浓度在温度升至80 ℃就可达到要求;当温度升至95 ℃以上时,Na+、K+去除效果均显著提高,反应1 h左右,Na+质量浓度降至15 mg/L以下,K+质量浓度则低于1 mg/L。综合考虑,确定去除K+、Na+时温度以不低于95 ℃为宜。
2.3 碱土金属Ca2+、Mg2+的去除
MgF2和CaF2溶度积很小,而MnF2溶度积较大,所以,采用MnF2并辅以添加剂沉淀溶液中的Ca2+、Mg2+。
2.3.1 氟化剂+添加剂加入量对Ca2+、Mg2+去除的影响
控制溶液pH为4左右,温度60 ℃,反应时间2 h左右,以MnF2为氟化剂,氟化剂+添加剂加入量(理论量倍数)对Ca2+、Mg2+去除效果的影响试验结果如图5所示。
图5 氟化剂+添加剂加入量对Ca2+、Mg2+去除的影响
由图5看出:当氟化剂+添加剂加入量为理论量的3倍时,溶液中Ca2+质量浓度降至5 mg/L以下且不再进一步降低,而Mg2+质量浓度则降至30 mg/L以下并有进一步降低的趋势。考虑到生产成本等问题,确定MnF2+添加剂加入量以理论量的3倍为宜。
2.3.2 温度对Ca2+、Mg2+去除的影响
温度对溶液中Ca2+、Mg2+沉淀有明显影响[7]。MnF2+添加剂用量为理论量的3倍,溶液pH控制在4左右,反应时间2 h左右,温度对Ca2+、Mg2+去除的影响试验结果如图6所示。可以看出:当温度由30 ℃升至80 ℃,溶液中Mg2+质量浓度随温度升高先降低后又升高,而Ca2+质量浓度则呈现逐渐升高趋势,但从整体净化效果看,试验条件下Ca2+、Mg2+质量浓度都低于50 mg/L,满足合格液标准。综合考虑,去除Ca2+、Mg2+的最佳温度为60~80 ℃。
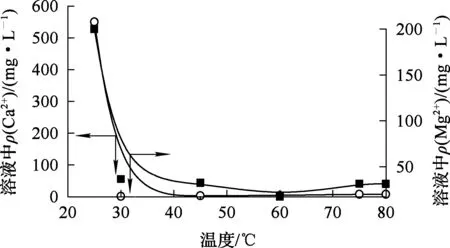
图6 温度对Ca2+、Mg2+去除的影响
2.4 重金属Cu2+、Zn2+的去除
由表2看出,浸出液中Pb2+质量浓度仅0.009 mg/L,满足合格液要求,因此重金属的去除只考虑Cu2+、Zn2+。在90℃下反应30 min,考察BaS对Cu2+、Zn2+去除效果的影响。试验结果如图7所示。
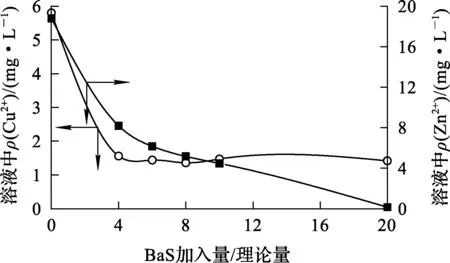
图7 BaS加入量对Cu2+、Zn2+去除的影响
由图7看出:随BaS加入量增加,溶液中Cu2+、Zn2+质量浓度显著下降;在BaS加入量为理论量的20倍时,Zn2+质量浓度降至0.2 mg/L左右;BaS加入量为理论量的4倍时,Cu2+质量浓度降至1.4 mg/L,此后变化不大。综合考虑,确定BaS加入量为理论量的20倍较为适宜。
2.5 浓缩结晶
去除了杂质的溶液采用直接蒸发法浓缩结晶硫酸锰。蒸发前调溶液pH至3~4范围内。蒸发过程中,当蒸发量约为65%时,即认为蒸发结束。再采用抽滤及甩干方式进行固液分离,固体在不低于160℃条件下烘干12~20 h。所得硫酸锰产品质量指标见表3。
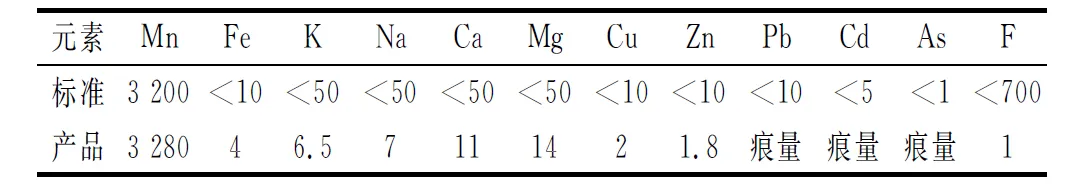
表3 硫酸锰产品质量指标 ×10-6
3 结论
采用分步沉淀法净化氧化锰矿石酸浸后的硫酸锰溶液,可获得较为纯净的硫酸锰溶液,对此溶液蒸发浓缩可获得电池级硫酸锰产品。溶液中的杂质Fe2+经高品位氧化锰矿石氧化成Fe3+,然后水解去除;K+、Na+通过加入硫酸铁使形成钾(钠)矾沉淀去除,Ca2+、Mg2+通过添加“MnF2+添加剂”沉淀去除,Cu2+、Zn2+采用BaS沉淀去除。
除杂过程选用的试剂大部分为含锰化合物,而Ba2+会形成更难溶的硫酸钡沉淀,因此除杂过程中未引入其他阳离子杂质,不会造成二次污染,且引入的锰化合物可以补充去除其他杂质时损失的锰。
