丁基苯酞通过激活PI3K∕Akt∕GSK-3β信号通路及其在局部脑缺血损伤脑梗死中的神经保护作用
2019-10-28王晓荣乌云高娃赵福全高玉峰
王晓荣 乌云高娃 赵福全 高玉峰
内蒙古民族大学附属医院1蒙医脑血管介入科,2蒙西医肾病科(内蒙古通辽028000)
缺血性脑卒中是临床常见的一种中枢神经系统疾病,具有较高的死亡率和致残率,严重威胁人类的健康和生存质量[1]。其病理生理过程非常复杂,可在多种因素条件下引起脑部血液流动障碍,导致大脑神经元细胞凋亡,会出现动作、语言、感觉和记忆能力等神经功能障碍[2]。在细胞凋亡过程中,磷脂酰肌醇3-激酶∕蛋白激酶B(PI3K∕Akt)信号通路对相关蛋白的调节发挥关键作用,PI3K∕Akt 可将膜受体信号传递至细胞内,来实现维持细胞增殖和抑制细胞凋亡的过程[3]。作为Akt 的底物,糖原合成酶激酶-3β(GSK-3β)是调节细胞凋亡的关键元件[4]。丁基苯酞(butyl phthalide,NBP)是对缺血性脑梗死患者神经功能改善具有显著效果的药物,可防止因脑缺血造成脑梗死的发生,同时有研究[5]表明,NBP 还能改善缺血部位的能量代谢,参与抑制神经细胞的凋亡过程。NBP 通过对PI3K∕Akt∕GSK-3β信号通路的调节保护局部脑缺血损伤脑梗死的作用机制尚不清楚。本研究采用大鼠大脑中动脉局灶缺血模型,探讨NBP 对局部脑缺血损伤脑梗死的保护作用,同时分析其对PI3K∕Akt∕GSK-3β信号通路的调控作用,从而为临床提供数据支持。
1 材料与方法
1.1 实验动物和主要试剂12 ~15 周龄的SPF 级健康Wistar 雄性大鼠,体质量200 ~220 g,购自北京维通利华实验动物技术有限公司;NBP 购自石药集团恩必普药业有限公司;LY294002 购自美国Sigma 公司;尼龙线购自上海禾丰制药有限公司;二喹啉甲酸法(bicinchoninic acid,BCA)蛋白浓度检测试剂盒、3,3-二氨基联苯胺(diaminobenzidine,DAB)化学发光试剂盒、Akt、P-Akt、GSK-3β、P-GSK-3β抗体均购自上海仁捷生物科技有限公司;聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜购自美国PALL 公司;磁共振扫描仪购自德国西门子公司;凝胶成像仪购自美国Bio-Rad 公司;BXM-950 光学显微镜购自上海炳宇光学仪器有限公司;CM1850石蜡切片机购自北京德泉兴业商贸有限公司;蛋白印迹设备购自美国Bio Rad 公司。
1.2 模型构建和分组处理将100 只12 ~15 周龄的SPF 级Wistar 雄性大鼠随机分为5 组(n= 20):假手术组(Sham 组)、模型组(Model 组)、NBP 组、P13K 特异性抑制剂LY294002 组(LY 组)和NBP+LY组。模型构建:大鼠麻醉后,取0.285 mm直径的尼龙线,参照参考文献[6],使大脑中动脉(middle cerebral artery,MCA)前段及其侧支血流阻断2 h,此时大脑前动脉血流不受影响,造成MCA 局部缺血,待抽回尼龙线,MCA 血流恢复后,完成大鼠大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)造模。Sham组不做血管结扎或阻塞,其余操作同Model 组。造模后第1 天开始,NBP 组、LY 组、NBP+LY 组分别腹腔注射10 mg∕kg NBP、10 mg∕kg LY和10 mg∕kg NBP+10 mg∕kg LY,注射剂量10 μL,每天1 次,连续给药7 d,Sham 和Model 组腹腔给予等量生理盐水。本研究经医院伦理委员会批准,批准文号:内蒙古民族大学附属医院医伦[2017]第068 号。
1.3 神经功能缺损程度评分(nervous function defect score,NDS)第7 天给药30 min 后,参考文献[7]采用改良的mNNS 评分方法,将大鼠行为分为6 个等级,评分标准为:0 分:大鼠爬行正常没有不对称活动;1 分:大鼠尾部垂直提起时前肢或后肢弯曲;2 分:大鼠在1 分的基础上伴有不能直线行走;3 分:大鼠爬行时向左侧转圈;4 分:大鼠自由活动时向左侧倾倒;5 分:大鼠在4 分的基础上出现左前爪后拖;6 分:大鼠肢体完全不能支撑身体,无法自发爬行。
1.4 磁共振成像(magnetic resonance imaging,MRI)法测量脑梗死体积大鼠经神经功能缺损程度评分结束后,随机选取6 只大鼠,使用磁共振扫描仪检测脑梗死体积,大鼠取仰卧位,找到标准轴位后,在横断面T2-加权成像的基础上进行冠状面3 层扫描,层厚度1.5 mm,间距0.2 mm。T2-加权成像检测大鼠脑梗死体积,梗死区域为苍白色,正常脑组织区域为灰色。利用Image J 分析软件计算脑梗死体积(%)=(梗死区体积∕全脑组织体积)×100%。
1.5 尼氏染色检测脑组织中神经元数目大鼠经神经功能缺损程度评分结束后,随机挑取6 只,麻醉后胸腹切口,在露出的心脏左心室插管,4%多聚甲醛心内灌注至整个肝脏变为白色,取出完整的脑组织至冰器皿上并即刻以4%多聚甲醛固定,再用梯度乙醇在真空条件下脱水二甲苯透明后用石蜡将脑组织包埋处理。处理好的脑组织进行5 μm 厚的冠状切片参照文献中的方法进行尼氏染色。光学显微镜(×400)下观察每组切片6 个不同的视野,并通过Image-Pro 6.2 软件处理图像,观察缺血侧大脑皮层区域内完整神经元的数目。
1.6 免疫印迹法检测Akt、P-Akt、GSK-3β、PGSK-3β大鼠经神经功能缺损程度评分结束后,随机挑取6 只,断头处死动物,迅速剥离颅骨取缺血侧半脑组织在冰浴条件下分离大脑皮质,加入RIPA 组织裂解液中匀浆器打碎,冰浴5 min 后离心,离心条件:13 000 r∕min,4 ℃,时间10 min,获得上清,BCA 蛋白定量试剂盒进行上清中蛋白浓度的定量检测,用2×电泳缓冲液稀释蛋白至相同浓度。10%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白,用Tris∕甘氨酸缓冲液将蛋白转移至PVDF 膜上,5%TBST 液中室温封闭2 h,将PVDF 膜放入相应一抗稀释液(均为1∶1 000)中孵育,4 ℃过夜。次日,将膜取出,TBST 液洗涤10 min,加入辣根过氧化物酶标记的山羊抗兔IgG 二抗稀释液(均为1∶10 000),室温孵育2 h,加入DAB 发光液,凝胶成像仪下读取读取灰度值,以GAPDH作为内参,计算目的蛋白相对表达水平。
1.7 统计学方法数据分析采用软件SPSS 16.0,符合正态分布的计量资料采用平均数±标准差进行表示,多组间比较采用单因素方差分析,两两间比较采用独立t检验,P <0.05 表示差异具有统计学意义。
2 结果
2.1 NBP对MCAO大鼠神经功能的影响与Sham组相比,Model 组大鼠神经功能损伤评分明显升高,差异有统计学意义(t=-60.335,P <0.001),经NBP 治疗后,与Model 组相比,NBP 组 神经功能损伤评分出现明显下降,差异有统计学意义(t=-32.025,P <0.001),LY 组、NBP +LY 组 与Model 组比较组间差异无统计学意义(t= 1.165,P=0.251;t=0.920,P=0.363)。见图1。
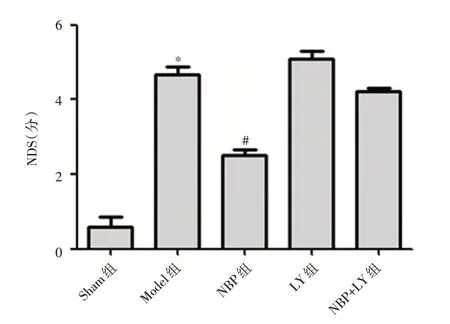
图1 NBP 对MCAO 大鼠脑内神经功能的影响Fig.1 Effect of NBP on neural function in MCAO rats
2.2 NBP对MCAO大鼠脑梗死体积的影响Sham组大鼠两侧脑组织未发现梗死区域,与Sham 组相比,Model 组脑梗死体积明显增大(t=-146.485,P <0.001);与Model 组相比,NBP 组脑梗死体积明显减小,差异具有统计学意义(t=-49.422,P <0.001)。LY 组、NBP+LY 组与Model 组相比组间差异无统计学意义(t=-1.058,P= 0.297;t= 1.758,P=0.087)。见图2。

图2 NBP 对MCAO 大鼠脑梗死体积的影响Fig.2 Effect of NBP on cerebral infarction volume in MCAO rats
2.3 NBP 对MCAO 大鼠脑内神经元完整性的影响神经元经过尼氏染色在光镜下观察呈蓝紫色,如图3、4 所示,Sham 组神经元形态正常,与Sham 组相比,Model 组神经元出现异常结构,完整的神经元数量明显减少,差异具有统计学意义(t=41.220,P <0.001);与Model 组相比,NBP 组脑组织内完整神经元的数量明显升高(t= 28.354,P <0.001),LY 组、NBP + LY 组与Model 组相比组间差异无统计学意义(t=-0.4925,P= 0.625;t=0.913,P=0.367)。

图3 尼氏染色观察NBP 对MCAO 大鼠脑内神经元完整性的影响(×400)Fig.3 Effect of NBP on neuronal integrity in MCAO rats was observed by Nissl staining(×400)
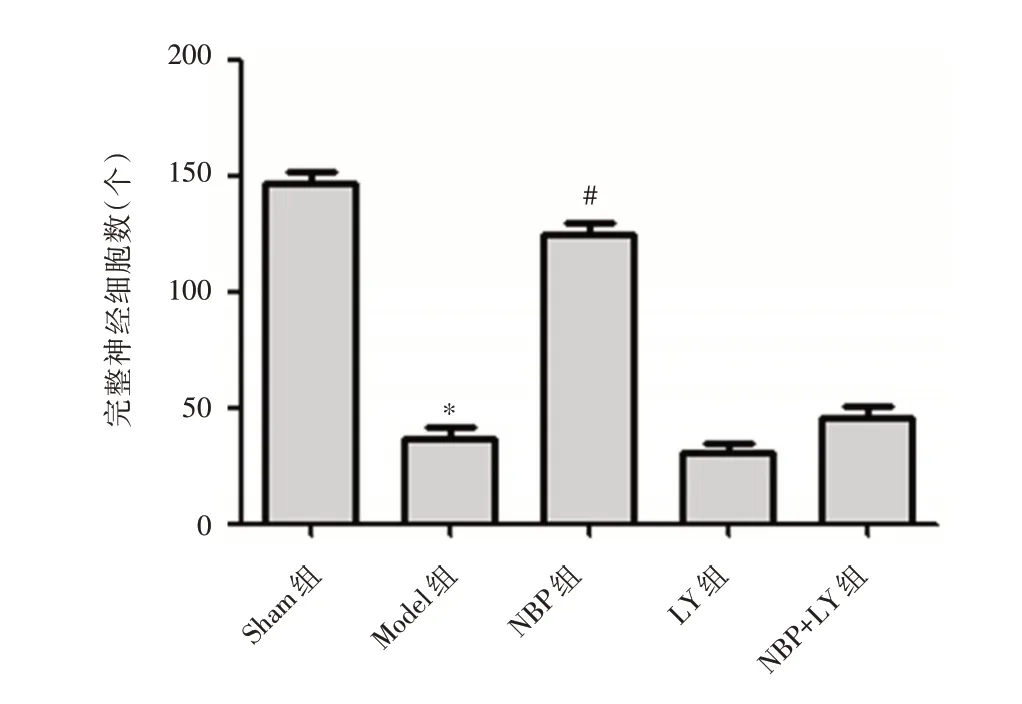
图4 各组完整神经细胞个数比较Fig.4 Comparison of the number of intact neurons among 5 groups
2.4 NBP 对MCAO 大鼠脑组织中Akt、P-Akt、GSK-3β、P-GSK-3β表达的影响为了进一步观察NBP 对大鼠缺血脑梗死的作用机制,本研究采用蛋白免疫印迹法检测了缺血区脑组织中Akt、PAkt、GSK-3β、P-GSK-3β蛋白表达,结果显示与Sham 组相比,Model 组中Akt、GSK-3β磷酸化水平明显下降(t= 14.536,P <0.001;t= 87.131,P <0.001);与Model 组相比,NBP 组大鼠脑 组 织 中Akt、GSK-3β磷酸化明显升高,差异具有统计学意义(t=-7.830,P <0.001;t= 64.879,P <0.001),LY 组、NBP +LY 组Akt、GSK-3β 磷酸 化水 平与Model 组相比组间差异无统计学意义(P-Akt:t=-0.070,P= 0.944;P-GSK-3β:t= 10.413,P=0.682);(P-Akt:t= 1.542,P= 0.131;P-GSK-3β:t=1.422,P=0.158)。见图5。
3 讨论
大脑是机体生理功能最为复杂的器官之一,对血液供应具有极强的依赖性,当大脑供血的动脉发生狭窄或阻断时,会导致脑组织因供血供氧不足出现局部缺血甚至坏死,大脑功能受到损害,对机体的生理活动产生严重不良影响[8-9]。缺血性脑梗死与心血管疾病和恶性肿瘤并列成为对人类生命构成极大威胁的致死性疾病[10]。
对于缺血性脑梗死进行的药物研发在医学界受到极大重视,NBP 作为缺血性脑血管疾病的治疗药物,在临床上得到广泛使用,且效果显著。本研究采用大鼠脑中动脉阻塞法构建局部脑缺血损伤再灌注模型,Model 组大鼠出现脑梗死体积明显增大,神经功能缺损严重,且神经元细胞凋亡数目增多。本研究根据预实验结果选择NBP 给药浓度。结果表明,经过NBP 治疗的大鼠与Model 组相比,脑梗死体积明显缩小,神经功能损伤程度明显减轻,同时抑制了神经细胞凋亡的数量,大鼠局部脑缺血损伤得到缓解,该结果与既往实验结果一致[11],再次证实了药物的治疗效果。
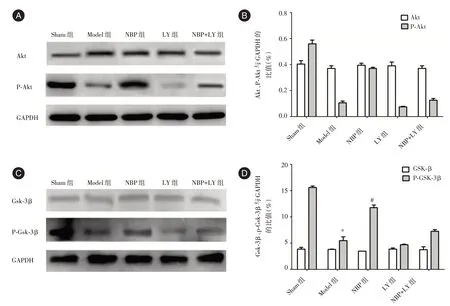
图5 NBP 对MCAO 大鼠脑组织中Akt、P-Akt、GSK-3β、P-GSK-3β 表达的影响Fig.5 Effects of NBP on the expression of Akt,P-Akt,GSK-3β and P-GSK-3βgsk-3 in MCAO rats
研究药物的分子机制,探寻药物作用的靶点有利于药物的使用及药物的优化。以往的研究结果表明,线粒体是细胞凋亡的关键元件,NBP 可通过提高线粒体三磷酸腺苷(ATP)酶的活性,对因缺血造成损伤的细胞线粒体起到保护作用,从而抑制细胞凋亡[12]。此外研究显示NBP 可能通过作用于大脑缺血部位,提高位血管内皮生长因子(VEGF)和碱性成纤维生长因子(bFGF)的表达量,实现大脑损伤的保护作用[13]。因研究结果缺少干预实验进行验证,对于途径未进行深入研究。LY294002 作为PI3K 特异性抑制剂,可特异性抑制PI3K110 亚基单元的活性,阻断PI3K 介导的信号通路。本研究中使用LY294002 验证NBP 对PI3K∕Akt∕GSK3β信号通路的调节保护局部脑损伤的作用机制,结果显示,Akt 和GSK-3β磷酸化水平在NBP 组与Model 组相比大幅增加,而LY+NBP 组较NBP 组下降明显,LY294002 逆转了NBP 介导的Akt 和GSK3β磷酸化水平,说明NBP 可通过PI3K来实现Akt 和GSK3β磷酸化进程。有研究[14]表明,PI3K∕Akt∕GSK-3β信号通路抑制了大脑再灌注损伤后细胞的凋亡,同时在后期参与了其修复过程,对于抑制缺血后脑梗死面积扩大起到保护作用。与NBP 组相比,LY+NBP 组大鼠脑梗死体积明显增大,神经功能损伤程度更为严重,且神经细胞凋亡的数量增加,证明了NBP 可能是通过调控PI3K∕Akt∕GSK-3β信号通路在大脑缺血损伤中起保护作用。
综上所述,NBP 可以激活缺血性脑梗死所致的PI3K∕Akt∕GSK-3β 信号的激活,从而减轻神经功能损害,发挥对局部缺血致脑梗死的保护作用。但NBP 是否还能通过调节其他通路来影响疾病进程,仍需进一步的研究。
