131I治疗儿童及青少年分化型甲状腺癌对血常规、肝功能及甲状旁腺的短期影响
2019-10-28申沛于韦智晓李俊红韦海莲
申沛于 韦智晓 李俊红 韦海莲
广西医科大学第一附属医院核医学科(南宁530021)
甲状腺癌在成人内分泌肿瘤中较常见,而在儿童及青少年中较为少见,在美国约占甲状腺癌患者1.8%[1],其中以分化型甲状腺癌(differentiated thyroid cancer,DTC)较常见。目前美国甲状腺协会(ATA)指南对成人DTC 治疗有标准的规范,为手术切除(全切或次全切)+131I 治疗+甲状腺激素抑制治疗。儿童及青少年甲状腺癌虽然预后较好,但起病隐匿,在确诊时更易发现颈部淋巴结及远处转移,因此131I 在儿童及青少年DTC 患者中的应用也逐渐被重视。然而部分医生及家属考虑到131I 是一种放射性治疗,担心其副作用影响患者将来的生长发育及生活质量,畏惧行131I 治疗。本文回顾性分析了60 例儿童及青少年DTC 患者131I治疗前后血常规、肝功能及甲状旁腺激素(parathyroid gland hormone,PTH)、降钙素(calcitonin,CT)的变化,拟探讨131I 治疗对其的短期影响。现报道如下。
1 资料与方法
1.1 一般资料2012年3月至2017年12月在我院核医学科接受131I 治疗且年龄≤21 岁的患者。
纳入标准:病理证实为DTC;行甲状腺全切或次全切除;首次接受131I 治疗;治疗前血常规、肝功能、甲状旁腺功能正常或接近正常;按时定期随访者。
排除标准:治疗前血常规异常者;使用升白细胞药物者;近期有感染者;有肝脏转移的患者;肝脏相关性疾病者;手术损伤甲状旁腺者。
按照上述标准,有60 例患者入组该研究,其中男17 例,女43 例,年龄8~21 岁,中位年龄18 岁;乳头状癌58 例,滤泡状癌2 例。首次清甲剂量为(5.77 ± 1.31)GBq(1.48~6.66 GBq),随访过程中,有50 例发现有甲状腺残留、颈部淋巴结转移或双肺转移者,再次予以清甲加清灶治疗,随访末累积剂量(16.20 ± 8.10)GBq(4.26~38.85 GBq);有10 例第一次后治愈未行后续治疗。
1.2 儿童及青少年DTC患者131I治疗伦理学要求儿童及青少年DTC 患者应在进行131I 治疗前告知治疗前、后及治疗过程中的注意事项,以及治疗过程中可能出现的副作用,并向患儿家属详细讲解131I 治疗的效果及安全性消除其恐惧心理,在治疗前签订知情同意书。
1.3131I 治疗前准备及方法(1)所有患者服131I 前停服左甲状腺素钠片3~4 周,期间禁食含碘高的食物及药物(如海带、紫菜、海鲜、华素片等),禁止行增强CT 检查。入院前行血常规、肝功能、肾功能、血电解质、PTH、人绒毛膜促性腺激素、胸部X线或CT、甲状腺部位及颈部B 超、血清甲状腺激素(总三碘甲状腺原氨酸TT3、总甲状腺素TT4、游离三碘甲状腺原氨酸FT3、游离甲状腺素FT4)、促甲状腺激素水平(TSH)、甲状腺球蛋白(Tg)及其抗体(TGAb)、甲状腺摄碘率(RAIU),明确甲状腺残留及全身情况。(2)首次清甲治疗时,若是仅有甲状腺残留而无其他部位转移,则按照ATA 指南给予固定剂量80~100 mci,若是有其他地方转移则给予120~150 mci。3~7 d 后行131I 全身显像。服131I 后告知患者多含服话梅等酸性食物,鼓励患者多饮水、排尿。治疗后1、3、6 个月在门诊根据情况复查甲功、血常规、肝功能及PTH、CT 等其他指标,根据检查结果决定后续治疗方案。复查未见甲状腺残留及其他转移者则不需继续治疗。若是发现有颈部淋巴结或肺部转移者则给予180~250 mci 进行清灶治疗。
1.4 收集、记录指标
1.4.1 血常规指标收集患者治疗前、后血常规检查结果(治疗前、治疗后1 周、治疗后1、3、6 个月),包括白细胞(WBC)、红细胞(RBC)、血红蛋白(HGB)、血小板(PLT)。
1.4.2 肝功能指标收集患者治疗前、后肝功能检查结果(治疗前、治疗后1、3、6 个月),包括天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)。
1.4.3 甲状旁腺指标收集患者治疗前、后甲状旁腺功能检查结果(治疗前、治疗后3、6 个月),包括PTH、CT。
1.5 统计学方法运用SPSS 20.0 统计学软件,计量资料均用均数±标准差表示,治疗前后血指标结果比较采用配对t检验进行统计学分析。以P<0.05 为差异有统计学意义。
2 结果
60 例患者中51 例经131I 治疗后好转,9 例病灶经治疗后无明显变化。住院观察期间仅有2 例患者出现肠胃不适,予以对症治疗后好转;其余患者未出现颈部水肿等其他不良反应。60 例患者均有131I 首次清甲治疗后血常规、肝功能及PTH、CT完整数据。首次清甲前患者各项指标均接近正常或在正常范围内。
2.1 治疗前后血常规各指标变化46 例患者治疗后1 周复查血常规,其中5 例患者治疗后1 周白细胞稍高于正常值,其余指标均在正常范围内;治疗后1 周各指标与治疗前比较差异无统计学意义(P>0.05)。60 例患者治疗后1 个月WBC、RBC、HGB、PLT 各指标均有所下降(P<0.05),检查结果显示异常的分别为18、15、13、16 例。治疗后3 个月只有PLT 下降(P<0.05),WBC、RBC、HGB 与治疗前比较差异均无统计学意义(P>0.05);治疗后3个月检查结果异常的分别为WBC 7例、RBC 4例、HGB 4 例、PLT 8 例。治疗后6 个月WBC、RBC、HGB、PLT 变化差异无统计学意义(P>0.05);治疗后6 个月检查结果异常的分别为WBC 2 例、RBC 4 例、HGB 5 例、PLT 4 例。60 例患者经131I 治疗后1 个月AST、ALT 检查结果显示异常的分别为6 例、5 例;3 个月AST、ALT 检查结果显示异常的分别为5 例、3 例;6 个月AST、ALT 检查结果显示异常的分别为3 例、3 例。治疗前与治疗后1、3、6 个月各指标比较差异均无统计学意义(P>0.05)。见表1、2。
表1 131I 治疗前及治疗后1 周血常规各指标变化Tab.1 Changes of blood routine indexes before and 1 week after131I treatment ±s

表1 131I 治疗前及治疗后1 周血常规各指标变化Tab.1 Changes of blood routine indexes before and 1 week after131I treatment ±s
时间治疗前治疗后1 周P 值WBC(× 109∕L)6.12 ± 1.20 6.25 ± 1.38 0.702 RBC(× 1012∕L)4.61 ± 1.70 4.62 ± 1.68 0.774 HGB(g∕L)123 ± 2.24 124 ± 2.00 0.783 PLT(× 109∕L)266.9 ± 9.84 270.0 ± 10.75 0.493
表2 131I 治疗前及治疗后1、3、6 个月血常规、肝功能各指标变化Tab.2 Changes of blood routine,liver function indexes before and 1,3,6 months after131I treatment ±s
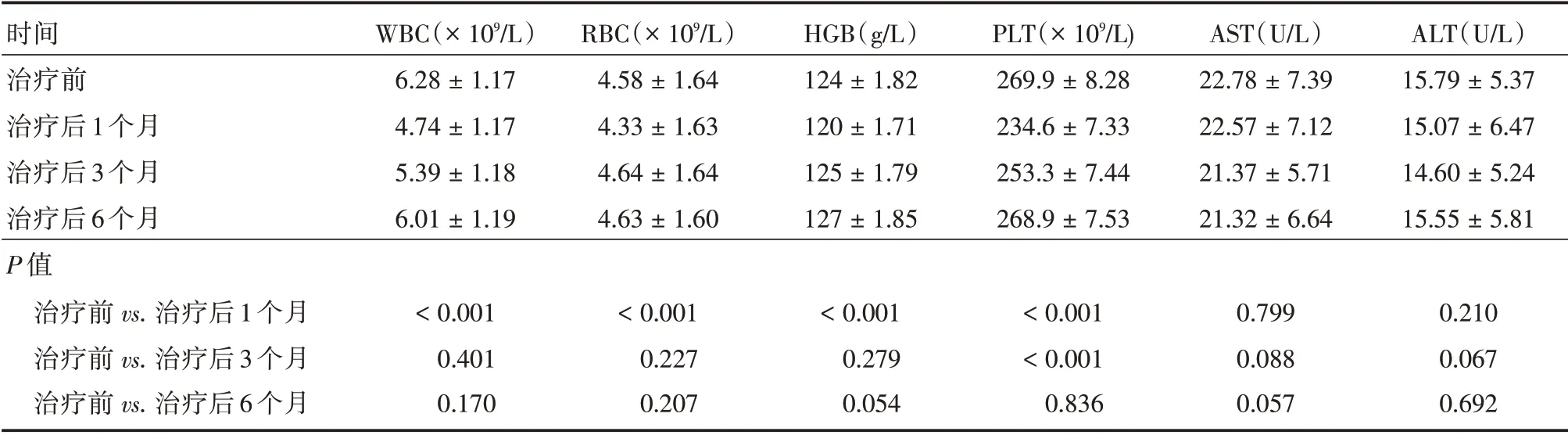
表2 131I 治疗前及治疗后1、3、6 个月血常规、肝功能各指标变化Tab.2 Changes of blood routine,liver function indexes before and 1,3,6 months after131I treatment ±s
时间治疗前治疗后1 个月治疗后3 个月治疗后6 个月P 值治疗前vs.治疗后1 个月治疗前vs.治疗后3 个月治疗前vs.治疗后6 个月WBC(×109∕L)6.28±1.17 4.74±1.17 5.39±1.18 6.01±1.19 RBC(×109∕L)4.58±1.64 4.33±1.63 4.64±1.64 4.63±1.60 HGB(g∕L)124±1.82 120±1.71 125±1.79 127±1.85 PLT(×109∕L)269.9±8.28 234.6±7.33 253.3±7.44 268.9±7.53 AST(U∕L)22.78±7.39 22.57±7.12 21.37±5.71 21.32±6.64 ALT(U∕L)15.79±5.37 15.07±6.47 14.60±5.24 15.55±5.81<0.001 0.401 0.170<0.001 0.227 0.207<0.001 0.279 0.054<0.001<0.001 0.836 0.799 0.088 0.057 0.210 0.067 0.692
2.2 治疗前后甲状旁腺功能变化60 例患者治疗后3 个月PTH、CT 检查结果异常的分别为4 例、0 例;6 个月后PTH、CT 检查结果异常的分别为2 例、0 例。治疗前PTH、CT 与治疗后3、6 个月比较差异均无统计学意义(P>0.05)。见表3。
表3 131I 治疗前及治疗后3、6 个月甲状腺旁腺各指标变化Tab.3 Changes of parathyroid indices before and 3,6 months after131I treatment ±s
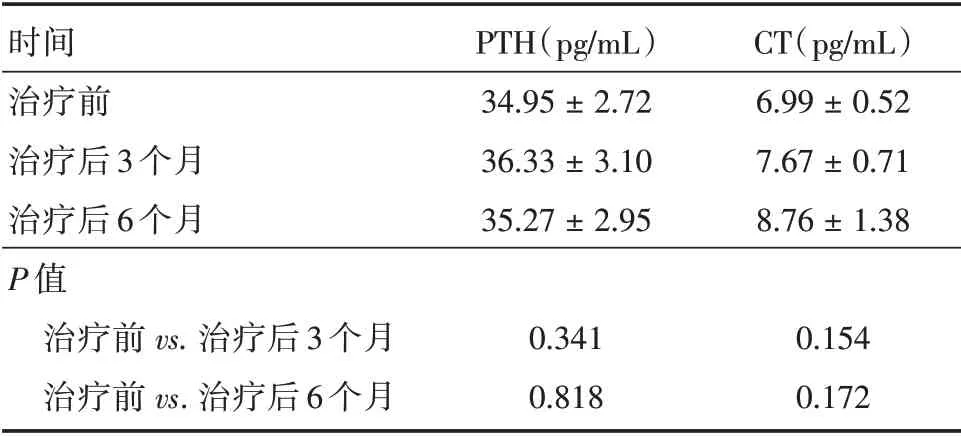
表3 131I 治疗前及治疗后3、6 个月甲状腺旁腺各指标变化Tab.3 Changes of parathyroid indices before and 3,6 months after131I treatment ±s
时间治疗前治疗后3 个月治疗后6 个月P 值治疗前vs.治疗后3 个月治疗前vs.治疗后6 个月PTH(pg∕mL)34.95±2.72 36.33±3.10 35.27±2.95 CT(pg∕mL)6.99±0.52 7.67±0.71 8.76±1.38 0.341 0.818 0.154 0.172
3 讨论
出于对131I 副作用的担心,其在儿童及青少年DTC 患者中的应用受到了限制。多数学者认为与成人DTC 相比,儿童及青少年甲状腺癌患者虽然预后较好,但其在确诊时更易发现颈部淋巴结及远处转移,而且易复发。这可能与儿童及青少年癌基因重排现象较点突变更加明显,且肿瘤呈侵袭性生长,局部免疫力下降有关[2]。 所以建议患者在行甲状腺全切或次全切术后进行131I 联合内分泌抑制治疗,降低复发率。但考虑到儿童及青少年的生长发育情况,建议其只需行甲状腺单叶切除或大部分切除,同时加中央组淋巴结清扫术,降低手术并发症,术后只用TSH 抑制治疗,不进行131I 治疗。本研究中60 例患者首次清甲治疗成功38 例,清甲治疗后有52 例患者的Tg 有不同程度的降低,说明131I 治疗儿童及青少年DTC 患者疗效显著。
131I 治疗副作用主要有近期及远期,儿童及青少年正处于生长发育的重要阶段,不良反应更应该受到重视。近期不良反应常见的有服完碘后颈部肿胀出现疼痛,胃部刺激出现恶心、呕吐等。对于胃肠道刺激反应可以给予兰索拉唑,一般很快就会缓解;对于反应严重的可给予止吐及输液治疗。远期不良反应包括骨髓抑制、第二肿瘤发生率增加、影响生育功能[3]。远期不良反应的发生与治疗剂量、治疗累积次数、治疗间隔时间、总的治疗剂量、骨转移情况等相关。一过性的骨髓抑制而且未出现明显临床症状是可以不予处理,目前尚未见因骨髓抑制引起死亡的病例。多饮水、多排尿及尽量减少131I 服用剂量可以减少其对生殖系统影响。本文就131I 治疗对血常规、肝功能及甲状旁腺的近期影响加以分析。
本研究中患者的血常规各指标在1 个月内有所下降,可能为血液系统对辐射的短期反应,造成血细胞短暂性损伤。对于治疗后1 个月WBC 轻度下降的患者只需等待观察无需任何治疗;对于极少数WBC 下降较明显的患者可予以升白细胞药物治疗,1 周后WBC 恢复正常。治疗结束后3、6 个月未进行任何升白治疗。有研究报道131I 治疗会造成骨髓抑制[4],表现为外周血中某一成分或全血成分减少。赫珊瑚等[5]研究发现,成人接受131I治疗后会对WBC 产生一过性轻微的影响。ZHAO等[6]报道接受大剂量131I 治疗的成人DTC 患者,PLT 会有下降但在正常范围内。而儿童及青少年对射线更加敏感,本研究发现WBC、RBC、HGB 仅在治疗后1 个月内轻度下降,治疗后3、6 个月各指标均恢复,与治疗前水平接近。虽然PLT 治疗前与治疗后1、3 个月相比差异有统计学意义,但是大部分均在正常范围内,而且治疗后6 个月也接近治疗前指标。血常规各指标在治疗后1 周与治疗前比较差异无统计学意义,而且部分指标较治疗前升高,可能是机体对131I 治疗产生的应激性反应。本研究提示131I 对血液的影响可能是暂时且可恢复的,而且多发生在治疗后3 个月内,不需要进行临床治疗。OMÜR 等[7]研究发现在131I 治疗后的长期随访中,血液系统肿瘤发生率明显增高,其中白血病发生率增加2.5 倍。因此对于131I 是否会骨髓产生远期影响,则需要更加长期的研究去证实。
在成年人进行131I 治疗后行全身显像示肝脏弥漫性摄取,其发生率高达35%~97%[7],其原因可能是131I 标记的甲状腺激素与肝脏分泌的甲状腺激素结合球蛋白结合有关[8]。血液中99%的T3或T4是通过与血浆球蛋白结合进行运输的,这些球蛋白大部分由肝脏合成。当甲状腺激素被释放入血后,经过肝肠内循环被肝细胞摄取。碘是合成甲状腺激素的原料,经过131I 治疗的患者合成的甲状腺激素则含有放射性131I,因此经过131I 治疗的患者3~5 d 后行全身碘显像时可以看到肝脏显影。故131I 全身显像肝脏显影是一种常见现象。OMÜR 等[7]研究发现肝脏摄取与131I 剂量有关,并与AST∕ALT 水平呈正相关。王森[9]研究指出131I 进入血液后被残余甲状腺组织及转移灶摄取,合成甲状腺激素;残余甲状腺越多(或)合并转移患者摄取131I 剂量增多,激素进入肝脏代谢或经脱碘酶作用被肝脏重新摄取,因此131I 在肝脏内异常浓聚,而损伤肝功能。肝脏摄取131I 是否会对肝功能产生影响,目前研究较少。儿童及青少年患者各系统尚未发育完全,131I 是否影响肝脏功能更有待研究。本文中观察131I 治疗后虽然少数患者肝功能指标有所升高,但整体分析1、3、6 个月后肝功能,发现AST∕ALT 与治疗前比较差异均无统计学意义(P>0.05)。经过131I 治疗患者全身显像肝脏有显影,但对肝功能未产生影响的原因可能与甲状腺激素合成数量相关。本研究中接受131I 治疗的儿童及青少年DTC 患者均行甲状腺全切或次全切,残留的甲状腺较少。而且在服131I 前要停用左甲状腺素钠片3~4 周使TSH >30 mIU∕L,患者处于明显的甲减状态,甲状腺激素严重不足。因此,肝脏摄取131I 相对较少,所以对肝功能不会产生影响。
本研究对60 例术后行131I 治疗的儿童及青少年DTC 患者治疗前后PTH、CT 检测结果进行回顾性分析。治疗后3、6 个月PTH、CT 检测结果与治疗前比较差异无统计学意义(P>0.05),说明术后行131I 治疗的DTC 患者发生甲状旁腺功能减退与131I 治疗无关。本研究随访时间有限,要延长131I 治疗后观察时间,并增加血钙、血磷等甲状腺旁腺功能相关的指标。
综上所述,131I 治疗儿童及青少年DTC 短期内是相对安全的,虽然对血常规有影响,但是是轻微短暂、可恢复的,而对肝功能及甲状旁腺未见明显短期影响。本文的局限性是病例数不够多,随访时间较短,要继续增加样本量和分析指标,延长随访时间,为临床拿出更加有力的证据。
