长链非编码RNA-LncRNA小核仁RNA宿主基因14对乳腺癌细胞增殖和迁移的影响
2019-10-28刘淳林顺欢贾筠关灵郑锐年林钦雄刘克军袁惠玲叶伟标廖玉婷
刘淳 林顺欢 贾筠 关灵 郑锐年 林钦雄 刘克军袁惠玲 叶伟标 廖玉婷
南方医科大学附属东莞市人民医院1肿瘤内科,2临床研究中心,3乳腺科,4病理科(广东东莞523000)
乳腺癌占女性所有肿瘤的29%,是中国和世界范围内女性最常见的恶性肿瘤[1]。虽然近年来对于乳腺癌的诊断和治疗方法取得了很大进展,但乳腺癌患者的5年生存率仍然较低,由于乳腺癌转移率高,且目前其发病和转移的机制尚未完全清楚[2],因此,深入探讨乳腺癌的分子机制对乳腺癌的诊断和治疗具有重要意义。长链非编码RNA(long non-coding RNAs,lncRNAs)是长度超过200 nt 的RNA,其参与肿瘤的多种生物学行为[3]。既往研究表明,LncRNA-NORAD 可被YAP 途径抑制并通过隔离S100P 抑制乳腺癌的转移[4]。而LncRNA-sONE 可通过诱导miR-34a、miR-15a、miR-16 和let-7a 的表达来抑制三阴性乳腺癌侵袭性[5]。研究表明,LncRNA 小核仁RNA 宿主基因14(small nucleolar RNA host gene 14,SNHG14)一种关键的LncRNA,LncRNA-SNHG14 在多种肿瘤中差异表达,通过海绵状miR-203 促进细胞肾细胞癌迁移和侵袭[6]。且LncRNA-SNHG14 可通过吸附miR-92a-3p 抑制胶质瘤细胞增殖和侵袭,促进肿瘤细胞凋亡[7]。也有研究显示LncRNA-SNHG14 通过吸附miR-340 从而在非小细胞肺癌中发挥致癌功能[8]。因此,LncRNA-SNHG14 在不同肿瘤中具有差异的生物学功能,目前对于LncRNA-SNHG14 在乳腺癌中的表达和对肿瘤细胞生物学功能的影响仍未明确。本研究旨在探讨LncRNA-SNHG14 在乳腺癌组织中的表达水平,及其对乳腺癌细胞增殖和迁移的影响和潜在机制。
1 资料与方法
1.1 组织收集收集于2018年1月至2019年1月在我院行手术治疗的乳腺癌组织和癌旁组织共40例,其中肿瘤分期Ⅰ期12 例、Ⅱ期13 例、Ⅲ期11例、Ⅳ期4 例,组织学分级Ⅰ级16 例、Ⅱ级14 例、Ⅲ级10 例。所有患者在术前均未进行放疗和化疗。所有组织用无菌PSB 洗涤后,快速放入冷冻液氮,储存在-80 ℃待测。本研究获得医院伦理委员会审核通过。
1.2 细胞培养和处理CAL51、BT474、HCC1954、HS578T、T-47D 人乳腺癌细胞,以及正常乳腺上皮细胞株MCF-10A 购自中国科学院生物化学与细胞生物学研究所,培养基由10%胎牛血清(FBS;Life Technologies,Gaithersburg,MD,USA),Dulbecco改良的Eagle 培 养基(DMEM)(Gibco、Rockville,MD,USA)组成。细胞置于含有5%CO2的37 ℃培养箱中培养。
1.3 细胞转染合成了针对LncRNA-SNHG14 的表达短发夹RNA(shRNA)的慢病毒,具体靶向序列为5′-GCAACATTCCCTGAACATACT-3′(shRNA#1)和5′-GCGAGGAATCTGATTCCAAGC-3′(shRNA#2)的shRNA 连接到pLKD-CMV-G&PR-U6-shRNA载体,并通过包装病毒质粒包装成慢病毒,具体操作由和园生物技术公司(上海)进行。然后将LncRNA-SNHG14 的shRNA 和空载对照(对照)的慢病毒用于CAL51 乳腺癌细胞中的转染。转染48 h后,并采用嘌呤霉素(5 μg∕mL)筛选稳转细胞株14 d 后,使用RT-qPCR 检测细胞中LncRNA-SNHG14 的表达水平。
1.4 RNA 提取和RT-qPCR用TRIzol 试剂(Invitrogen,Carlsbad,CA,USA)分离组织和细胞中的总RNA。使用TRIzol 试剂(Invitrogen,Carlsbad,CA,USA)分离总RNA。通过逆转录试剂盒(TaKaRa Biotechnology Co.,Ltd.,Dalian,China),然 后从总RNA 逆转录互补的脱氧核糖核酸(cDNA)。RTqPCR 条件如下:在95 ℃,5 min;95 ℃,10 s;60 ℃,30 s,总共35 个循环。RT-qPCR 引物:SNHG14,正向:5′-GGGTGTTTACGTAGACCAGAACC-3′,反向:5′-CTTCCAAAAGCCTTCTGCCTTAG-3′,β-actin,正向:5′-CCAACCGCGAGAAGATGA-3′和反向:5′-CCAGAGGCGTACAGGGATAG-3′。用ABI 7500 进行qRT-PCR 测定(Invitrogen),has-miR-144,正向:5′-GGGAGATCAGAAGGTGATT-3′,反向:5′-GTGCAGGGTCCGAGGT-3′,通过2-ΔΔCt法计算LncRNASNHG14 在乳腺癌组织中或细胞中的表达水平。
1.5 细胞增殖检测通过CCK-8 法测定(Dojindo,Kumamoto,Japan)每24 小时监测96 孔板中乳腺癌细胞的细胞增殖水平。CCK-8 试剂孵育60 min 后,采用分光光度计(Thermo Scientific,Rockford,IL,USA)测量450 nm 处的吸光度。并通过克隆形成实验检测乳腺癌细胞的增殖水平,具体将处于对数生长期的乳腺癌细胞约500 个接种到6 孔板,培养20 d 后,固定后采用结晶紫染色于显微镜下观察计数。
1.6 细胞侵袭和迁移实验Transwell 侵袭实验:8 μm 孔径的Transwell 小室(Corning,NY,USA)进行。 将150 μL 无血清DMEM 中的4×104个细胞铺到含有50 μg 基质胶(BD,Bedford,MA,USA)的Transwell 小室的上室中。下室加入600 μL 的10%FBS+DMEM。48 h 后,将室的顶部表面用预冷的甲醇浸没10 min,并用结晶紫染色30 min,统计迁移入下室的乳腺癌细胞。细胞迁移实验则不采用基质胶让肿瘤细胞迁移8 h。
1.7 结合位点和预后分析采用starBase V3.0(http:∕∕starbase.sysu.edu.cn∕)预 测SNHG14 结 合 的miRNA,并通过Kaplan Meier plotter(http:∕∕kmplot.com∕analysis∕)工 具 分析miRNA 与 乳 腺 癌预 后的关系。
1.8 荧光素酶测定将SNHG14 的3′-UTR 克隆到pGL3 载体(Promega,Madison,WI,USA)中作为野生型(WT)3′-UTR。通过快速变化的定点诱变试剂盒(Stratagene,La Jolla,CA,USA)进行SNHG14 3′-UTR 中作为has-miR-144 结合位点的进行突变(MUT)。然后,它们用于转染CAL51 细胞。采用荧光素酶测定在双荧光素酶的表达。
1.9 Western Blot 检测采用RIPA 裂解细胞蛋白,BCA 法测定蛋白浓度后,在SDS-PAGE 凝胶电泳分离并转膜,4 ℃孵育一抗过夜,Rabbit Anti-CEP55抗体(ab170414)和Anti-beta Actin(ab227387)抗体均购自abcam。采用HRP 标记二抗孵育1 h后,采用ECL 法进行显影,图像采集后采用Image J软件进行分析。
1.10 统计学方法采用Graphpad prism 7.0 软件进行统计分析。数据以均数± 标准差表示,两组比较采用t检验,多组间比较采用方差分析,进一步两两比较采用SNK 法检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 乳腺癌组织和细胞系中LncRNA-SNHG14 的表达水平分析40 例乳腺癌肿瘤组织和癌旁组织对比中,其中肿瘤组织的LncRNA-SNHG14 的表达水平平均为(3.62±0.74)倍数变化,显著高于癌旁组织,差异具有统计学意义(P<0.001,图1A);而CAL51、BT474、HCC1954、HS578T、T-47D 人乳腺癌细胞系的LncRNA-SNHG14 的表达水平均显著高于正常的乳腺上皮细胞株MCF-10A,其中CAL51的表达水平最高,为(9.22 ± 0.45)倍数变化(图1B)。肿瘤分期为Ⅲ、Ⅳ期的LncRNA-SNHG14 的表达水平显著高于Ⅰ、Ⅱ期,且肿瘤组织学分级Ⅲ级的LncRNA-SNHG14的表达水平显著高于Ⅰ级和Ⅱ级,差异具有统计学意义(P<0.05,图1C、1D)。
2.2 敲低LncRNA-SNHG14 表达对乳腺癌细胞增殖的影响采用慢病毒敲低CAL51 细胞系的LncRNA-SNHG14表达后,RT-qPCR结果显示shRNA#1的敲低效率最高(图2A)。CCK-8 检测结果显示敲低LncRNA-SNHG14 表达后24、48 和72 h,CAL51细胞的活性显著低于对照组,差异具有统计学意义(P<0.05,图2B);克隆形成实验结果显示shRNA#1 的CAL51 细胞系其克隆形成数显著低于对照组(P<0.05,图2C、2D)。

图1 乳腺癌组织和细胞系的LncRNA-SNHG14 表达水平Fig.1 LncRNA-SNHG14 expression levels in breast cancer tissues and cell lines
2.3 LncRNA-SNHG14 对乳腺癌细胞侵袭和迁移的影响敲低LncRNA-SNHG14 后,CAL51 细胞的侵袭和迁移到下室的细胞数显著减少(P<0.001,图3),表明敲低LncRNA-SNHG14 后乳腺癌细胞的侵袭和迁移能力均显著下降。

图2 LncRNA-SNHG14 表达对乳腺癌细胞增殖的影响Fig.2 Effect of LncRNA-SNHG14 expression on proliferation of breast cancer cells
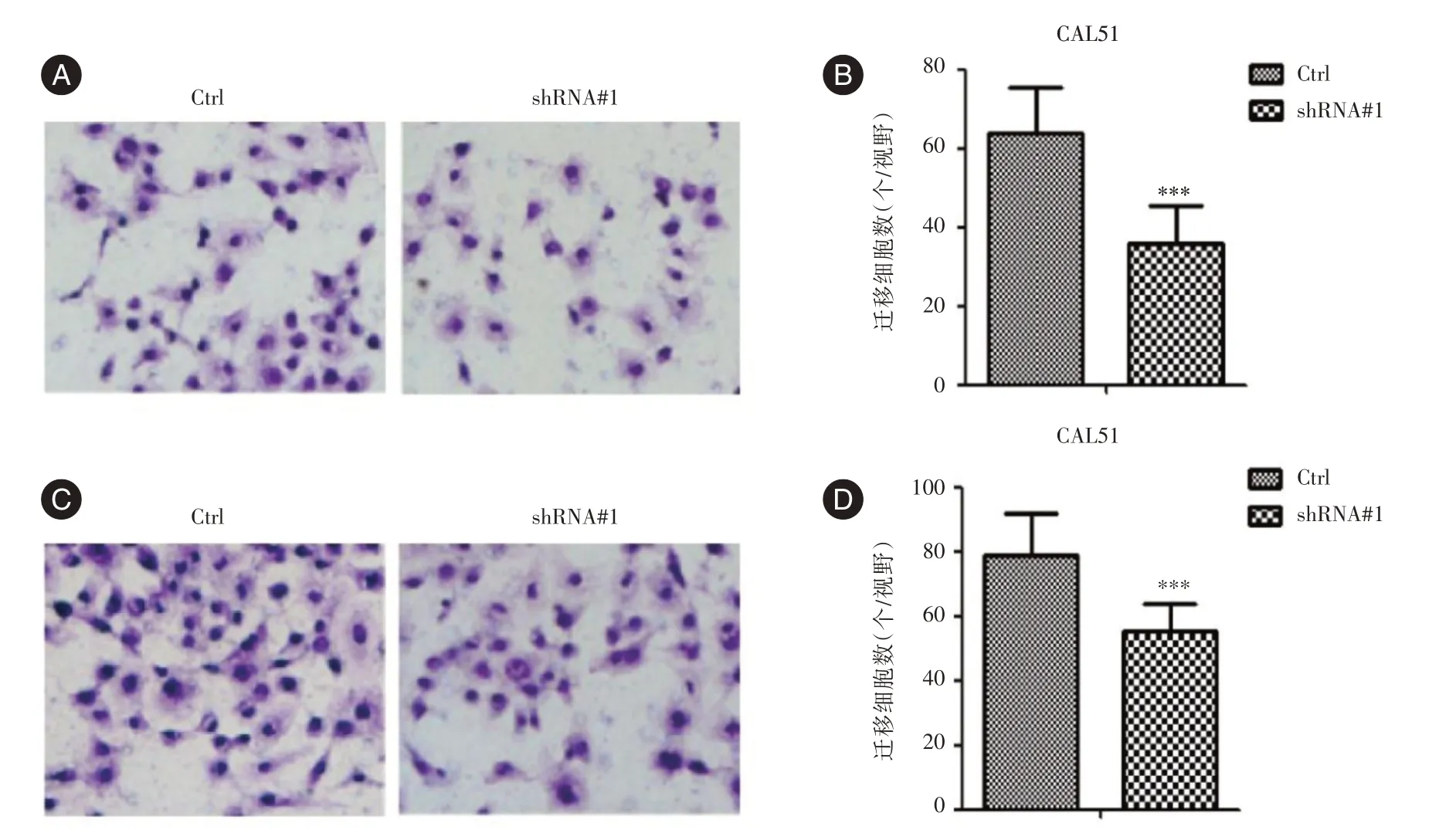
图3 LncRNA-SNHG14 对乳腺癌细胞侵袭和迁移的作用Fig.3 Effect of LncRNA-SNHG14 on invasion and migration of breast cancer cells
2.4 LncRNA-SNHG14 在乳腺癌细胞中与hasmiR-144 的关系采用starBase V3.0 预测到LncRNA-SNHG14 可以与miR-144 相结合,且has-miR-144 能靶向降解中心体蛋白55(centrosomal protein 55,CEP55)(图4A),敲低LncRNA-SNHG14后CAL51的miR-144的表达量显著上调(图4B),且荧光素酶和RNP 检测试验明确了LncRNA-SNHG14 可以与miR-144 相结合(图4C)。Kaplan Meier plotter 结果显示miR-144低表达乳腺癌患者总体生存率显著下降(图4D)。敲低LncRNA-SNHG14 后CAL51 细胞CEP55的表达水平显著下降(图4E、4F)。
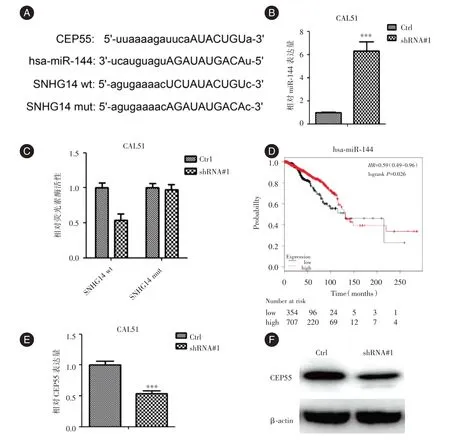
图4 LncRNA-SNHG14 与miR-144 和CEP55 的关系Fig.4 Relationship between LncRNA-SNHG14 and miR-144 and CEP55
3 讨论
大量研究表明LncRNAs 是乳腺癌增殖和转移的重要调节因子。LncRNA SNAR 可以促进乳腺癌细胞的增殖和转移,可能是新的治疗靶点[9]。LncRNA UCA1 在乳腺癌中起着致癌基因的作用,通过靶向miR-143 调节细胞增殖和凋亡[10]。LncRNA LINP1 可促进DNA 双链断裂的修复,并提高乳腺癌细胞对放疗的敏感性[11]。因此,探讨LncRNAs 在乳腺癌中的作用对乳腺癌的病理生理机制提供了新的机遇和治疗方向。最近研究[12]表明LncRNA-SNHG14在肿瘤发生的进展中起重要作用。本研究的结果初步明确了LncRNA-SNHG14在乳腺癌组织和乳腺癌细胞中表达显著上调。此外,沉默LncRNA-SNHG14 后显著抑制了乳腺癌细胞的增殖和迁移,进一步明确了LncRNA-SNHG14可以吸附miR-144 从而调节CEP55 的表达以发挥其作用。表明LncRNA-SNHG14 是调节乳腺癌细胞增殖和迁移的重要因子。
本研究首先明确了SNHG14 在乳腺癌组织和细胞系中显著高表达,并且抑制SNHG14 可以显著抑制乳腺癌细胞的增殖、侵袭和迁移作用。表明SNHG14 可以调节乳腺癌细胞的生长和转移。既往研究[13]显示LncSNHG14 促进膀胱癌的发生和进展,SNHG14 的过表达加速了增殖潜能和细胞周期进程。且SNHG14 在宫颈癌中可以显著抑制细胞增殖、迁移和侵袭,促进细胞凋亡[14],这表明了SNHG14 在多种肿瘤中均有调节细胞增殖和转移的作用。
探讨SNHG14 在乳腺癌中促进其增殖和转移作用的机制,笔者首先发现了SNHG14 可以吸附miR-144,从而间接调节了CEP55 的表达。CEP55作为微管-成束蛋白,其可在间期细胞的中心体中发现,并在细胞周期调节中起重要作用[15]。既往研究[16]表明CEP55 可以促进细胞周期发生变化,是细胞周期的生物标志物,且CEP55 在乳腺癌中显著高表达。同时,miR-144 可以同靶向CEP55 而抑制乳腺癌细胞的增殖、迁移、侵袭,具体是通过诱导细胞周期阻滞和通过抑制CEP55 的表达促进了乳腺癌细胞凋亡。本研究中采用Kaplan Meier plotter 预测到了miR-144 低表达乳腺癌患者预后显著不良,而敲低SNHG14 后乳腺癌细胞miR-144的表达显著升高,而CEP55 的表达水平显著下降,表明了SNHG14 是通过靶向吸附miR-144,进一步介导CEP55 表达上升的信号轴发挥了对乳腺癌增殖和迁移的促进作用。
对于SNHG14 对乳腺癌的体内作用以及其调节miR-144 的具体机制,仍需要进一步深入研究。综上所述,LncRNA-SNHG14 在乳腺癌组织和细胞中高表达,LncRNA-SNHG14 可通过miR-144∕CEP55 信号轴从而促进乳腺癌细胞的增殖和迁移。LncRNA-SNHG14 有望成为治疗乳腺癌的重要靶点。
