两株海水鱼肠道芽孢杆菌的分离鉴定及特性分析
2019-10-26王腾腾韩慧宗张明亮姜海滨
孙 娜,王腾腾,韩慧宗,张明亮,王 斐,姜海滨
(1.上海海洋大学水产与生命学院,上海 201306;2.山东省海洋资源与环境研究院,山东省海洋生态修复重点实验室,烟台 264006)
芽孢杆菌(Bacillus)是一类好气或兼性厌氧的革兰氏阳性杆状细菌,具有稳定性好、抗性强、复活率高等优点[1],能够产生蛋白酶、淀粉酶等大分子物质以提高宿主的消化机能,促进营养物质的消化与吸收[2]。许多研究表明,芽孢杆菌可显著改善养殖鱼类的生长特性,预防及治疗鱼类的疾病。姚清华等[3]将枯草芽孢杆菌(B.subtilis)添加到饲料中投喂鳗鲡(Anguilla japonica),显著提高了其肠道内蛋白酶、淀粉酶、脂肪酶的活力;黄灵等[4]以含芽孢杆菌的饲料投喂珍珠龙胆石斑鱼(Epinephelus fuscoguttatus♀×E.lanceolatus♂),达到了降低饲料系数、促进生长、提升免疫力的效果;CHAVES-POZO等[5]用添加了枯草芽孢杆菌的饲料投喂大黄鱼(Larimichthys crocea),提高了大黄鱼的增重率,调节了鱼体非特异性免疫,减少了疾病的发生。因此,芽孢杆菌在海水鱼养殖中的应用可促进其产业的健康和可持续发展[2]。
随着20世纪80年代海水鱼生殖调控和苗种繁育技术的突破,海水鱼类养殖产业得到突飞猛进的发展。但病害频发等问题也随之日益突出,严重制约了该产业的健康发展。从海水鱼肠道内分离芽孢杆菌等益生菌,对于研制有效的微生态制剂以提高海水鱼的抗病能力等具有重要意义。目前,解淀粉芽孢杆菌 (B.amyloliquefaciens)、枯草芽孢杆菌、地衣芽孢杆菌(B.licheniformis)以及短小芽孢杆菌(B.pumilus)等[3,6-8]均已被应用于海水鱼养殖实验中,并取得良好效果。但芽孢杆菌在海水鱼养殖中的应用仍处于初步发展阶段,可应用的种类相对较少,并且不同芽孢杆菌对不同鱼类具有特异性,是否可以成为有利于鱼体生长和免疫的益生菌尚缺乏相关的理论基础,菌株特性及其对鱼类生长发育的安全性等尚缺乏科学实验依据。因此,本研究从海捕野生蓝点马鲛(Scomberomorus niphonius)和许氏平鲉(Sebastes schlegelii)肠道内分离、纯化得到两株芽孢杆菌,采用16S rDNA基因序列分析法对其进行分类鉴定,并对其生长特性、产酶特性及动物安全性进行了研究,旨在筛选能够提高特定养殖鱼类肠道酶活性并促进其生长的芽孢杆菌,进而为研发和推广适用于海水鱼养殖的微生态制剂提供候选菌株。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
海捕野生蓝点马鲛(体长32.53 cm,体质量323.74 g)和许氏平鲉(体长26.82 cm,体质量467.06 g)购于山东烟台,用于芽孢杆菌的分离。健康许氏平鲉[体长(12.77±0.86)cm,体质量(44.96±9.11)g]和大菱鲆[体长(13.82±1.88)cm,体质量(45.26±14.03)g]由烟台泰华海洋科技有限公司提供,用于芽孢杆菌的安全性检测实验。
1.1.2 培养基
LB固体及液体培养基购于生工生物工程(上海)股份有限公司,酪素培养基、淀粉培养基、产脂肪酶定性培养基参照陶荣霞[9]的方法配置。
1.2 细菌分离纯化
使用70%的酒精擦拭鱼体腹部表面,无菌解剖,剪取前肠段,去除肠道内容物,无菌生理盐水冲洗2次,刮取肠道内壁黏膜,加入无菌生理盐水并涡旋振荡摇匀,80℃水浴热处理20 min,取100μL混合液均匀涂布于LB固体培养基,根据菌落形态学特征对细菌进行分离、纯化,并在-80℃条件下甘油保种。
1.3 细菌鉴定
1.3.1 形态观察及生理生化特性鉴定
将保种的菌株接种于LB固体培养基中,培养24 h后观察菌株形态、菌落颜色及菌落大小;并进行革兰氏染色,采用梅里埃API 50 CHB试剂盒进行生理生化特性检测,参照布坎南等[10]和东秀珠等[11]的方法对菌株进行初步鉴定。
1.3.2 16SrDNA基因序列比对及系统发育分析
采用16S rDNA基因序列分析法对初步鉴定的细菌进行分子鉴定。通用引物为 8F(5′-AGAGTTTGATCCTGGCTCAG-3′)、 1492R (5′-GGCTACCTTGTTACGACTT-3′),扩增产物经 1%琼脂糖凝胶电泳检测,送至英潍捷基(上海)贸易有限公司北京测序实验室进行测序。测序结果用BLAST软件与GenBank中的有关序列进行同源性分析,利用Mega 6.0软件构建16S rDNA系统发育树。
1.4 生长特性分析
1.4.1 温度对生长的影响
取100μL培养至指数期的菌悬液接种于LB液体培养基,分别置于 5、10、15、20、25、30、35、45、55℃下培养24 h,检测600 nm的光密度,生长情况结果以△OD600值(终止时OD600-初始时OD600)表示,每个试验组设置3个平行。
1.4.2 pH对生长的影响
取100μL培养至指数期的菌悬液接种于pH值分别为2、5、7、9和11的LB液体培养基,30℃培养24 h后检测600 nm的光密度,每个试验组设置3个平行。
1.4.3 NaCl含量对生长的影响
取100μL培养至指数期的菌悬液接种于NaCl含量(w/v%)分别为 0、1%、2%、3%、4%、5%、6%和7%的LB液体培养基,30℃培养24 h后检测600 nm的光密度,每个试验组设置3个平行。
1.5 产酶特性分析
无菌挑取芽孢杆菌分别点种到酪素培养基、淀粉培养基和产脂肪酶定性培养基上,30℃培养48 h,观察菌落周围是否产生明显的水解圈。其中酪素培养基和产脂肪酶定性培养基可分别观察到透明圈和显色圈大小;淀粉培养基采用碘试剂染色法着色后观察透明圈大小;并测量菌落和显色圈的直径[9]。
1.6 安全性检测
安全性检测实验设计参照王腾腾等[12]和EL-RHMAN等[13]的方法。选取健康的许氏平鲉和大菱鲆各54尾,分别对筛选出的2株芽孢杆菌进行安全性检测。每种菌株的检测实验共分3组,每组3个平行,每个平行分别包含实验用鱼各6尾,于70 L玻璃缸暂养7 d后用于实验。暂养期间水温(19±1)℃,日换水2次,连续充气,不投喂食物,及时清理粪便。
芽孢杆菌在35℃、200 r·min-1条件下振荡培养12 h至指数期后,6 000 r·min-1离心5 min,用0.65%的无菌生理盐水重悬至浓度为1×108cfu·mL-1。
第1、2组鱼体分别用于2株芽孢杆菌的安全性检测,每尾实验用鱼腹腔注射1 000μL 1×108cfu·mL-1菌悬液;第3组(对照组)每尾腹腔注射1 000μL 0.65%生理盐水。注射后连续观察14 d,分别记录许氏平鲉和大菱鲆的活动、摄食、排便和存活等情况,实验结束后解剖鱼体,观察鱼体脏器有无发生病变。
1.7 数据统计与分析
采用SPSS软件包单因素方差分析法(oneway ANOVA)中的Duncan多重比较检验法进行数据分析,数据差异水平设置为P<0.05;采用Origin 8.0软件作图,实验数据均用平均数±标准差(x±SD)表示。
2 结果与分析
2.1 细菌的鉴定
2.1.1 形态学及生理生化鉴定
从蓝点马鲛和许氏平鲉肠道中共分离纯化出37株细菌,通过细菌形态特征观察、革兰氏阴阳性鉴定及生理生化特征检测初步筛选出2株芽孢杆菌,分别命名为YB1和YH2。YB1菌落凸起,呈白色,表面较粗糙无光泽,边缘有褶皱;YH2菌落凸起,呈米黄色,表面有光泽,边缘光滑无褶皱。革兰氏染色均呈阳性,显微镜下观察两株菌均呈杆状。YB1和YH2的生理生化特征鉴定结果如表1所示。

表1 YB1和YH2的生理生化特性鉴定结果Tab.1 Physiological and biochemical characterization of YB1 and YH2
2.1.2 分子生物学鉴定
PCR仪扩增细菌YB1和YH2的16S rDNA基因,获得大小分别为1 431 bp和1 459 bp的片段,在NCBI数据库中对YB1和YH2的序列信息进行相似性比对分析,构建系统发育树如图1所示。结果表明:YB1和YH2均属于芽孢杆菌科(Bacillaceae)的芽孢杆菌属,YB1与蜡样芽孢杆菌(B.cereus)YJK(HQ143569.1)的相似度为99%,YH2与壁芽孢杆菌(B.muralis)HlS3200905(MG011540.1)的相似度为98%。结合形态学及生理生化特征,确定菌株YB1为蜡样芽孢杆菌,菌株YH2为壁芽孢杆菌。
2.2 YB1和YH2的生长特性
2.2.1 不同温度下YB1和YH2的生长情况
菌株YB1在15~35℃条件下均能生长,且各温度下YB1的生长情况存在显著性差异(P<0.05),在35℃时生长状况最佳;随着培养温度升高,YB1培养液的△OD600值逐渐增大;当培养温度过低(5℃、10℃)或温度过高(45℃、55℃)时,YB1培养液的△OD600值最低,YB1基本不生长(图2-a)。YH2在15~45℃条件下均能生长,且各温度下YH2的生长情况存在显著性差异(P<0.05),在30℃时生长状况最佳。在15~30℃,随着培养温度升高,YH2培养液的△OD600值逐渐增大;当培养温度大于30℃时,YH2培养液的△OD600值逐渐降低;当培养温度过低(5℃、10℃)或温度过高(55℃)时,YH2培养液的△OD600值最低,YH2基本不生长(图2-b)。
2.2.2 不同pH下YB1和YH2的生长情况

图1 基于16S r DNA序列的菌株YB1和YH2系统发育树Fig.1 Clustering results of strains YB1 and YH2 based on 16S r DNA gene sequence
菌株YB1在pH为5~9的培养基下均能生长,但生长情况存在显著性差异(P<0.05):在pH为5~7的培养基中,随着pH的升高,YB1培养液的△OD600值逐渐增加,在pH为7时达到最大,说明在该pH下YB1的生长情况最好;在7~9之间,培养液的△OD600值有所下降,当培养基pH过低(pH=2)或过高(pH=11),YB1基本不生长(图3-a)。YH2在pH为5~9的培养基下均能生长,但其生长情况存在显著性差异(P<0.05):在pH为5时生长状况最佳;随着pH的升高,YH2培养液的△OD600值逐渐降低,说明YH2适宜在偏酸环境下生长。当培养基pH过低(pH=2)或过高(pH=11),YH2基本不生长(图3-b)。

图2 不同温度下YB1和YH2的生长情况Fig.2 Growth of YB1 and YH2 in various temperatures

图3 不同pH下YB1和YH2的生长情况Fig.3 Growth of YB1 and YH2 in various pH
2.2.3 不同NaCl含量下YB1和YH2的生长情况
菌株YB1在NaCl含量为0~5%的LB培养基中均能生长;随着NaCl含量的升高,YB1培养液的△OD600值逐渐降低,说明向LB培养基中添加NaCl不利于YB1的生长;当NaCl含量大于6%时,YB1基本不生长(图4-a)。YH2在NaCl含量为0~7%的LB培养基中均能生长,在NaCl含量为2%时生长情况最佳;在0~2%的培养基中,随着NaCl含量的升高,YH2培养液的△OD600值逐渐升高;在3%~7%时,随着NaCl含量的升高,培养液的△OD600值逐渐下降(图4-b)。
2.3 YB1和YH2的产酶特性
菌株YB1和YH2的产酶能力测试结果如图5所示。YB1和YH2均具有产蛋白酶和淀粉酶的能力,不具有产脂肪酶的能力。测量分析YB1和YH2在培养基上产生透明圈与菌圈直径比的大小(表2),结果表明,YB1的产酶能力均强于YH2。
2.4 YB1和 YH2的安全性
以1×108cfu·mL-1浓度向许氏平鲉和大菱鲆腹腔注射YB1和YH2,观察并统计实验用鱼的生存和死亡情况(表3)。结果显示:注射YB1菌悬液的许氏平鲉和分别注射YB1和YH2菌悬液的大菱鲆游泳和摄食能力良好,未出现伤亡个体,解剖后内脏组织正常,无病变现象。而注射YH2菌悬液的许氏平鲉在第3天开始出现死亡现象,实验结束时共计6尾个体死亡,解剖存活和死亡鱼体,内脏组织正常,无病变现象。以上结果表明:在注射浓度≤1×108cfu·mL-1时,YB1对大菱鲆和许氏平鲉均是相对安全的,而YH2仅对大菱鲆是相对安全的。
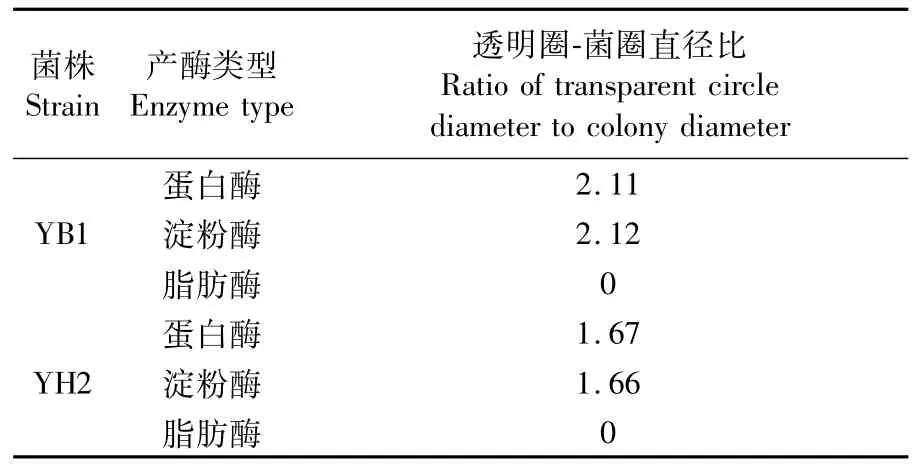
表2 芽孢杆菌YB1和YH2产蛋白酶、淀粉酶和脂肪酶定性检测透明圈-菌圈直径比Tab.2 Ratios of transparent circle diameter to colony diameter in qualitative plate tests of protease,amylase and lipase

表3 YB1和YH2的安全性检测实验结果Tab.3 Safety test results of strains YB1 and YH2

图4 不同NaCl含量下YB1和YH2的生长情况Fig.4 Growth of YB1 and YH2 with various NaCl concentrations

图5 YB1和YH2产蛋白酶和淀粉酶定性检测结果Fig.5 Results of protease and amylase qualitative tests of YB1 and YH2
3 讨论
芽孢杆菌是一类产芽孢、抗应激、具有高活性消化酶系的异养细菌[14],在海水鱼肠道内定植后,能够提高肠道消化酶的活力、抑制有害菌群的生长繁殖、调节肠道内环境的平衡,从而促进海水鱼的生长,预防疾病的发生。目前,已有部分分离自海水鱼肠道的芽孢杆菌得到了鉴定,如短小芽孢杆菌(B.pumilus)SE5和克劳氏芽孢杆菌(B.clausii)DE5分离自斜带石斑鱼(Epinephelus coioides)[8]、枯草芽孢杆菌 M001分离自牙鲆(Paralichthys olivaceus)[15],通过对其开展养殖评价实验已取得了良好的益生效果。本研究首次从海捕野生蓝点马鲛和许氏平鲉肠道内分离获得了两株特征明显的芽孢杆菌菌株YB1和YH2,分别鉴定为蜡样芽孢杆菌YB1和壁芽孢杆菌 YH2。YB1在 15~35℃、pH 5~9、NaCl含量0~5%范围内生长较快,YH2在15~45℃、pH 5~9、NaCl含量0~7%范围内生长较快,表明2株芽孢杆菌对温度、pH和NaCl含量具有广泛的适应性,可适于不同海水鱼类肠道环境。
鱼类肠道中的芽孢杆菌可以通过分泌蛋白酶、淀粉酶和纤维素酶等多种胞外酶参与宿主的消化和免疫过程[16-18]。刘晓勇等[19]的研究表明,饲料中添加适量枯草芽孢杆菌可有效提高杂交鲟(Acipenser baeri♂×A.schrenkii♀)幼鱼肠道内蛋白酶、淀粉酶和脂肪酶的活性,促进其生长;马如龙等[20]的研究发现饲料中添加芽孢杆菌可以提高石斑鱼肝胰脏和肠道的消化酶活性;LIU等[21]的研究表明,饲料中添加枯草芽孢杆菌可显著提高斜带石斑鱼头肾白细胞的吞噬活性、呼吸爆发活性、SOD活性、血清LSZ活性和血清选择性补体(ACH50)活性。本研究筛选的2株芽孢杆菌均具有较好的产蛋白酶和淀粉酶的能力,说明2株芽孢杆菌可以高效分解食物中的淀粉和蛋白质,定植于海水鱼肠道内可以提高其肠道中淀粉酶和蛋白酶活力,促进海水鱼对营养物质的消化吸收,从而促进海水鱼的生长。
益生菌是一种活性微生物或微生物制剂,因其安全、无毒、无副作用等优点在水产养殖中得到了良好的应用,但WANG等[22]提出马来西亚发现的对虾细菌性白斑病是由枯草芽孢杆菌引起的;胡宗云等[23]认为蜡样芽孢杆菌是黄颡鱼(Pelteobagrus fulvidraco)“红头病”的病原菌之一。因此开发益生菌应用于生产前,为确保其对机体无致病性,必须开展安全性检测。吕利群等[24]在开发解淀粉芽孢杆菌Sh1时发现,腹腔注射1×108cfu·mL-1的 Shl对草鱼(Ctenopharyngodon idellus)的生长没有任何不良影响;王腾腾等[12]在许氏平鲉养殖生产中应用食窦魏斯氏菌(Weissella cibaria)YH1前,验证了YH1对鱼体是安全的;巴翠玉等[25]在开发水产类微生态制剂时,通过腹腔注射证实了枯草芽孢杆菌对鲫(Carassius auratus)无致病性。本研究中动物安全性检测实验表明,YB1在浓度≤1×108cfu·mL-1对大菱鲆和许氏平鲉均是相对安全的,YH2在浓度≤1×108cfu·mL-1对大菱鲆是相对安全的,注射YH2的许氏平鲉出现6尾死亡的情况,故排除其作为许氏平鲉益生菌的可能性,因此2株芽孢杆菌对特定养殖对象是安全的。本研究为下一步探究蜡样芽孢杆菌YB1和壁芽孢杆菌YH2对特定养殖对象生长和免疫的影响提供了理论依据,为其应用于生产提供了可能。
综上所述,本研究分析了蜡样芽孢杆菌YB1和壁芽孢杆菌YH2的生长条件,验证了其产酶特性和动物安全性,显示了YB1和YH2作为有益菌用于海水鱼养殖的潜力。
