大黄酚对局灶性脑缺血再灌注小鼠Beclin1及Bax的作用
2019-10-24房亚兰黄语悠赵咏梅师文娟李锦程段云霞罗玉敏
房亚兰 黄语悠 赵咏梅* 师文娟 李锦程 段云霞 高 利 罗玉敏
(1. 北京市平谷区医院全科医疗科,北京 101200;2. 首都医科大学宣武医院 北京市老年病医疗研究中心,北京 100053)
卒中是世界范围内死亡和残疾的主要原因,严重危害人类健康,缺血性卒中是最常见的卒中形式,约占所有卒中的80%[1]。虽然在血管再通方面取得了一定进展,但静脉注射重组组织纤溶酶原激活剂实现血管再通受到治疗时间窗的限制[2],并且缺血后血液供应的恢复可导致继发性脑损伤,即脑缺血再灌注(I/R)损伤,其病理生理机制非常复杂[3]。
脑缺血再灌注导致许多应激因子的产生和激活,这些因子触发并增强自噬及细胞凋亡。自噬是对异常的蛋白质或细胞器进行降解及再循环,以避免老化蛋白质或受损细胞器的积累,从而实现各种细胞成分的更新[4]。因此,生理状态下,适当的自噬具有细胞保护作用,在营养缺乏的条件下促进细胞存活。但脑缺血再灌注时,自噬被过度激活,则引起神经细胞死亡[5]。有研究[6]表明,抑制自噬可减少氧糖剥夺条件下的神经元死亡。Beclin1蛋白在自噬的起始阶段发挥重要作用[7],目前认为自噬是不同于坏死和凋亡的生理过程,是卒中后第三种类型的细胞死亡[8]。近年来的研究[5, 8]表明,神经元自噬与脑缺血再灌注损伤密切相关。细胞凋亡亦是脑缺血诱导的神经元死亡的重要途径之一,Bax蛋白作为细胞凋亡家族的重要组成成员,与Beclin1共同参与细胞凋亡和自噬的调控[9-10]。
大黄酚(chrysophanol, CHR)是中药大黄的一种有效提取成分[11],具有减少炎性因子、抑制氧化应激、抑制内质网应激等作用[12-14]。一些研究[11-14]表明,在脑缺血再灌注损伤中,CHR具有显著的神经保护作用,但其相关作用机制尚不完全清楚。因此,本研究用小鼠制作大脑中动脉梗死(middle cerebral artery occlusion, MCAO)再灌注模型,探究CHR对脑缺血再灌注小鼠再灌注后14 d自噬和细胞凋亡的影响,为CHR发挥脑缺血再灌注损伤的长期脑保护作用机制提供更多的科学依据。
1 材料与方法
1.1 实验动物及分组
2月龄C57BL/B6健康雄性小鼠18只,购自北京维通利华实验动物公司,实验动物许可证号:SCXK(京) 2012-0001,体质量(23.5±1)g,饲养于首都医科大学宣武医院SPF级动物实验室。采用数字表法将实验小鼠随机分为3组:假手术组(Sham,n=6);缺血再灌注组(MCAO,n=6);大黄酚给药组(CHR,n=6)。CHR溶于含1%(体积分数)Tween 80和1%(体积分数)DMSO的0.9%(质量分数)氯化钠注射液中,自缺血再灌注模型制作当天至再灌注后14 d,连续每天予以CHR组小鼠腹腔注射0.1 mg/kg CHR, Sham组和MCAO组小鼠腹腔注射同等体积的含1%(体积分数) Tween 80和1%(体积分数)DMSO的0.9%(质量分数)氯化钠注射液。
1.2 主要仪器设备与试剂
小动物手术显微镜(Carl Zeiss公司,德国)、双极电凝器(ACC100,德威公司)、麻醉机(Harvard Apparatus公司,美国)、反馈式温度调节仪(CMA 150 ,Carnegie Medicin公司,瑞典)、离心机(Thermo Fisher Scientific公司,美国)、荧光显微镜(Nikon公司,日本)等。
CHR(中国食品药品检定研究院);Tween 80(Sigma公司,美国);恩氟烷(河北一品制药有限公司);Beclin1抗体(Abcam公司,美国);Bax抗体(CST公司,美国);NeuN抗体(Millipore公司,美国);β-actin抗体(Santa公司,美国)等。
1.3 动物模型制作
参照改良ZeaLonga法[15]制作小鼠MCAO模型。将恩氟烷混合于70%(体积分数)N2O和30%(体积分数)O2,用5%(体积分数)恩氟烷对实验小鼠进行诱导麻醉,再用2%(体积分数)恩氟烷维持麻醉。自小鼠颈部正中切口分离右侧颈总动脉、颈内动脉及颈外动脉,将尼龙线栓(头端直径为0.38 mm)自颈外动脉残端插入颈内动脉,至距颈外动脉和颈内动脉分叉约1 cm处。手术操作过程中应用反馈性控温毯监测实验小鼠肛温,维持在(37.0±0.5) ℃。栓塞45 min后,拔出线栓进行再灌注。术后小鼠自由进食及饮水,并饲养于SPF级动物实验室。
1.4 免疫荧光双标染色
于缺血再灌注模型制作后的第14天,所有小鼠腹腔注射水合氯醛麻醉,断头取脑,置于4%(质量分数)多聚甲醛后固定48 h,再经30%(质量分数)蔗糖脱水24 h后,将脑组织制作连续冰冻切片,每片脑组织厚度均为20 μm,脑组织切片用PBS清洗后,于含有0.2%(体积分数)TritonX-100的PBS中室温下孵育10 min,用PBS清洗后,于5 %(体积分数)山羊血清中室温下封闭30 min,滴加一抗(Beclin1与NeuN鼠多克隆抗体 1∶300),4 ℃过夜。次日将脑组织切片用PBS清洗后,滴加山羊抗鼠和山羊抗兔荧光二抗(1∶300),室温避光孵育1 h。PBS清洗后,用DAPI (4′,6-diamidino-2-phenylindole)封片剂封片。置于荧光显微镜下观察。每组小鼠选择同一位置的脑切片3张,在相同放大倍数、相同参数条件下,每张脑组织冰冻切片随机选取4个脑皮质缺血半暗带区视野照相,使用NIS Element软件统计。
1.5 Western blotting
于缺血再灌注模型制作后的第14天,所有实验小鼠经水合氯醛麻醉后断头取脑,立即置于模具中,于前囟0到-0.1切取厚度1 mm的冠状脑组织切片,在冰上将缺血梗死侧脑组织置于含蛋白酶抑制剂的裂解缓冲液中匀浆,冰浴30 min后,经4 ℃ 12 000g离心30 min后取上清液。采用BCA法测定蛋白浓度。样品中加入上样缓冲液煮沸10 min,然后行SDS-PAGE电泳,湿转法转膜90 min,于室温下5%(质量分数)脱脂牛奶中封闭1 h,将膜置入一抗(Bax 1∶1 000,β-actin 1∶1 000),于4 ℃孵育过夜,经TBST清洗3次,于室温下HRP标记的二抗中孵育1 h,经TBST清洗3次后,加入ECL化学发光液显色,于化学发光系统检测,蛋白条带用Image J软件进行定量分析。
1.6 统计学方法

2 结果
2.1 CHR抑制MCAO小鼠脑缺血半暗带区Beclin1表达
免疫荧光双标染色结果可见,在MCAO小鼠脑缺血半暗带区内可见Beclin1阳性细胞为红色荧光染色、NeuN阳性细胞为绿色荧光染色,细胞核为蓝色荧光。图像合并后,Beclin1红色荧光与NeuN绿色荧光重合,表明Beclin1与神经元共定位,即脑缺血再灌注后Beclin1在缺血半暗带区神经元内表达(图1A)。结果还显示,Sham组小鼠脑组织内偶见Beclin1红色荧光染色;与Sham组相比,MCAO组小鼠脑缺血半暗带区Beclin1染色阳性细胞显著增多(P<0.05);与MCAO组相比,CHR组小鼠脑缺血半暗带区Beclin1的表达显著减少(图1A),差异有统计学意义(P<0.05,图1B)。
2.2 CHR抑制MCAO小鼠缺血侧脑组织Bax蛋白的表达
如图2所示,缺血45 min再灌注后第14天,MCAO组小鼠缺血侧脑组织的Bax蛋白表达水平比Sham组明显增多,差异有统计学意义(P<0.05)。与MCAO组相比,CHR组小鼠缺血侧脑组织Bax蛋白表达水平明显减少,差异有统计学意义(P<0.05)。
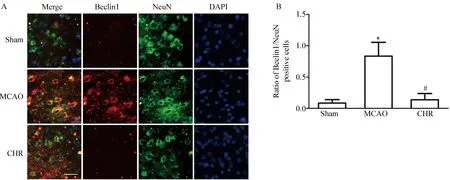
图1 免疫荧光双标染色法检测脑缺血再灌注后14 d Sham、MCAO与CHR组小鼠脑缺血半暗带区Beclin1与NeuN的表达 Fig.1 Expression of Beclin1 (red) and NeuN (green) in cerebral ischemia penumbra of Sham, MCAO and CHR groups mice 14 d after reperfusion by double immunofluorescence labeling
A:representative double immunofluorescence labeling of Beclin1 (red) / NeuN (green) on 14 d after ischemia/reperfusion. Bar=20μm.B: quantification of Beclin1-positive cells. (n=5, mean±SD)*P<0.05vsSham group,#P<0.05vsMCAO group;MCAO: middle cerebral artery occlusion;DAPI: 4′,6-diamidino-2-phenylindole;CHR: chrysophanol.
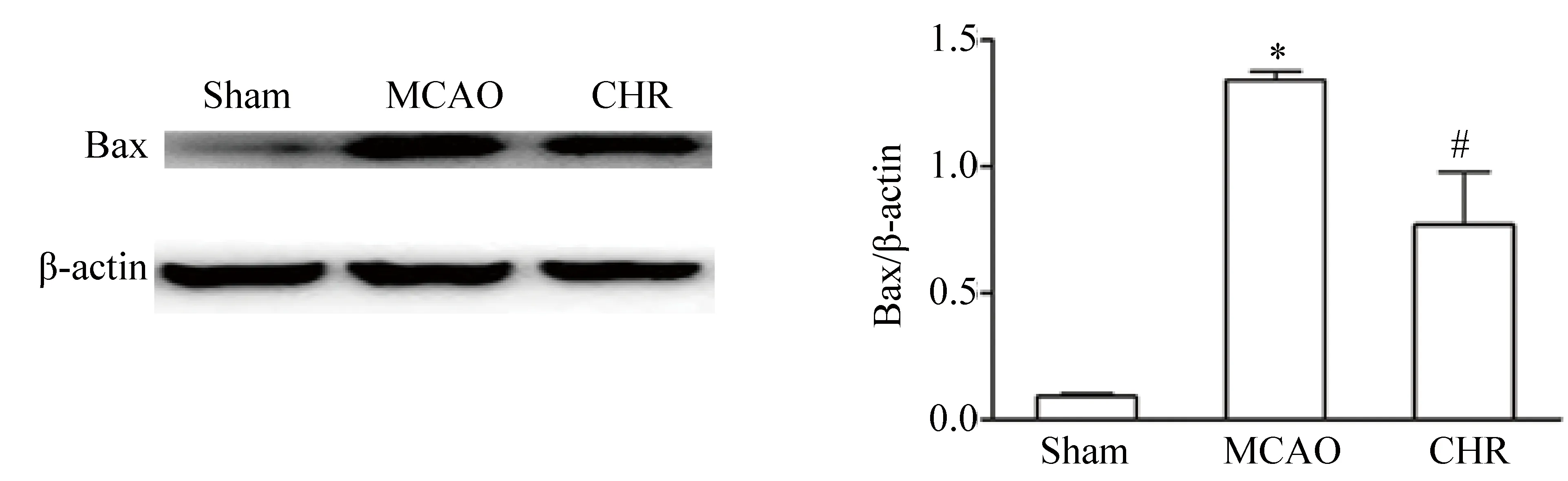
图2 蛋白免疫印迹法检测脑缺血再灌注后14 d Sham、MCAO及CHR组小鼠缺血侧脑组织促凋亡蛋白Bax的表达Fig.2 Expression of Bax in ischemia brain tissue of Sham, MCAO and CHR groups mice 14 d after reperfusion by Western blotting
*P<0.05vsSham group,#P<0.05vsMCAO group (n=5, mean±SD);MCAO: middle cerebral artery occlusion;CHR: chrysophanol.
3 讨论
脑缺血再灌注损伤涉及炎性反应、氧化应激、内质网应激、钙离子稳态失衡等许多复杂的病理生理过程,自噬和凋亡亦是脑缺血再灌注损伤的重要环节,这些因素相互作用,最终引起神经元死亡[3]。笔者前期的研究[13-14,16]显示,经HE染色小鼠脑组织切片,发现MCAO小鼠的缺血侧脑组织丢失面积显著增加,CHR能显著减少小鼠缺血侧脑组织丢失面积,降低转棒试验、平衡木实验等神经功能评分,并能够有效抑制脑缺血再灌注后的炎性因子、减少活性氧自由基(reactive oxygen species, ROS)产生、抑制内质网应激,显著提高MCAO小鼠再灌注后14 d的生存率,具有长期的脑保护作用。但是关于CHR对自噬和细胞凋亡的影响仍不明确,对此环节的深入研究或许可为CHR减轻脑缺血再灌注损伤的机制提供更多的科学依据。Beclin1目前被认为是自噬的重要标志蛋白[7]。Bax作为细胞凋亡领域的研究热点之一,具有促进细胞凋亡的作用[17]。本研究采用MCAO模型小鼠,应用免疫荧光染色法检测脑缺血半暗带区Beclin1蛋白的水平,Western blotting方法检测缺血侧脑组织Bax蛋白的表达水平,探究CHR在脑缺血再灌注过程中对于神经元自噬及凋亡的影响,从而进一步明确CHR发挥神经保护作用的相关机制。
近几年的研究[4,18]表明,自噬是细胞经由溶酶体途径对细胞内功能失调的细胞器和异常的蛋白质进行降解和再利用的过程,对于自体修复具有重要意义,适度的自噬有助于维持细胞稳态。但是在特定条件下,自噬被过度激活则会引起自噬性细胞死亡[18-19],研究[5-6,8]表明,自噬在I / R损伤中扮演极其重要的角色。Beclin1参与自噬体膜的形成,在自噬的起始阶段具有重要作用,其表达水平与自噬活性密切相关[7,20-21]。为了探究CHR对脑缺血再灌注后自噬的影响,本研究检测了CHR对MCAO小鼠脑缺血半暗带区自噬相关蛋白Beclin1的影响。研究结果显示,脑缺血再灌注后14 d,与Sham组相比,MCAO组小鼠脑缺血半暗带区的Beclin1蛋白水平明显增多。Beclin1调控其他自噬蛋白到自噬前体中,在自噬过程中发挥正性调节作用[20]。敲除Beclin1可通过抑制自噬减轻脑缺血后神经变性[19]。因此本研究表明,脑缺血再灌注后可诱导Beclin1蛋白过量产生,进而过度激活自噬。通过将Beclin1与NeuN进行免疫荧光双标染色显示,自噬相关蛋白Beclin1与神经元共定位,提示脑缺血再灌注后神经元发生自噬性死亡可能是脑损伤的主要原因之一。予以CHR治疗的MCAO小鼠脑缺血半暗带区Beclin1蛋白水平明显下降,表明CHR可能通过减少Beclin1产生,进而抑制过度自噬,减少神经元自噬性死亡,发挥长期脑保护作用。
Beclin1是协调细胞自噬与凋亡的重要蛋白质[9,21]。新的研究[8]表明,自噬和细胞凋亡是细胞程序性死亡的主要形式。自噬与凋亡相互作用,可加重细胞受损,增加细胞死亡[22-23]。Bcl-2家族是调节细胞凋亡的主要途径,抗凋亡蛋白Bcl-2和促凋亡蛋白Bax是Bcl-2家族的重要组成成员[24]。关于心肌缺血再灌注的研究[25-26]显示,Bcl-2与Beclin1相互作用可调节自噬程度,抑制过度自噬诱导的细胞死亡,从而发挥心肌保护作用。有关食管癌的临床研究[27-28]显示,Beclin1蛋白表达与Bax水平呈正相关,Bax蛋白高表达在高分化食管鳞癌中可抑制Bcl-2对于Beclin1的调节,促进Beclin1介导的细胞自噬性死亡。经高浓度半胱氨酸蛋白酶抑制剂C处理的脑缺血再灌注大鼠,缺血侧脑皮质内的促凋亡蛋白Bax与自噬蛋白Beclin1过量表达,进一步的相关性分析表明,缺血侧脑皮质内的凋亡细胞数与Beclin1呈正相关[10]。然而,目前对于Beclin1与Bax在脑缺血再灌注损伤中具体的相互作用关系尚不明确。本研究提示,Beclin1与Bax可能存在相互作用,进而调节细胞自噬与凋亡。因此,本研究进一步探究了CHR对MCAO小鼠缺血侧脑组织Bax蛋白水平的影响,结果显示,脑缺血再灌注后14 d,MCAO组小鼠缺血侧脑组织Bax蛋白水平较Sham组小鼠明显升高,表明脑缺血再灌注损伤诱导促凋亡蛋白Bax大量表达,引起细胞凋亡。给予CHR治疗的MCAO小鼠缺血侧脑组织Bax蛋白水平较MCAO组小鼠明显降低,说明CHR可减少Bax蛋白产生,抑制细胞凋亡。结合本研究中CHR减少MCAO小鼠脑缺血半暗带区Beclin1表达,提示CHR可能通过减少Bax促凋亡蛋白表达,抑制Beclin1介导的神经元自噬性死亡。
综上所述,本研究结果表明,给予CHR治疗可抑制促凋亡蛋白Bax产生,下调自噬蛋白Beclin1的表达,进而抑制脑缺血再灌注后神经元凋亡和自噬,减少神经元死亡,发挥长期神经保护作用。
