一种用于肺部图像引导放射治疗的双能X射线透视成像方法
2019-10-24贺树萌马善达付东山
贺树萌,马善达,王 伟,付东山*
(1.天津医科大学肿瘤医院放射治疗科 国家肿瘤临床医学研究中心 天津市“肿瘤防治”重点实验室 天津市恶性肿瘤临床医学研究中心,天津 300060;2.江苏瑞尔医疗科技有限公司,江苏 无锡 214192)
双能减影(dual energy subtraction, DES)成像技术于1967由Alvarez等首先提出,于1986年首次用于临床诊断,目前主要用于放射诊断领域,包括检测及诊断胸部异常[1-5]及骨密度仪等[6];其在放射治疗领域的研究对象普遍为模体[7],临床研究尚处于起步阶段。X线在穿透人体的过程中主要发生光电效应和康普顿效应。采用高低能X线分别照射同一种物质时,在高能X线束作用下主要发生光电效应,低能X线束作用下主要发生康普顿效应。采用单次曝光法与双次曝光法两种方法可获得高低能X线图像。传统双次曝光法中高低能X线切换时间较长,受患者呼吸、肌肉及心脏运动影响,所得减影图像易存在运动伪影。
本文提出一种双能X线透视成像方法,以高低能X线对同一部位进行曝光,通过高低能快速切换方式采集一对高低能图像,以最大限度降低减影图像的运动伪影。双能X线透视成像设备具有C型臂旋转结构,可在不同投影方向采集呼吸周期内9或10个时相的高低能图像对序列。通过改进传统对数加权减影算法,本文提出的自动双能减影首先对高能X线图像进行低通滤波,以降低软组织减影图像中的量子噪声,然后采用CNR值作为图像评价参数,自动搜索对数加权值,获得最佳质量的软组织减影图像。本研究采集和分析了20例肺部肿瘤患者的临床数据,并与高低能X线图像进行目视对比,评价其对软组织减影图像中肿瘤可视度的提高程度。
1 设计与方法
1.1 成像设备及图像采集 双能X线透视成像设备主要由C型臂、治疗床、X线管、平板探测器、高压发生器和控制计算机组成(图1),可在不同投影角度采集图像。
通过双次曝光法采集高低能X线图像对,采集过程中高低能X线快速切换。采集双能图像时需要每个管电压保持在平稳状态,若X线能量切换时间较短,会造成管电压在切换瞬间围绕基准电压上下波动,产生不稳定的高低能X线而影响图像质量。受设备限制,传统图像采集方式采用较长的能量切换时间来保证电压的稳定性。受患者呼吸、肌肉、心脏运动的影响,如不进行高低能X线切换,得到的减影图像易存在运动伪影。本研究选用升压时间短且稳定的定制高压发生器,以缩短能量切换时间,同时保证管电压的稳定性;高能X线能量在125~135 kVp之间、低能X线能量在70~80 kVp之间选择。

图1 双能X线透视成像设备 图2 一组高低能脉冲序列
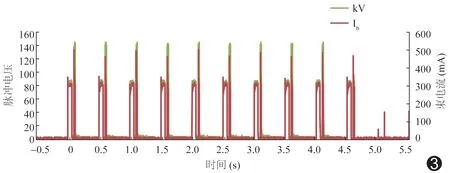
图3 连续高低能脉冲序列
图2示采集图像过程中的一组高低能脉冲序列(130 kVp/75 kVp),其中If、Ib和kV分别是灯丝电流、脉冲电流和电压,Trigger指高能触发信号。首先通过一个低能长脉冲(75 kVp, 65 ms)完成低能X线图像采集,此过程中脉冲电流由180 mA上升至290 mA;经过33 ms低能到高能的切换时间;再触发一个高能短脉冲(130 kVp, 5 ms)完成高能X线图像采集。采集一组高低能X线图像需103 ms,快速切换可避免呼吸运动引起的图像伪影。
图3示本成像设备通过触发连续高低能脉冲序列,每对高低能脉冲之间间隔0.4 s,在一个呼吸周期内(4~5 s)可采集9或10个呼吸时相的图像,形成呼吸周期运动图像序列。采集20例接受放射治疗的肺部肿瘤患者的图像,每例分别在0°、45°、90°和135°投影方向采集9或10个时相的高低能X线图像对序列,高低能脉冲电压范围选择分别为120~130 kVp和70~80 kVp。
1.2 自动减影算法 通过对数加权减影公式获得软组织减影图像:
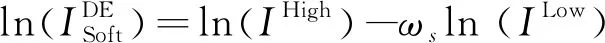
(1)

研究[8]指出减影会造成图像中量子噪声扩大,降低图像质量,使组织结构细节模糊。由于软组织减影图像中的绝大部分量子噪声由高能X线图像引入[9],对高能X线图像通过低通滤波,去除量子噪声,软组织减影图像中的高频信息由未经低通滤波的低能X线图像提供。改进后的对数加权减影公式为:

(2)

自动减影算法采用CNR值作为图像质量评价参数,自动获取最佳软组织减影图像。CNR指两种组织信号强度差异与背景噪声强度之比,在减影过程中以之作为衡量骨骼与软组织区域之间对比度的评价参数。对权重系数进行固定步长迭代,精确计算迭代过程中每个权重系数对应的CNR值。CNR值最小时,骨骼与软组织间的对比度小,骨骼被充分减去,减影效果最佳,此时对应最佳权重系数和最优软组织减影图像。CNR值计算公式:
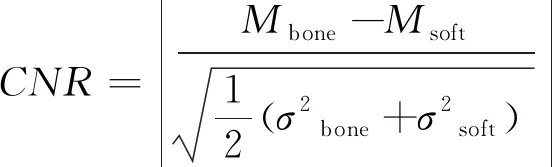
(3)
其中Mbone,Msoft分别代表骨骼与肺部软组织的像素平均值,σbone和σsoft分别代表骨骼和肺部软组织的像素标准偏差。
在有明显骨骼与软组织对比度的肺实质区域计算CNR值,选择图像对比度较高的低能X线图像确定肺实质区域,提取肺实质,并进行骨骼与软组织图像分割。肺部组织密度低,在X线图像中呈现为2个独立的亮区域。根据此灰度特征,计算整幅图像在水平方向与垂直方向的平均投影灰度值,划分出左右2个肺实质区域[10],见图4A。在面积较大的肺实质区内使用形态学滤波与最小误差阈值分割法[11],分割出肺实质的主要部分,见图4B,肺实质图像仅包含肺部软组织与骨骼。然后采用王鑫等[12]的基于Hough变换的肋骨边缘检测法确定骨骼边界,分割出骨骼和软组织(图4C、4D)。
2 结果
采用双能X线透视成像系统对20例患者在0°、45°、90°、135°投影方向采集呼吸周期9或10个时相的高低能图像对序列,分别获得198、196、198和198个高低能图像对,共790组,分析790个高低能图像对,获得790幅软组织减影图像;通过与高低能X线图像的目视对比,评价软组织减影图像中肿瘤可视度的提高程度。
2.1 自动减影算法结果 图5A和5B为一对高能X线图像(125 kVp)和低能X线图像(70 kVp),图5C为通过本文减影算法获得的软组织减影图像。在减影图像计算过程中,对ωs在0~1范围内进行迭代,迭代步长0.001。图6为减影迭代过程中权重系数ωs与CNR值的关系曲线,图7为不同ωs取值时对应的减影图像结果。如图6和图7所示,随ωs值增大,CNR值变小,当ωs值达到0.635时,CNR值最小,减影图像质量最好,骨骼被充分消除(图7F);当ωs取值过大时,骨骼边界重现,减影图像出现失真(图7G、7H)。
图8A和8B分别为经传统减影算法和自动减影算法处理得到的软组织减影图像,白色矩形内为肿瘤区域;图8C和8D分别为图8A和8B白色矩形内放大的肿瘤区域。目视对比可见自动减影算法得到的图像噪声小,肿瘤细节更加清晰。
2.2 肿瘤可视度评价 2名影像科医师通过目视判断高低能X线图像与减影图像中肿瘤的可视度和清晰度,发现高低能图像中,受骨骼遮挡,肿瘤可见度很低,而经自动减影算法处理得到的软组织减影图像中肿瘤清晰可见(图9)。
在0°、45°、90°和135°方向分别采集的198、196、198和198个高低能X线图像对中,肿瘤可视图像分别为198、38、69和49对,可视比例分别为100%(198/198)、19.39%(38/196)、34.85%(69/198)和24.75%(49/198)。骨骼遮挡是造成肿瘤不可视或可视度低的主要原因。软组织减影图像中肿瘤可视图像分别为198、108、149和159幅,可视比例提升至100%(198/198)、55.10%(108/196)、75.25%(149/198)和80.30%(159/198),肺部肿瘤可视度得到显著提高。

图4 软组织区域与骨骼位置确定过程图 A.肺实质区域; B.肺实质; C.骨骼; D.软组织

图5 患者男,60岁,肺癌,软组织减影图像的效果图 A.高能X线图像; B.低能X线图像; C.软组织减影图像

图6 ωs-CNR值曲线
3 讨论
本研究提出的双能X线透视成像方法包含图像采集系统与自动减影算法两部分。图像采集系统采用C臂旋转结构和高低能快速切换采图机制,可在任意投影角度采集图像,高低能快速切换可避免运动伪影产生。以自动减影算法对高能X线图像进行去噪处理,可减少软组织减影图像中的量子噪声,保留肿瘤
部位细节清晰度,提高软组织减影图像的图像质量;采用CNR值作为减影过程中的图像质量评价参数,自动获取最佳软组织减影图像,无需人工干预,可避免人工操作带来的不确定性。自动减影算法在Matlab中实现,计算耗时<0.8 s,后续将采用C++实现本算法,并使用GPU加速和并行运算,以提高实时性。此法具有伪影低、图像质量高、全自动无需人工干预的优点,可显著提高肺部肿瘤可视度,提供完整肿瘤信息。
目前常用的肿瘤动态跟踪方式主要为kV级X线立体平面成像系统[13-14],受骨骼遮挡难以直接对肿瘤进行定位跟踪,通常在肿瘤内部或附近植入一个或多个金属标记,通过跟踪金属标记间接估算肿瘤位移,且金属标记植入可能引发气胸等并发症。本文方法为无标记肿瘤运动跟踪提供了新的途径:通过自动双能减影算法获得呼吸周期所有时相的软组织减影图像序列,以图像间平均像素差值作为衡量标准,自适应选择匹配所需的参考图像,采用基于归一化互信息的软组织图像匹配算法,获取呼吸周期所有时相的肿瘤位置,实现无标记定位跟踪运动肿瘤。

图7 ωs不同取值时减影结果图 A.ωs=0.2; B.ωs=0.3; C.ωs=0.4; D.ωs=0.5; E.ωs=0.6; F.ωs=0.635; G.ωs=0.7; H.ωs=0.8

图8 减影结果对比图 A.传统减影算法结果; B.自动减影算法结果; C.传统减影算法结果肿瘤区域放大图; D.自动减影算法结果肿瘤区域放大图

图9 肿瘤可视度目视比较 A.高能图像(130 kVp)及肿瘤区域; B.低能图像(70 kVp)及肿瘤区域; C.软组织减影图及肿瘤区域
