经鼻蝶显微手术治疗功能性垂体腺瘤的复发危险因素分析*
2019-10-24张明宋锦宁吴媛黄廷钦赵君杰马旭东高李贵
张明,宋锦宁,吴媛,黄廷钦,赵君杰,马旭东,高李贵
(1.西安交通大学第二附属医院 神经外科,陕西 西安 710004;2.西安交通大学第一附属医院 神经外科,陕西 西安 710061;3.西安交通大学第二附属医院重症医学科,陕西 西安 710004)
垂体腺瘤占颅内肿瘤的10%~15%[1],经蝶窦入路切除垂体腺瘤是选择手术治疗患者的第一选择,但鞍上或鞍旁侵犯垂体腺瘤不能全部切除,5年期有12%~58%肿瘤残余患者出现复发,即使肉眼下全部切除,仍有10%~20%的患者在数年后出现复发[2-3]。分泌激素的垂体腺瘤统称为功能性垂体腺瘤(functional pituitary adenomas,FPAs),手术是 FPAs根治的首选方式。本文对经鼻蝶显微手术切除FPAs的患者进行随访,分析导致FPAs复发的危险因素,为提高临床治愈率,降低复发率提供理论依据。
1 资料与方法
1.1 一般资料
回顾性分析2010年10月—2017年10月西安交通大学第一附属医院及西安交通大学第二附属医院共112例经鼻蝶显微手术切除FPAs患者的临床资料,按患者随访结局分为复发组18例和未复发组94例。包括催乳素瘤(Prolactinoma,PRL)、促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)腺瘤、生长激素(growth hormone,GH)腺瘤及促甲状腺激素(thyroid stimulating hormone,TSH)腺瘤等类型。其中,男性48例,女性64例;年龄16~77岁,平均(39.6±15.7)岁。所有患者术前进行完整生物化学检查,包括垂体激素全套检测(GH、三碘甲状腺原氨酸、四碘甲状腺原氨酸、TSH、催乳素、ACTH及晨起皮质醇水平等)。垂体大腺瘤患者在MRI检查发现有视交叉压迫时还应行视力及视野检查。患者基线资料包括手术前后临床症状及体征、手术前后实验室及影像学检查、术中所见、手术效果、并发症、临床结果和术后处理。患者术后3 d内或最迟出院前行鞍区MRI检查,作为术后随访的基线资料。为尽早发现肿瘤是否复发,对术后无症状患者应进行连续性MRI监测,即至少每年或每一年半复查鞍区MRI。若患者出现与肿瘤生长相关的症状或随访中患者激素水平发生改变,需立即行鞍区MRI检查。
1.2 方法
经鼻蝶显微镜下FPAs切除术均经鼻中隔蝶窦入路,术中常规使用手术显微镜,根据情况可辅助使用神经导航。术前根据蝶窦CT三维重建观察蝶窦气化类型、分隔情况及蝶窦与鞍底的关系。分离鼻黏膜时,保持黏膜完整,保持鼻中隔软骨部完整推向一侧,以防止中隔软骨的坏死而出现鼻中隔穿孔。术中始终保持在中线位置上操作,避免损伤颈内动脉,减少肿瘤残留机会。利用高速磨钻磨除鞍底时,避免损伤双侧海绵窦及颈内动脉。鞍底打开后,尽量避免用双极电凝灼烧硬膜,切开鞍底硬膜时可对其行病理检查,以明确肿瘤是否为侵袭性生长。术中保护垂体柄,避免损伤海绵窦、鞍上重要组织及神经、血管。对于性状与正常垂体相似不易判断者,不必强行切除,以免导致术后垂体功能低下。术中镜下全部切除标志:鞍内肿瘤清除、鞍隔下降、鞍底硬膜及鞍隔无肿瘤浸润。对于向鞍上扩展的肿瘤,鞍内肿瘤切除后,可采用辅助呼吸末正压通气或者压迫双侧颈静脉的方式增加颅内压,使鞍上部分塌陷入鞍内,达到全部切除。肿瘤切除后需在瘤腔放置止血材料止血,但不宜过度填塞,肿瘤切除后,若未打开蛛网膜,颅底重建使用患者自身骨组织;若有蛛网膜打开,且有脑脊液流出,则颅底重建需使用患者自体脂肪及筋膜修复鞍底。术后肿瘤组织均经组织病理学切片确定诊断。辅助治疗包括药物及立体定向放射治疗(伽马刀),如患者术后确定有肿瘤残余或为侵袭性FPAs,术后即给予相应辅助治疗。应用医院门诊病历系统联合电话回访收集患者术后复诊情况。
1.3 影像学诊断及复发诊断
所有患者术前经鞍区MRI平扫及强化扫描确定,鞍区MRI动态延迟增强扫描确定垂体微腺瘤。垂体微腺瘤在影像学上定义为最大瘤体直径≤10 mm,垂体大腺瘤定义为最大瘤体直径>10~40 mm,>40 mm定义为垂体大腺瘤。所有患者术前进行蝶窦CT平扫及三维重建或蝶鞍矢状位平片。垂体腺瘤侵入海绵窦是指肿瘤超过颈内动脉外侧连线及肿瘤越过颈内动脉海绵窦段,与Knosp Ⅲ级一致[4]。术后复发定义:根据术后第1次MRI影像学进行比较判断,完全切除垂体腺瘤的患者中发现新发肿瘤,或者术后连续性MRI扫描检查与术后首次MRI扫描检查相比,发现未完全切除肿瘤重新生长的证据,或激素水平正常后再次出现激素分泌升高。MRI影像学检查结果由神经放射学医师及神经外科医师共同判定。
1.4 随访
所有患者术后1个月时来院检测垂体激素水平,并在术后6个月内,每3个月复诊1次;之后2年内每半年复诊1次,或术后若有任何不适随时来院随诊。复诊项目包括普通体检、所有垂体激素项目检测及鞍区MRI检查。本组纳入病例为完成术后随访的FPAs患者,随访时间为术后6~62个月,中位随访时间为术后28.6个月。
1.5 统计学方法
数据分析采用SPSS 19.0统计软件。计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以率(%)表示,比较用χ2检验;等级资料以等级表示,比较用秩和检验;影响因素的分析用多因素Cox回归模型,P<0.05为差异有统计学意义。
2 结果
2.1 临床资料
FPAs患者临床症状最为常见的是溢乳及闭经43例(38.4%),头痛或头晕25例(22.3%),视力及视野障碍32例(28.6%),其他临床表现还包括性功能障碍16例(14.3%),肢端肥大症14例(12.5%),瘤卒中3例(2.7%),Cushing病4例(3.6%)等。术后病理检查显示,FPAs最多的病理学类型是PRL74例(66.1%),其次为GH腺瘤19例(17.0%),其他还包括ACTH腺瘤8例(7.1%),PRL-GH混合腺瘤5例(4.4%),TSH腺瘤3例(2.7%),促性腺素瘤3例(2.7%)。Knosp分级0~Ⅱ级患者96例(85.7%),Knosp分级Ⅲ、Ⅳ级患者16例(14.3%)。78例(69.6%)为首次手术治疗,34例(30.4%)为2次手术。肿瘤直径中位数范围4~41 mm,平均13.3 mm。其中,96例(85.7%)垂体腺瘤为大腺瘤(>10 mm),9例(8.0%)垂体腺瘤为微腺瘤(≤10 mm)。
2.2 术后并发症及处理
术后有7例(6.3%)发生脑脊液鼻漏,其中5例患者经卧床休息等积极保守治疗后约2周治愈,2例患者经鼻蝶再次手术修补颅底后治愈。术后并发尿崩症患者16例(14.3%),其中7例经口服氢氯噻嗪片后治愈,9例经口服醋酸去氨加压素片(弥凝)后治愈,无患者发生永久性尿崩症。术后有4例患者出现垂体功能减退(3.6%),以激素替代治疗≥3个月,无永久性垂体功能减退。本组病例中,15例(13.4%)患者术后肿瘤有残余,其中6例肿瘤残余位于海绵窦内,9例残余位于海绵窦外。术后有1例(0.9%)患者被临床确诊为脑膜炎,经积极抗感染、腰大池持续引流脑脊液及鞘内注射1个月后治愈。另外有1例(0.9%)患者因拔除鼻腔填塞纱条后再次出血,经再次进行鼻腔填塞后治愈。本组病例中无患者发生颈内动脉损伤及深静脉血栓或肺栓塞。在围手术期及后期随访期间,无患者因手术并发症死亡。
2.3 影响 FPAs 术后复发的危险因素
本组共18例(16.1%)FPAs患者术后复发,其中13例为影像学检查证实复发,5例为内分泌检查证实复发。单因素分析结果显示,两组患者术后性别、年龄、肿瘤病理分型及是否首次手术比较,经χ2检验,差异无统计学意义(P>0.05);而Knosp分级、术后肿瘤残留、Ki-67表达情况及辅助治疗比较,差异有统计学意义(P<0.05)。两组患者肿瘤直径比较,经秩和检验,差异有统计学意义(P<0.05);复发组患者术后PRL腺瘤所占比例高于未复发组(P<0.05)。见表1。
2.4 影响FPAs患者术后复发的多因素Cox回归模型
以肿瘤复发时间和结局状态为分析变量,以Knosp分级、肿瘤直径、术后肿瘤残留、Ki-67及辅助治疗为自变量,进行多因素Cox回归分析,变量筛选采用逐步法,α进入=0.05,α剔除=0.10,发现肿瘤直径、术后肿瘤残留及Ki-67等是影响FPAs患者术后复发的独立危险因素(P<0.05)。见表2、3。
2.5 建立判断 FPAs患者复发风险的函数模型
根据多因素Cox回归模型分析结果,拟合判断FPAs患者术后复发的函数,即h(t,X)=h0(t)exp(1.138X3+1.178X4+1.888X5),函数中X3表示肿瘤直径,X4表示术后肿瘤残留,X5表示Ki-67。函数值越大,复发危险性越高;函数值越小,复发危险性越低。

表2 影响FPAs患者术后复发的变量赋值
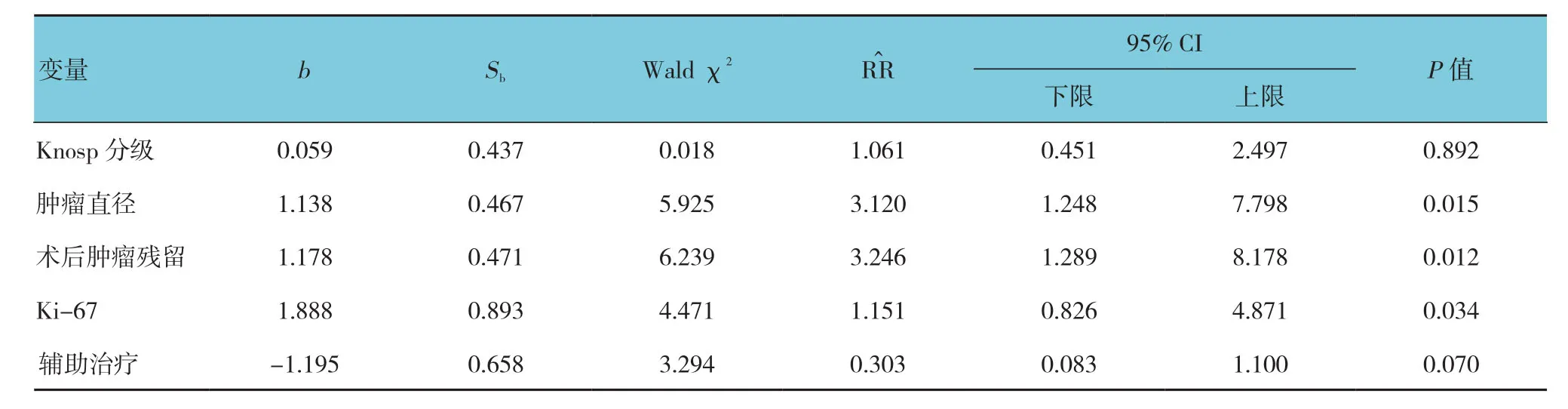
表3 FPAs患者术后复发的多因素Cox回归模型分析参数
3 讨论
经鼻蝶显微手术切除垂体腺瘤目前仍是FPAs首选的治疗方式,目的是生化治愈,保留正常垂体功能及对周围神经结构减压。本组FPAs经鼻蝶术后最常见的并发症为尿崩症及脑脊液漏,发生率分别为14.3%和6.3%,无患者发生永久性尿崩症。经鼻蝶术后发生并发症的危险因素包括高龄、复发肿瘤再次手术等[5],后者是术后并发症的独立危险因素,2次手术并发症率甚至达50%[6]。可能原因是首次手术可沿清晰的解剖间隙分离,而2次手术较难辨识已被纤维组织侵入的解剖间隙,且复发肿瘤与周围组织结构黏连更为紧密。
本组病例经单因素分析发现,Knosp分级、肿瘤直径、术后肿瘤残留、Ki-67表达情况及是否行辅助治疗是与FPAs术后复发相关的危险因素。进一步多因素Cox回归分析发现,肿瘤直径、术后肿瘤残留及Ki-67表达情况是影响FPAs术后复发的独立危险因素。本研究对112例患者随访6~62个月发现,完全手术切除率约为83.9%,术后总体复发率为16.07%。ROELFSEMA等[7]对过去30年的文献进行系统回顾发现,大多随访周期≤10年,肿瘤复发高峰时间1~5年。而是否随随访时间延长,肿瘤复发率继续升高目前暂无定论。
本组病例观察到,有海绵窦侵犯的Knosp Ⅲ、Ⅳ级患者[4,8]或术前MRI影像学检查可见肿瘤侵入蝶窦[9],术中可能残余极少部分肿瘤组织,但术后高分辨率薄层MRI中并不一定能够观察到。为达到生化治愈并避免切除后复发,在术中应识别并切除受到侵袭的鞍膈脑膜。经多因素Cox回归分析显示,Knosp分级不是垂体瘤术后复发的独立危险因素。对于FPAs患者而言,手术效果可达到内分泌水平的临床治愈。本组病例发现,较大肿瘤及肿瘤向海绵窦侵袭可使术后缓解程度降低,这可能是因为肿瘤的某些部分在术中无法完全切除,造成肿瘤部分残余。本组病例中虽然有部分患者术后出现复发,但经再次治疗后仍可获得较好的预后。
FPAs直径较大者(>40 mm)通常具有较高的侵袭性,可突破包膜,向硬膜、海绵窦等结构侵袭,破坏骨质[3]。本组病例多因素Cox回归分析结果亦提示垂体瘤直径与术后复发正相关。肿瘤直径越大,术后复发概率越高。术前肿瘤直径较大者需要定期复诊,复查激素水平的同时复查垂体MRI。发现疑有肿瘤复发迹象时,给予药物干预或放疗等措施,可降低术后复发率,改善患者预后[10]。本研究显示,术后肿瘤残留亦是FPAs复发的独立危险因素[11]。因此,术中尽量减少肿瘤残留,以提高术后缓解率。
本组病例单因素分析结果发现,催乳素瘤是FPAs患者的主要病理类型,但其复发率并未较其他肿瘤类型升高,可能与目前临床中对于催乳素瘤患者可做到早期诊断、早期治疗及药物治疗有效等密切相关。目前临床用于识别具增殖性和侵袭性腺瘤的病理学指标包括垂体腺瘤细胞的Ki-67、有丝分裂活性及p53染色情况[12]。本组研究主要纳入Ki-67作为FPAs增殖活性程度的评价指标,并最终进入回归方程,多因素Cox回归分析结果显示,Ki-67≥3%的FPAs具有较高的增殖活性,这类患者术后更易于复发。
综上所述,肿瘤直径较大、术后肿瘤残余及Ki-67≥3%是影响FPAs术后复发的独立危险因素,而对具有此类特点的肿瘤早期识别是提高FPAs全部切除率及降低术后复发的重要手段。
