慢病毒介导FGFR1沉默对肺癌细胞增殖和凋亡的影响
2019-10-24
(开封市中心医院 心胸外科,河南 开封 475000)
肺癌是常见的恶性肿瘤,发病率居恶性肿瘤的第2位,病死率居首位,对人类健康造成严重威胁,因此探寻早期诊断的特异性指标成为目前肺癌的研究热点[1]。成纤维生长因子受体 1(fibroblast growth factor receptor 1,FGFR1)在乳腺癌、胃癌、肺癌等恶性肿瘤组织中呈高表达,且应用于临床鳞状细胞癌的筛查,在肺癌靶向治疗中具有广阔前景,但具体作用机制尚未完全阐明[2-4]。本研究探讨慢病毒介导FGFR1沉默对肺癌细胞增殖、凋亡的影响,以期为肺癌靶向治疗提供参考。
1 材料与方法
1.1 细胞系
肺癌细胞A549、H3255、A-427购自美国典型菌种保藏中心(ATCC),肾上皮细胞293T购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。
1.2 主要试剂与仪器
慢病毒载体pLVTHM购自武汉淼灵生物科技有限公司,MTT试剂盒购自上海嵘崴达实业有限公司,Trizol、PrimeScriptTMRT Reagent Kit购自大连宝生生物工程有限公司,AnnexinV-FITC/PI细胞凋亡双染试剂盒购自杭州昊鑫生物科技股份有限公司,酶标仪购自美国Molecular Devices公司,BCA检测试剂盒购自北京天根生化科技有限公司,FBS、DMEM购自美国Gibco公司,37℃、5%二氧化碳CO2培养箱购自中国赛默飞世尔科技有限公司(上海),FGFR1单克隆抗体购自武汉艾美捷科技有限公司,β-actin单克隆抗体购自上海西格玛奥德里奇贸易有限公司,IRDye 680RD Donkey Anti-mouse IgG购自美国LI-COR公司,FACScan流式细胞仪购自美国BD公司。
1.3 筛选高表达 FGFR1 mRNA 的肺癌细胞
采用含10% FBS的DMEM完全培养基,在37℃、5% CO2培养箱中培养A549、H3255、A-427肺癌细胞。用Trizol法分别提取细胞总RNA,按照PrimeScriptTMRT Reagent Kit说明书将提取的总 RNA 逆转录为cDNA,用德国 Mastercycler®ep realplex 实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)仪检测 FGFR1 mRNA 的相对表达量。每个反应体系25μl,包括总cDNA 2μl,正反向引物各 1μl,SYBR 12.5μl,无 RNA 酶水补足反应体系至25μl。反应程序采用两步法,退火温度设置为60℃。所有实验重复≥2次,每次设3个生物学重复。以A549做均一化处理,用2-ΔΔCt法计算mRNA相对表达量,筛选出FGFR1 mRNA表达较高的肺癌细胞。FGFR1和内参基因GAPDH引物序列见表1。
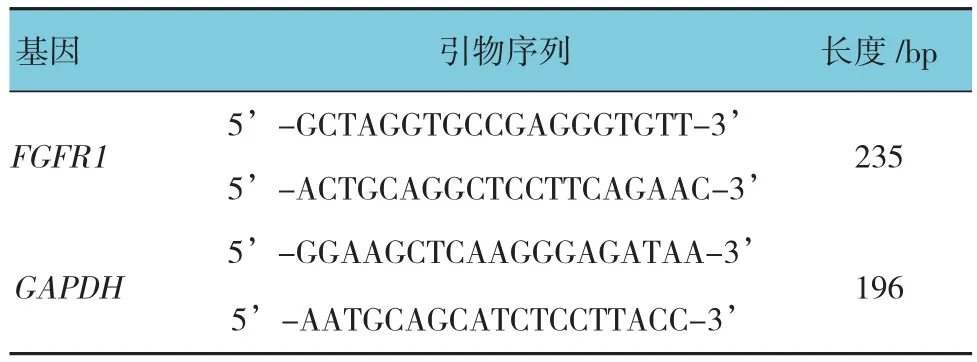
表1 qRT-PCR 引物列表
1.4 慢病毒表达载体 LV-shFGFR1 的构建、包装及病毒颗粒的制备
FGFR1特异性siRNA引物:5’-CGCAAGTAACGT ACCGTAATA-3’,位于FGFR1基因 96~116 bp处,引物由上海生工生物工程股份有限公司合成。限制性内切酶MluⅠ、ClaⅠ双酶切pLVTHM,将目的片段经DNA连接酶插入到酶切过的慢病毒表达载体,将构建好的慢病毒表达载体(LV-shFGFR1)转化至TOP10,筛选阳性克隆。将LV-shFGFR1、空载体分别与辅助包装质粒(pRsv-REV、pMDlg-pRRE、pMD2G)共转染293T细胞,包装干扰病毒颗粒,收毒,滴定至5×109TU/ml。
1.5 实验分组
收集病毒上清,加至A549细胞中,感染复数为10,同时加入病毒感染增强液和聚凝胺(5μg/ml),感染shFGFR1病毒作为干扰组,感染空载体病毒作为空载体组,未进行感染的作为对照组。96 h后用荧光显微镜检测重组慢病毒感染情况。
1.6 细胞检测
1.6.1 qRT-PCR检测 FGFR1 mRNA 提取各组细胞的总 RNA,参照 PrimeScriptTMRT Reagent Kit说明书逆转录总 RNA 为 cDNA,用 Mastercycler®ep realplex qRT-PCR仪检测FGFR1 mRNA相对表达量。每个反应体系20μl,包括总cDNA 2μl,正反向引物各1μl,SYBR 10μl,无 RNA 酶水 6μl。反应程序采用两步法,退火温度设置为60℃。所有实验重复≥2次,每次设3个生物学重复。以对照组做均一化处理,用2-ΔΔCt法计算 mRNA相对表达量。
1.6.2 Westernblotting 检测 FGFR1 蛋白 采用细胞裂解液(含PMSF)裂解各组细胞,8 000 r/min离心15 min,收集上清,放置4℃条件下备用。利用BCA检测试剂盒检测蛋白浓度,具体实验步骤参考说明书。根据检测的蛋白浓度进行半定量,10% SDSPAGE分离蛋白,采用全湿法350 mA转膜90 min,5%脱脂乳室温封闭2 h,PBS缓冲液洗涤5次,3 min/次。一抗即FGFR1单克隆抗体(1∶1 000稀释)或β-actin单克隆抗体(1∶1 000稀释)室温孵育 2.5 h,PBST 洗膜 3次,PBS洗膜 2次,5 min/次。室温条件下避光,荧光二抗(IRDye 680RD Donkey Anti-mouse IgG,1 ∶ 20 000 稀释)孵育 1.5 h,PBST洗膜3次,PBS洗膜2次,高压ddH2O洗涤2次,3 min/次。采用Odyssey®红外成像系统分析蛋白相对表达量。
1.6.3 MTT比色法检测细胞增殖 使用 MTT 测定各组细胞的增殖活力。将细胞按1.0×105个/孔接种至96孔培养板,细胞贴壁后将其分为对照组、空载体组及感染组。对各组细胞采用不同方式处理后继续培养,分别于干扰0、12、24、48和72 h后,加入20μl/孔MTT继续培养,4 h后弃上层溶液,加入1 300μl/孔DMSO,振荡溶解12 min。采用酶标仪测定470 nm处光密度(optical density,OD)值。
1.6.4 流式细胞术检测细胞凋亡将细胞按 1.0×105个/孔接种至96孔培养板中,对各组细胞采用不同方式处理后继续培养48 h,收集细胞,适量PBS缓冲液洗涤3次,75%预冷乙醇保存,4℃过夜。PBS洗涤 3次,37℃条件下 20μl RNA 酶孵育细胞 20 min,避光条件下20μl碘化丙啶(propidium iodide,PI)染色,4℃孵育30 min。采用FACScan流式细胞仪对细胞进行分析,利用ModFit LT细胞周期分析软件对凋亡细胞进行统计。
1.6.5 Hoechest染色检测细胞凋亡将细胞按1.0×105个/孔接种于含有飞片的24孔板中,培养48 h,弃上清,PBS缓慢洗涤 3次,每孔加入 2 ml 4%多聚甲醛固定液室温固定30 min,弃固定液,PBS缓慢洗涤3次,6 min/次,超净台中风干。避光条件下于飞片中央滴加 200μl Hoechest 33258 工作液,室温染色20 min,PBS轻柔洗去染色液,洗涤3次,6 min/次,用镊子小心取出飞片,滤纸小心吸去飞片多余液体,自然风干飞片,于干净载玻片上滴加抗荧光猝灭剂1滴,于飞片细胞一侧小心放置于滴加有抗荧光猝灭剂的位置上进行封片,封片后利用荧光显微镜进行观察。
1.7 统计学方法
数据分析采用SPSS 17.0统计软件。计量资料以均数±标准差(±s)表示,比较用单因素方差分析或重复测量设计的方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 A549 细胞中 FGFR1 mRNA 呈高表达
A549、H3255、A-427细 胞 中 FGFR1 mRNA 的相对表达量分别为(1.11±0.06)、(0.62±0.04)和(0.71±0.02),经单因素方差分析,差异有统计学意义(F=109.339,P=0.000);A549细胞高于H3255和A-427细胞(P<0.05)。见图1。
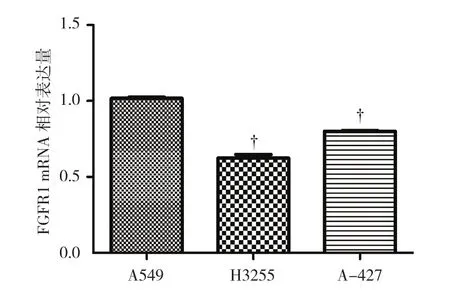
图1 3 种肺癌细胞中 FGFR1 mRNA 相对表达量比较(±s)
2.2 慢病毒稳定感染 A549 细胞
感染96 h后,荧光显微镜检测病毒感染A549细胞情况显示,空载体组和干扰组细胞绿色荧光蛋白阳性率均>90%,表明重组慢病毒对A549细胞有较好的亲嗜性。见图2。

图2 A549 细胞病毒感染情况(×100)
2.3 干 扰组A549 细胞 中 FGFR1 mRNA 表达下调
以β-actin为内参基因,对照组、空载体组、干扰组A549细胞中FGFR1 mRNA相对表达量分别为(1.09±0.12)、(1.07±0.10)和(0.21±0.03),经单因素方差分析,差异有统计学意义(F=89.787,P=0.000);空载体组与对照组比较,差异无统计学意义(P>0.05);干扰组低于对照组(P<0.05)。见图3。
2.4 干扰组细胞中 FGFR1 蛋白表达下降

图3 各组FGFR1 mRNA 相对表达量比较(±s)
以GAPDH作为内参,对照组、空载体组、干扰组A549细胞中FGFR1蛋白相对表达量分别为(0.42±0.09)、(0.39±0.07) 和(0.08±0.01), 经单因素方差分析,差异有统计学意义(F=24.344,P=0.001);空载体组与对照组比较,差异无统计学意义(P>0.05);干扰组低于对照组(P<0.05)。见图4。
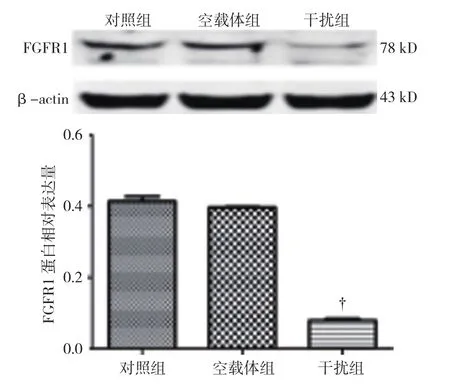
图4 各组FGFR1 蛋白相对表达量比较(±s)
2.5 各组细胞增殖情况
干扰组、空载体组、对照组0、12、24、48和72 h的细胞增殖情况比较,采用重复测量设计的方差分析,结果:①不同时间点细胞增殖情况比较,差异有统计学意义(F=75.321,P=0.000);②3组细胞增殖情况比较,差异有统计学意义(F=68.364,P=0.000);③ 3组细胞增殖情况随时间变化趋势有差异(F=91.637,P=0.000)。见表2和图5。
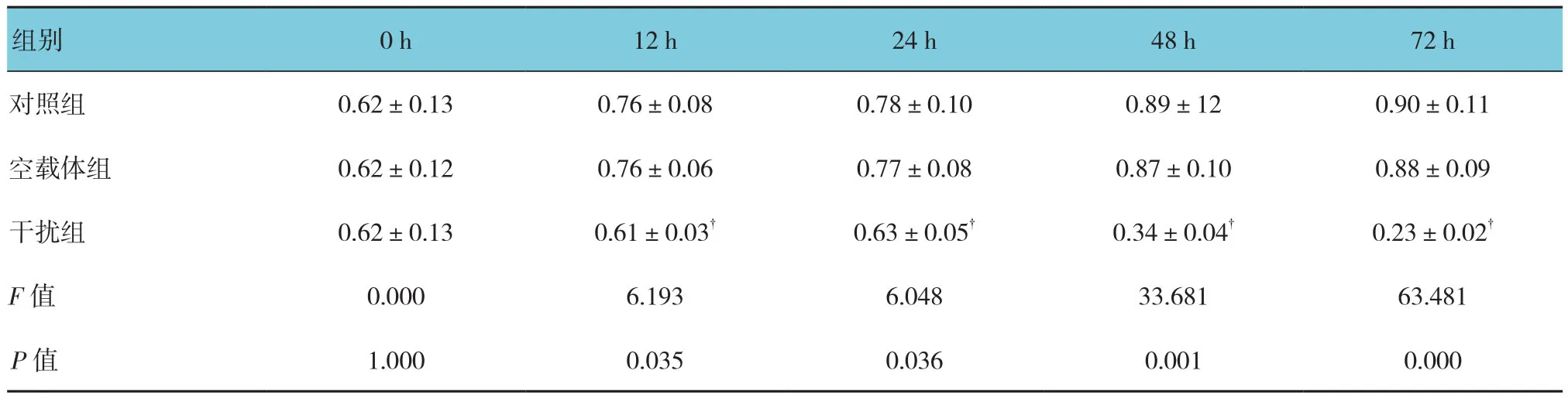
表2 各组细胞不同时间点的OD值比较

图5 各组细胞 OD 值变化趋势(±s)
2.6 干扰组细胞凋亡率上升
经Hoechest染色显示,对照组细胞凋亡率为(17.2±1.32)%,空载体组为(17.3±1.24)%,干扰组为(25.32±2.14)%,经单因素方差分析,差异有统计学意义(F=66.296,P=0.000);空载体组与对照组比较,差异无统计学意义(P>0.05);干扰组高于对照组和空载体组(P<0.05)。Hoechest染色检测细胞凋亡结果与流式细胞术检测结果一致。见图6~8。

图6 流式细胞凋亡图

图7 各组细胞凋亡情况(Hoechest染色×400)
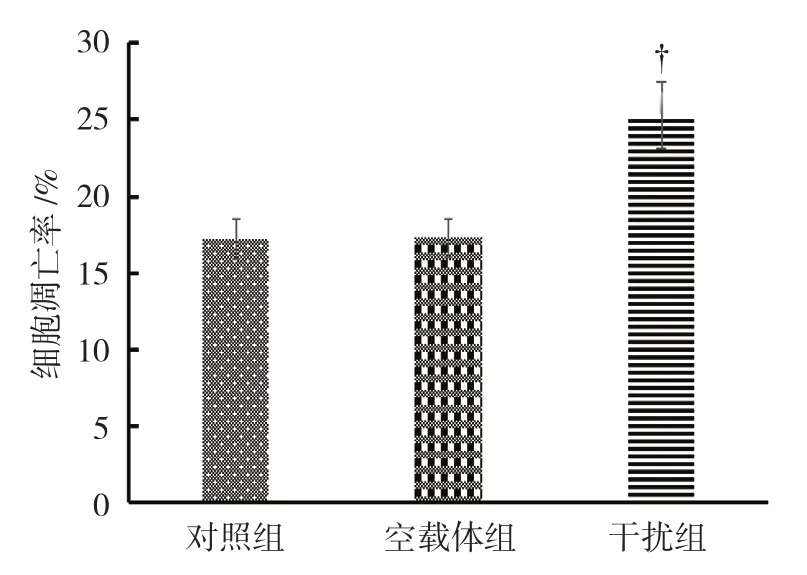
图8 各组细胞凋亡率比较(±s)
3 讨论
肺癌是目前世界范围内病死率最高的疾病[5]。肺癌分为小细胞肺癌和非小细胞肺癌,其中非小细胞肺癌所占比例较大[6]。小细胞肺癌具有发展迅速、转移较快和侵袭力强等特点,小细胞肺癌初治时较易获得良好的疗效,但后期治疗极易对药物产生耐药性,出现癌症复发和转移[7]。非小细胞肺癌具有癌细胞增长缓慢,且转移、扩散较晚等特点[8]。通常非小细胞肺癌患者不易被察觉,经常发现时已处于中、晚期,也因此导致非小细胞肺癌患者病死率居高不下[9]。肺癌受许多因素调控,机制极其复杂,其中包括一些基因结构及表达发生变化等[10-13]。
FGFR1基因编码的蛋白为酪氨酸激酶受体,是一个跨膜蛋白,成纤维生长因子受体可与FGFR1蛋白细胞外区域结合,导致FGFR1蛋白结构改变和细胞内区域发生磷酸化,从而活化STAT、Rap1、MAPK和PI3K-Akt等信号通路[14]。随着对FGFR1研究的不断深入,其在肿瘤发生、发展过程中的作用也越来越不容忽视。相关研究发现,在肿瘤组织中FGFR1相对表达量显著高于癌旁正常组织,由此说明FGFR1为癌症相关基因[15]。由于常用的放化疗在肺癌治疗上有生存率低和预后效果不理想等缺点,人们迫切需要一种新的治疗方法来弥补放化疗的不足,因此分子靶向治疗走进了人们的视线,并随着研究的不断深入,目前分子靶向治疗药物已进入临床应用,例如以EGFR为靶点的易瑞沙和特罗凯便属于该类药物[16-17]。本研究利用肺癌细胞系,阐明慢病毒介导FGFR1沉默对肺癌细胞增殖和凋亡的影响,为肺癌分子靶向治疗的研究提供实验基础。
本实验采用qRT-PCR检测各组FGFR1 mRNA相对表达量,结果显示,A549细胞中FGFR1 mRNA相对表达量高于H3255和A-427细胞,因此本研究通过慢病毒介导抑制FGFR1表达来探讨FGFR1对A549肺癌细胞增殖和凋亡的影响。siRNA是一种短片段dsRNA,能够利用慢病毒载体对siRNA进行介导,在核酸内切酶作用下,降解同源互补的mRNA,从而导致目的基因无法变大,呈现抑制状态[18]。本研究结果显示,干扰组FGFR1 mRNA相对表达量较对照组下调,表明慢病毒表达质粒能够干扰FGFR1基因的转录。采用Western blotting检测各组FGFR1蛋白相对表达量,结果显示,干扰组FGFR1蛋白相对表达量较对照组下调,进一步验证慢病毒表达质粒能够干扰FGFR1蛋白的表达。Western blotting检测结果与实时荧光定量检测结果一致,表明无论是在转录水平还是在翻译水平上,干扰组FGFR1 mRNA和蛋白相对表达量均表现为下调。过往研究表明,当FGFR1表达受到抑制时可有效抑制胃癌细胞增殖[19]。本研究通过MTT比色法发现,与对照组相比,干扰组中细胞增殖率下降,说明慢病毒介导的FGFR1基因沉默能够抑制肺癌细胞的增殖,与过往相关研究一致[19],表明在肺癌细胞中FGFR1相对表达量下调也能有效抑制癌细胞增殖。相关研究表明,在卵巢癌中FGFR1相对表达量下调可促进细胞凋亡,增加对药物的敏感性[20]。本研究中FGFR1细胞凋亡结果显示,干扰组细胞凋亡率高于对照组,表明慢病毒介导的FGFR1基因沉默能够促进肺癌细胞的凋亡,与过往其他癌症研究结果一致[20]。本研究通过对照组与空载体组的对比,可以排除慢病毒载体本身对FGFR1表达产生影响的干扰。
综上所述,慢病毒介导的FGFR1沉默,显著抑制FGFR1表达,从而抑制肺癌细胞增殖,同时促进肺癌细胞的凋亡。提示FGFR1可能参与肺癌细胞的发生、发展过程,同时也说明FGFR1有潜力成为新的药物分子靶标,但还需对其进一步验证,本研究结果为肺癌基因治疗提供新的实验基础。
