低铅染毒促进非酒精性脂肪性肝病大鼠Hcy升高的分子机制研究*
2019-10-24朱为梅张静思杨红玲华鹏徐丽芬
朱为梅,张静思,杨红玲,华鹏,徐丽芬
(1.云南省第三人民医院,云南 昆明 650011;2.云南省老干部医院,云南 昆明 650034)
当前重金属污染已经成为影响人民群众健康的一大病因[1-2]。2016年云南省第三人民医院对云南省某重工业城市进行了大范围铅中毒和非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)流行病学调查,发现当地慢性铅中毒广泛流行,同时铅中毒NAFLD患者血清同型半胱氨酸(Homocysteine,Hcy)相对无铅中毒NAFLD患者明显升高[3]。因此笔者推测在NAFLD发生和发展过程中,铅可能会损伤Hcy代谢酶,最终造成血清Hcy升高。为此本研究从Hcy合成和分解途径考查铅中毒对NAFLD大鼠的影响,为今后铅中毒和NAFLD的治疗提供一定的理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物和饲养条件无特定病原体级 SD 大鼠40只,体重160~180 g,雌雄各半,均购于昆明医科大学动物实验中心(动物合格证号:2011-007),购买后饲养于标准小动物饲养房,饲养温度控制在18~26℃,湿度控制在55%~65%,光照和黑暗条件下各12 h,实验经本院医学伦理委员会审核通过(审批号 R-082018044)。
1.1.2 实验材料普通和高脂饲料、垫料(昆明医科大学动物实验中心),Hcy检测试剂盒(武汉博士德生物工程有限公司),醋酸铅(武汉博士德生物公司),铅测定试剂盒(北京汇智泰康生物技术有限公司),白细胞介素 -1α(Interleukin-1α,IL-1α)和白细胞介素-1β(Interleukin-1β,IL-1β) 试 剂盒(武汉博士德生物工程有限公司),白细胞介素-6(Interleukin-6,IL-6)和肿瘤坏死因子 -α(tumor necrosis factor-α,TNF-α)试剂盒(南京森贝伽生物科技有限公司),MTHFR、MTR、CBS和β-肌动蛋白(β-actin)抗体(美国Santa公司),二抗(北京中山金桥公司),总RNA提取试剂盒(北京天根生化科技有限公司),引物(上海生工生物工程股份有限公司)。
1.1.3 实验仪器可见光分光光度计(722-S 型,上海光学仪器厂),电子分析天平(FA1004型,上海光学仪器一厂),自动脱水机(ASP-300S型,德国Leica公司),台式高速冷冻离心机(5427R型,德国Eppendorf公司),手动切片机(KM2245型,德国Leica公司),生物组织包埋机(BMJ-1型,上海珂淮仪器有限公司),生物摄影显微镜(Eclipse E200型,日本Nikon公司),全自动生化分析仪(C8008型,美国雅培公司)。
1.2 方法
1.2.1 动物分组及处理所有大鼠在购买后给予适应性喂养2周,然后按照随机数字表法将其分为普通饲料组、低铅染毒普通饲料组(0.3 g/kg含醋酸铅普通饲料)、高脂饲料组及低铅染毒高脂饲料组(0.3 g/kg含醋酸铅高脂饲料,剂量的确定根据参考文献[4]报道的最低剂量),每组10只[4]。标准饲养条件下饲养8周后处死所有大鼠。
1.2.2 标本采集大鼠分批次隔夜禁食 12 h,于次日采用4%水合氯醛3 ml/(kg·d)麻醉处死,将其固定于解剖板,采用心脏取血法收集血液,取5 ml置于抗凝管中交由本院检验科检测,其余血液4 000 r/min离心10 min收集上清,备用于相关生化指标检测。收集血液后,取出肝脏,统一切取肝左叶置于4%甲醛溶液中用于病理学检测,其余肝脏切成4小块,其中1小块置入冻存管中备用于RNA检测,其余直接放入超低温冰箱中用于Western blotting和肝铅检测。
1.3 观察指标
1.3.1 血清指标血清肝功能指标谷草转氨酶(aspartate transaminase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、Hcy、叶酸及维生素 B12的测定采用全自动生化分析仪,血铅和肝铅的测定仪器为分光光度计,IL-1α、IL-1β、IL-6和TNF-α的检测仪器为全自动生化分析仪。血铅、肝铅、IL-1α、IL-1β、IL-6和TNF-α的测定严格按照试剂盒说明书进行。
1.3.2 肝脏组织病理学肝脏组织病理学检查采用苏木精 - 伊红(hematoxylin-eosin staining,HE)染色,其步骤按照常规方法进行:从中性甲醛溶液中取出肝脏组织,自来水过夜冲洗,梯度酒精脱水,二甲苯透明,石蜡包埋、切片[5]。
1.3.3 Westernblotting蛋白表达采用Western blotting检测,从超低温冰箱中取出肝脏组织,每组精确称取100 mg,用组织裂解液裂解后离心并收集上清,BCA法检测蛋白浓度并定量,每组各取50μg行SDS-PAGE,电泳完成后半干转移法转移到PVDF,5%脱脂牛奶封闭2 h后洗涤3次,加入一抗[MTR(1 ∶ 2 000)、CBS(1 ∶ 3 000)、MTHFR(1 ∶ 3 000)和β-actin(1∶ 5 000)], 摇床摇动30 min后 置于4℃冰箱中过夜,次日取出后洗涤3次,加入二抗(l∶5 000)孵育1 h,洗涤3次,暗室曝光压片。采用扫描仪收集图像,Image J软件计算并分析条带灰度,每组实验重复3次。
1.3.4 实时荧光定量聚合酶链反应(quantitative realtime polymerase chain reaction,qRT-PCR)采用天根总RNA提取试剂盒提取总RNA,定量并调平,逆转录为cDNA后进行扩增,反应条件:95℃预变性10 s,95℃变性 5 s,60℃退火 31 s,共40个循环。采用 2-ΔΔCt法测定并分析各组大鼠MTR、CBS和MTHFR mRNA相对表达量。见表1。

表1 qRT-PCR 引物序列
1.4 统计学方法
数据分析采用SPSS 20.0统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肝脏病理学
普通饲料组和低铅染毒普通饲料组肝脏切片表面光滑,肝细胞排列紧密,而高脂饮食组和低铅染毒高脂饲料组则出现明显脂肪空泡,此外也有一定的炎症因子浸润,特别是低铅染毒高脂饲料组,脂肪空泡更大且数量更多。见图1。

图1 各组大鼠肝脏组织病理切片(×400)
2.2 各组大鼠血铅和肝铅比较
各组大鼠血铅和肝铅含量比较,经单因素方差分析,差异有统计学意义(P<0.05)。低铅染毒普通饲料组和低铅染毒高脂饲料组均高于普通饲料组(P<0.05),低铅染毒高脂饲料组高于低铅染毒普通饲料组和高脂饲料组(P<0.05)。见表2。
表2 各组大鼠血铅和肝铅比较(n =10,μg/ml,±s)

表2 各组大鼠血铅和肝铅比较(n =10,μg/ml,±s)
注:①与普通饲料组比较,P <0.05;②与低铅染毒普通饲料组,P <0.05;③与高脂饲料组比较,P <0.05。
组别 血铅 肝铅普通饲料组0.11±0.04 0.88±0.37低铅染毒普通饲料组0.25±0.09① 2.42±0.87①高脂饲料组0.13±0.10 0.95±0.43低铅染毒高脂饲料组0.32±0.12①②③ 3.22±1.19①②③F值 37.792 21.458 P值 0.000 0.000
2.3 各组大鼠 AST、ALT 比较
各组大鼠AST、ALT比较,经单因素方差分析,差异有统计学意义(P<0.05)。低铅染毒普通饲料组、高脂饲料组和低铅染毒高脂饲料组均高于普通饲料组(P<0.05),高脂饲料组和低铅染毒高脂饲料组高于低铅染毒普通饲料组(P<0.05),低铅染毒高脂饲料组高于高脂饲料组(P<0.05)。见表3。
表3 各组大鼠 AST、ALT 比较(n =10,u/L,±s)

表3 各组大鼠 AST、ALT 比较(n =10,u/L,±s)
注:①与普通饲料组比较,P <0.05;②与低铅染毒普通饲料组,P <0.05;③与高脂饲料组比较,P <0.05。
组别 ALT AST普通饲料组72.85±4.35 153.14±9.40低铅染毒普通饲料组81.17±8.33① 171.43±12.27①高脂饲料组97.24±9.98①② 195.15±17.82①②低铅染毒高脂饲料组118.75±18.34①②③ 233.19±19.16①②③F值 35.791 24.422 P值 0.000 0.000
2.4 各组大鼠血清 Hcy、叶酸及维生素 B12 比较
各组大鼠Hcy、叶酸及维生素B12比较,经单因素方差分析,差异有统计学意义(P<0.05)。高脂饲料组和低铅染毒高脂饲料组Hcy高于普通饲料组和低铅染毒普通饲料组(P<0.05),叶酸和维生素B12低于普通饲料组和低铅染毒普通饲料组(P<0.05);低铅染毒高脂饲料组Hcy高于高脂饲料组(P<0.05),叶酸和维生素B12低于高脂饲料组(P<0.05)。见表4。
表4 各组大鼠 Hcy、叶酸及维生素 B12 比较(n =10,±s)
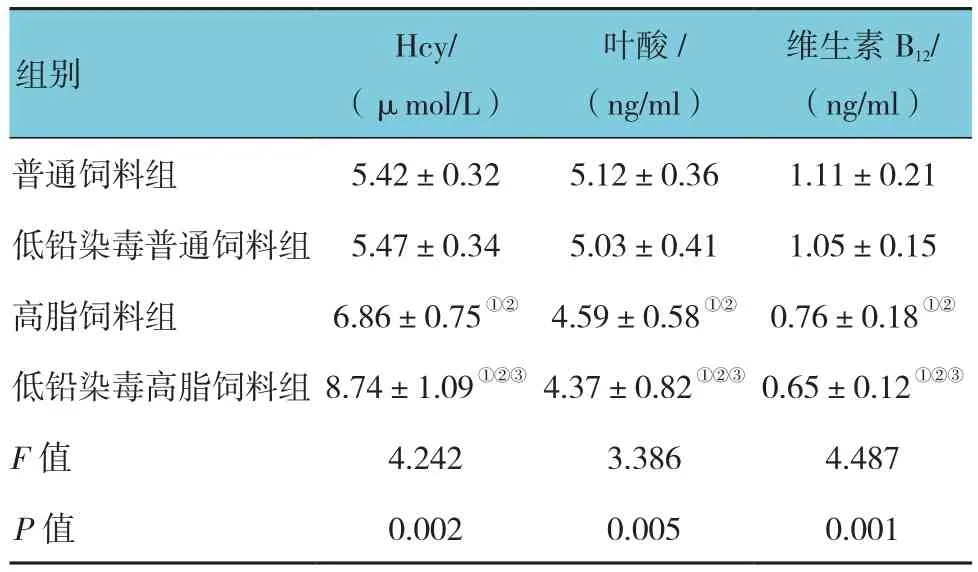
表4 各组大鼠 Hcy、叶酸及维生素 B12 比较(n =10,±s)
注:①与普通饲料组比较,P <0.05;②与低铅染毒普通饲料组,P <0.05;③与高脂饲料组比较,P <0.05。
维生素B12/(ng/ml)普通饲料组5.42±0.32 5.12±0.36 1.11±0.21低铅染毒普通饲料组5.47±0.34 5.03±0.41 1.05±0.15高脂饲料组6.86±0.75①② 4.59±0.58①② 0.76±0.18①②低铅染毒高脂饲料组8.74±1.09①②③ 4.37±0.82①②③ 0.65±0.12①②③F值 4.242 3.386 4.487 P值 0.002 0.005 0.001组别 Hcy/(μmol/L)叶酸/(ng/ml)
2.5 各组大鼠炎症因子比较
各组大鼠IL-1α、IL-1β、IL-6及TNF-α比较,经单因素方差分析,差异有统计学意义(P<0.05)。高脂饲料组和低铅染毒高脂饲料组均高于普通饲料组和低铅染毒普通饲料组(P<0.05),低铅染毒高脂饲料组高于高脂饲料组(P<0.05)。见表5。
表5 各组大鼠血清炎症因子比较(n =10,ng/ml,±s)
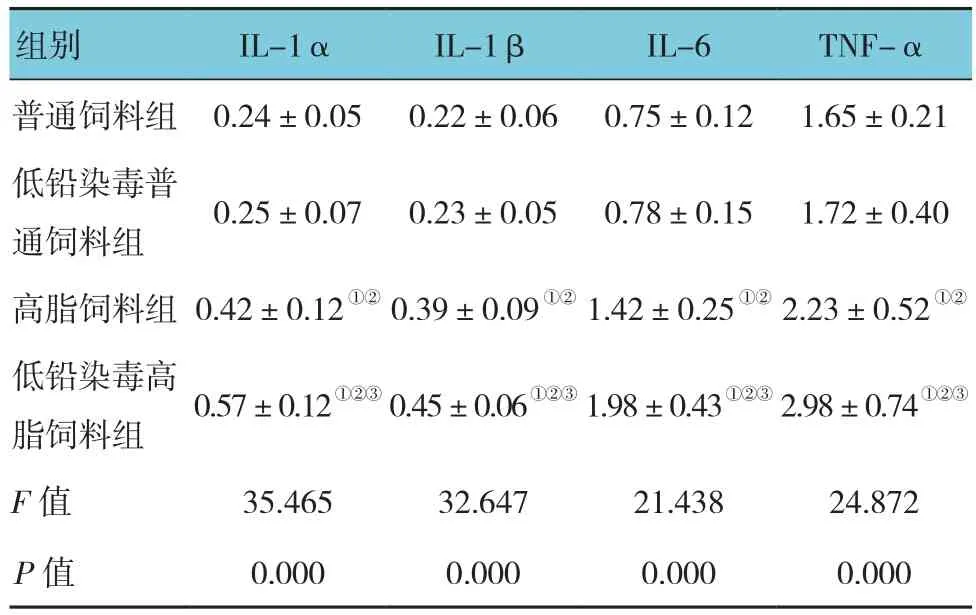
表5 各组大鼠血清炎症因子比较(n =10,ng/ml,±s)
注:①与普通饲料组比较,P <0.05;②与低铅染毒普通饲料组,P <0.05;③与高脂饲料组比较,P <0.05。
组别 IL-1α IL-1β IL-6 TNF-α普通饲料组0.24±0.05 0.22±0.06 0.75±0.12 1.65±0.21低铅染毒普通饲料组0.25±0.07 0.23±0.05 0.78±0.15 1.72±0.40高脂饲料组0.42±0.12①② 0.39±0.09①② 1.42±0.25①② 2.23±0.52①②低铅染毒高脂饲料组0.57±0.12①②③ 0.45±0.06①②③ 1.98±0.43①②③ 2.98±0.74①②③F值 35.465 32.647 21.438 24.872 P值 0.000 0.000 0.000 0.000
2.6 各组大鼠肝脏中MTHFR、MTR 及CBS蛋白相对表达量比较
各组肝脏中MTR、CBS蛋白相对表达量比较,差异无统计学意义(P>0.05)。各组大鼠肝脏中MTHFR蛋白相对表达量比较,经单因素方差分析,差异有统计学意义(P<0.05);高脂饲料组和低铅染毒高脂饲料组低于普通饲料组(P<0.05),低铅染毒高脂饲料组低于高脂饲料组(P<0.05);低铅染毒普通饲料组与普通饲料组MTHFR蛋白相对表达量比较,差异无统计学意义(P>0.05)。见表6和图2。
表6 各组大鼠肝脏中 MTHFR、MTR 及 CBS 蛋白相对表达量比较(n =10,±s)

表6 各组大鼠肝脏中 MTHFR、MTR 及 CBS 蛋白相对表达量比较(n =10,±s)
注:①与普通饲料组比较,P <0.05;②与低铅染毒普通饲料组,P <0.05;③与高脂饲料组比较,P <0.05。
MTHFR MTR CBS普通饲料组0.52±0.08 0.63±0.06 0.55±0.04低铅染毒普通饲料组0.57±0.06 0.65±0.04 0.56±0.05高脂饲料组0.36±0.07①② 0.61±0.07 0.58±0.07低铅染毒高脂饲料组0.23±0.09①②③ 0.64±0.06 0.59±0.05 F值 22.385 1.476 1.886 P值 0.000 0.105 0.102组别
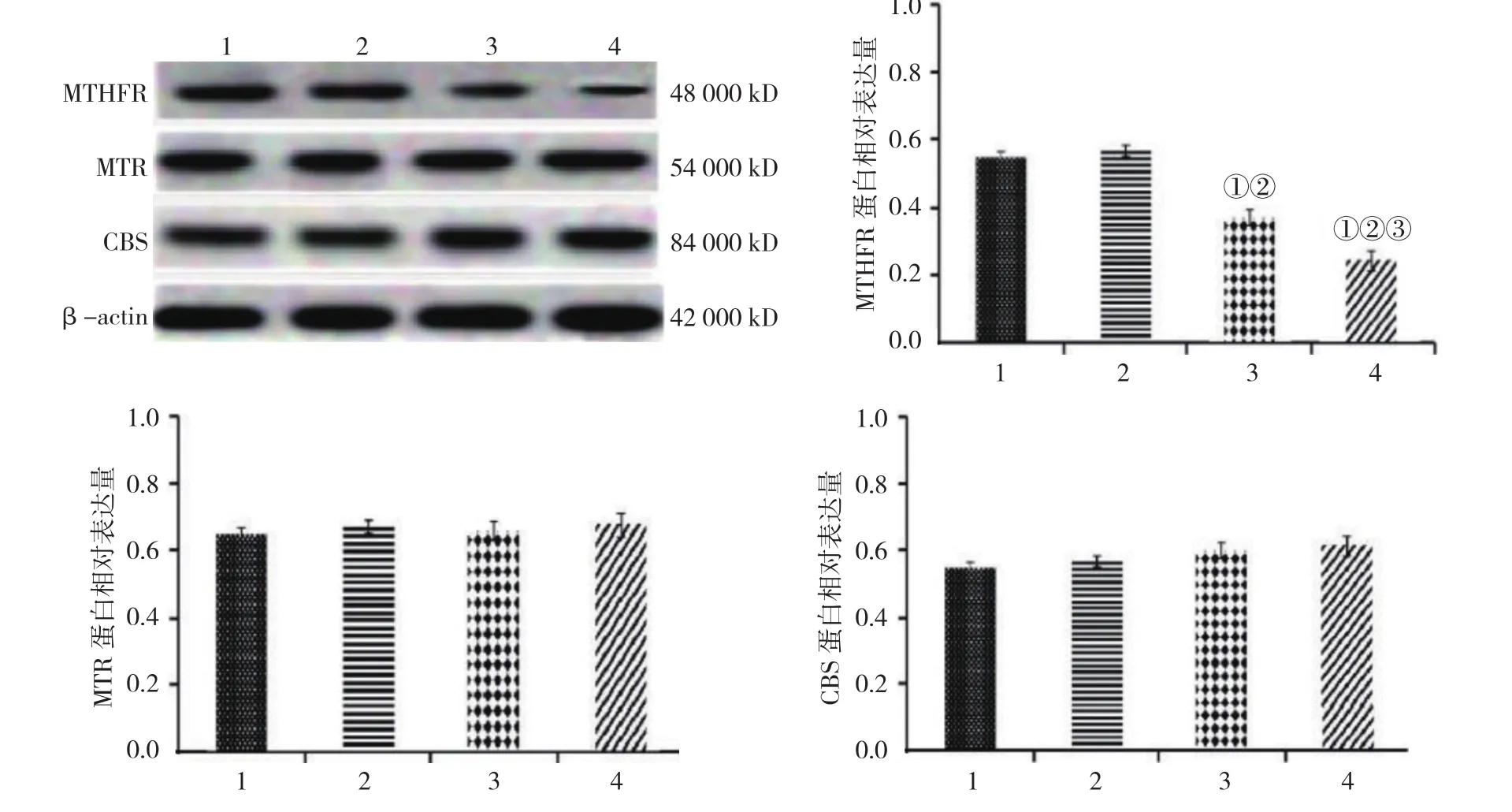
图2 各组大鼠肝脏中 MTHFR、MTR 及 CBS 蛋白相对表达量比较(n =10,±s)
2.7 各组大鼠肝脏中 MTHFR、MTR 及 CBS mRNA相对表达量比较
各组肝脏中MTR、CBS mRNA相对表达量比较,差异无统计学意义(P>0.05)。各组大鼠肝脏中MTHFR mRNA相对表达量比较,经单因素方差分析,差异有统计学意义(P<0.05);高脂饲料组和低铅染毒高脂饲料组低于普通饲料组(P<0.05),低铅染毒高脂饲料组低于高脂饲料组(P<0.05);低铅染毒普通饲料组和普通饲料组MTHFR mRNA相对表达量比较,差异无统计学意义(P>0.05)。见表7和图3。
表7 各组大鼠肝脏中 MTHFR、MTR 及 CBS mRNA 相对表达量比较(n =10,±s)
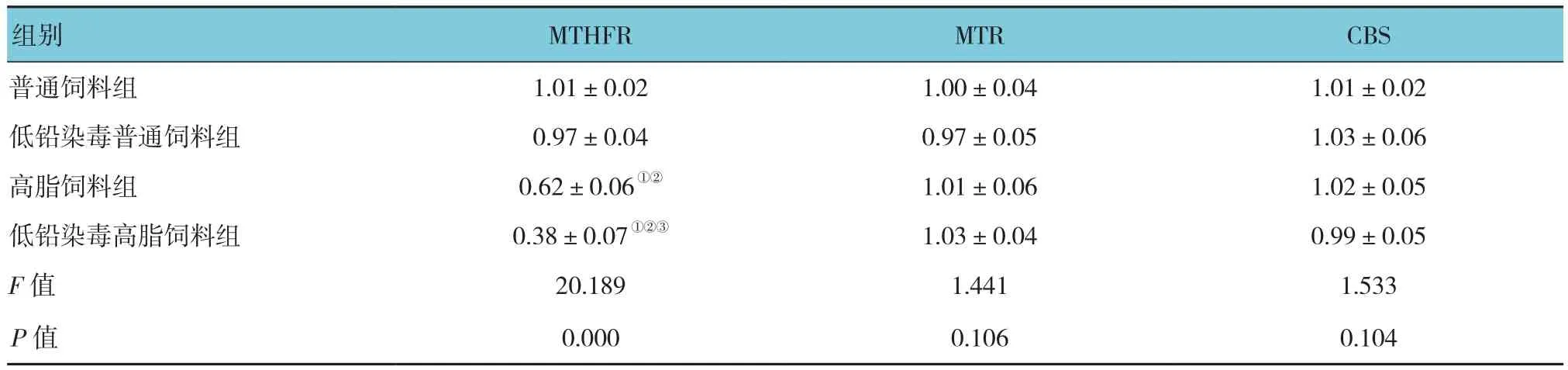
表7 各组大鼠肝脏中 MTHFR、MTR 及 CBS mRNA 相对表达量比较(n =10,±s)
注:①与普通饲料组比较,P <0.05;②与低铅染毒普通饲料组,P <0.05;③与高脂饲料组比较,P <0.05。
MTHFR MTR CBS普通饲料组1.01±0.02 1.00±0.04 1.01±0.02低铅染毒普通饲料组0.97±0.04 0.97±0.05 1.03±0.06高脂饲料组0.62±0.06①② 1.01±0.06 1.02±0.05低铅染毒高脂饲料组0.38±0.07①②③ 1.03±0.04 0.99±0.05 F值 20.189 1.441 1.533 P值 0.000 0.106 0.104组别

图3 各组大鼠肝脏中 MTHFR、MTR 及 CBS mRNA 相对表达量比较(n =10,±s)
3 讨论
近年来国内外对铅中毒进行了大量的流行病学研究[2]。以我国为例,2009年以来铅中毒特别是慢性铅中毒呈高发态势[6-7]。急性铅中毒患者主要集中于铅矿工作人员,而普通人群中多数为慢性铅中毒,且发病人数更多、更广。慢性铅中毒患者与正常人群在多种疾病的发生率上没有明显差异,但是对于有基础疾病的慢性铅中毒患者血清多项指标则明显高于正常人群,而Hcy则是一个差异指标。铅中毒的脂肪肝患者血清Hcy较无铅中毒的脂肪肝患者明显升高。而Hcy的升高与患者代谢密切相关。
Hcy在体内的生成和分解主要通过MTHFR、MTR和CBS 3种酶来进行,首先为转硫基途径,调节酶蛋白为CBS,CBS可催化Hcy和丝氨酸缩合生成胱硫醚,胱硫醚进一步可生成谷胱甘肽以提高机体抗氧化能力[8-11]。另一条途径为调节蛋白酶为MTR和MTHFR,在MTR的催化下Hcy和甲基四氢叶酸可生成蛋氨酸和四氢叶酸,蛋氨酸可直接被人体利用,而四氢叶酸则在MTHFR催化下重新生成甲基四氢叶酸。本研究显示,各组MTR和CBS表达没有差异,此外普通饲料组与低铅染毒普通饲料组MTHFR表达无差异,而高脂饲料组和低铅染毒高脂饲料组MTHFR表达低于普通饲料组,同时低铅染毒高脂饲料组也明显低于高脂饲料组,这提示在大鼠摄入高脂饲料的同时给予低铅染毒可以造成大鼠Hcy升高,其升高与MTHFR的表达异常相关。
肝细胞的炎症状态与CBS、MTR和MTHFR有直接关系[11]。在肝脏炎症发生的过程中,TNF-α是直接调控因子,TNF-α可直接活化IL-1α和IL-1β,此外TNF-α可激活肝脏Kupffer细胞,促进IL-6释放[12]。肝脏炎症反应发生后,可反作用刺激肝脏细胞,进而诱发Hcy代谢酶分泌异常,最终导致Hcy升高[13]。本研究结果显示,相较于普通饲料组,低铅染毒普通饲料组大鼠血清中IL-1α、IL-1β、IL-6和TNF-α并没有明显升高。而与普通饲料组和低铅染毒普通饲料组相比,高脂饲料组和低铅染毒高脂饲料组IL-1α、IL-1β、IL-6和TNF-α明显升高。相较于高脂饲料组,低铅染毒高脂饲料组IL-1α、IL-1β、IL-6和TNF-α明显升高,这提示低铅染毒不会对正常大鼠炎症因子和血清Hcy升高有促进作用,而在肝脏损伤后,则会明显升高Hcy和炎症反应。
综上所述,低铅染毒对NAFLD大鼠Hcy升高有明显促进作用,这与低铅摄入可增加肝脏炎症反应,降低肝脏中MTHFR表达有关。
