淋巴细胞/单核细胞比值对宫颈癌患者的预后价值研究*
2019-10-24
(成都市第五人民医院 肿瘤科,四川 成都 611130)
2018年全世界约有569 847例新发宫颈癌患者,311 365例患者死于宫颈癌[1]。宫颈癌复发是其治疗失败的主要原因,因此寻找独立的预后因素不仅可预测复发的风险,而且有助于指导临床个性化治疗,从而提高患者的生存预后。炎症与宫颈癌的发生、发展、侵袭及转移密切相关[2]。淋巴细胞/单核细胞比值(lymphocyte/monocyte ratio,LMR)作为肿瘤相关炎症指标,已被证实是多种恶性肿瘤患者的独立预后因素[3]。因此,本研究旨在分析LMR在宫颈癌患者中的潜在预后价值。
1 资料与方法
1.1 一般资料
选取2005年1月—2009年12月成都市第五人民医院收治的254例初诊宫颈癌患者的临床病理资料,所有患者经宫颈活检或手术病理确诊为宫颈癌,平均年龄46岁(30~75岁)。其中,Ⅰ期114例,Ⅱ期94例,Ⅲ期27例,Ⅳ期19例;宫颈鳞状细胞癌94.9%(241例),宫颈腺癌5.1%(13例)。以宫颈癌患者总生存时间(overall survival,OS)为终点,ROC 曲线计算LMR最佳临界值为2.01,其敏感性、特异性和曲线下面积分别为71.2%、79.7%和0.775(见图1)。根据LMR最佳临界值,将宫颈癌患者分为高LMR组(>2.01)177例和低LMR组(≤2.01)77例。临床资料包括患者年龄、肿瘤分期(参照2014版国际妇产科联盟FIGO分期标准)、病理类型、组织学分级、淋巴脉管浸润、淋巴结转移、间质浸润深度及外周血指标等。排除合并急性或慢性炎症感染、围手术期死亡、严重肝肾功能损害、自身免疫性疾病、血栓和出血性疾病、存在第二肿瘤、曾经接受抗肿瘤治疗及临床资料收集不全的患者。
1.2 方法
采用真空采血法采集所有宫颈癌患者诊断前24 h的清晨空腹静脉血,于其肘静脉抽取2 ml静脉血加入到乙二胺四乙酸二钾抗凝管中、混匀。采用北京中西远大科技有限公司JHF7-3000型血常规检测仪进行检测,检测指标包括血红蛋白、嗜酸性粒细胞、淋巴细胞及单核细胞。根据患者诊断前淋巴细胞及单核细胞数量,计算LMR。

图1 宫颈癌患者诊断前LMR水平的ROC曲线
1.3 随访情况
前2年每3个月随访1次,接下来连续5年每6个月随访1次,随后每1年随访1次,随访时间截止至2016年1月。随访期间进行妇科检查,实验室检查和影像检查(心腹部超声扫描、腹部磁共振、胸部X射线、心电图、计算机断层扫描和/或正电子发射计算机断层显像等)。随访终点事件包括无病生存时 间(progression-free survival,PFS) 和OS。PFS 指诊断第1天至患者出现肿瘤进展或死亡的时间;OS指诊断第1天至死亡日期或失访患者的末次联系日期的时间。
1.4 统计学方法
数据分析采用SPSS 20.0统计软件。计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以率(%)表示,比较用χ2检验。绘制ROC曲线,Kaplan-Meier法绘制生存曲线,比较用Log-rank χ2检验,单因素和多因素Cox分析确定影响预后的影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床病理特征
两组患者临床病理特征比较,经χ2检验,差异无统计学意义(P>0.05)。两组患者淋巴细胞、单核细胞比较,经t检验,差异有统计学意义(P<0.05);而血红蛋白、嗜酸性粒细胞比较,差异无统计学意义(P>0.05)。两组患者诊断前外周血LMR水平升高与外周血淋巴细胞数量增加及单核细胞数量减少有关(P<0.05),而LMR水平高低与宫颈癌患者肿瘤分期晚、细胞分化低、病理类型差、淋巴脉管浸润、淋巴结转移及间质浸润深度等因素无关(P>0.05)。见表1、2。

表1 两组患者临床病理特征比较 例(%)
表2 两组患者诊断前外周血血常规的参数比较(±s)

表2 两组患者诊断前外周血血常规的参数比较(±s)
组别 淋巴细胞/(×109/L) 单核细胞/(×109/L) 血红蛋白/(g/L) 嗜酸性粒细胞/(×109/L)LMR ≤ 2.01组1.20±0.43 0.93±0.64 114.09±24.42 0.15±0.13 LMR>2.01组1.80±0.71 0.47±0.20 116.65±17.72 0.17±0.17 t值 8.247 -6.220 0.831 0.578 P值 0.000 0.000 0.408 0.564
2.2 LMR、临床病理参数对宫颈癌患者的预后影响
Kaplan-Meier生存曲线显示,高LMR组患者PFS和OS分 别 为(91.0±1.2) 和(93.0±0.7)个月;低LMR组患者PFS和OS分别为(74.3±3.2)和(77.2±2.3)个月。高LMR组和低LMR组患者5年PFS生存率分别90%和57%;5年OS生存率分别94%和56%。两组患者PFS、OS生存率比较,经χ2检验,差异有统计学意义(χ2=36.331和59.432,均P=0.000)(见图2)。Cox分析采用逐步前进法,引入水准α≤0.05,剔除水准α≥0.1。单因素Cox分析显示,肿瘤FIGO分期晚期、单核细胞数量增多及LMR降低是影响宫颈癌患者PFS和OS的不良预后因素(P<0.05)。而多因素Cox分析显示,除肿瘤FIGO分期以外,LMR升高是宫颈癌患者PFS和OS的独立危险因素(P<0.05)。见图2和表3~6。

图2 两组患者PFS和OS的Kaplan-Meier生存曲线

表3 影响宫颈癌患者PFS的单因素Cox分析相关参数
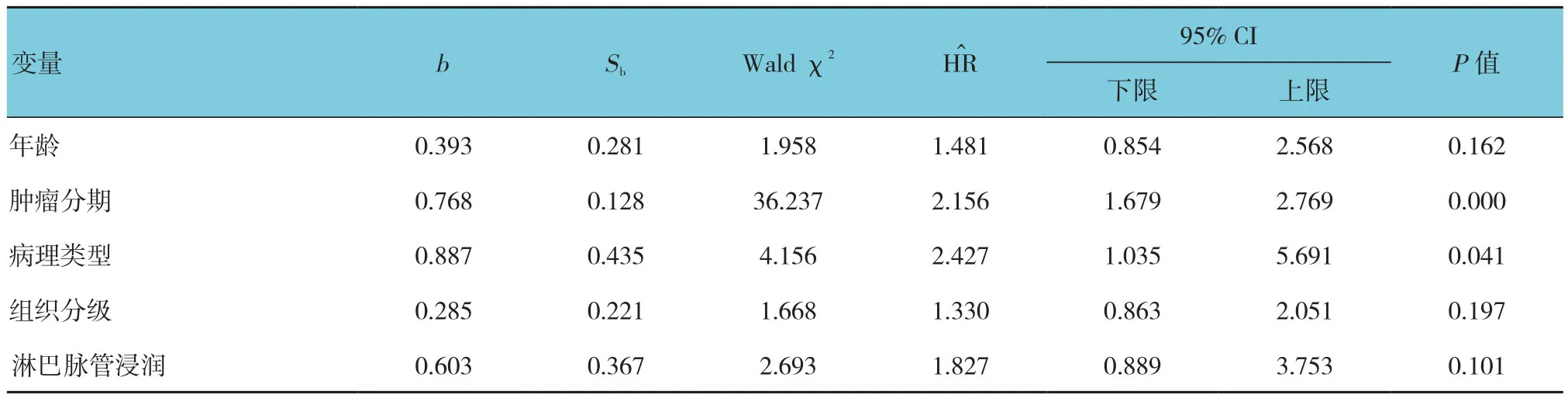
表4 影响宫颈癌患者OS的单因素Cox分析相关参数

续表4
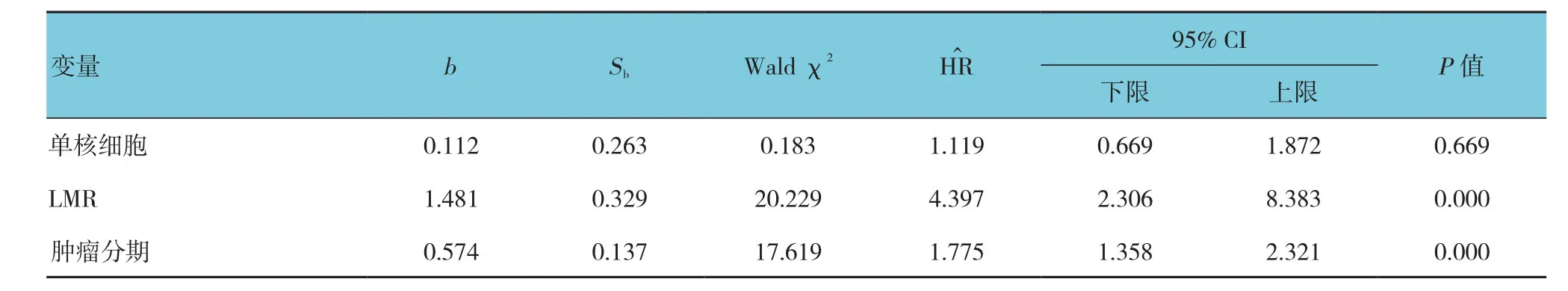
表5 影响宫颈癌患者PFS的多因素Cox分析参数
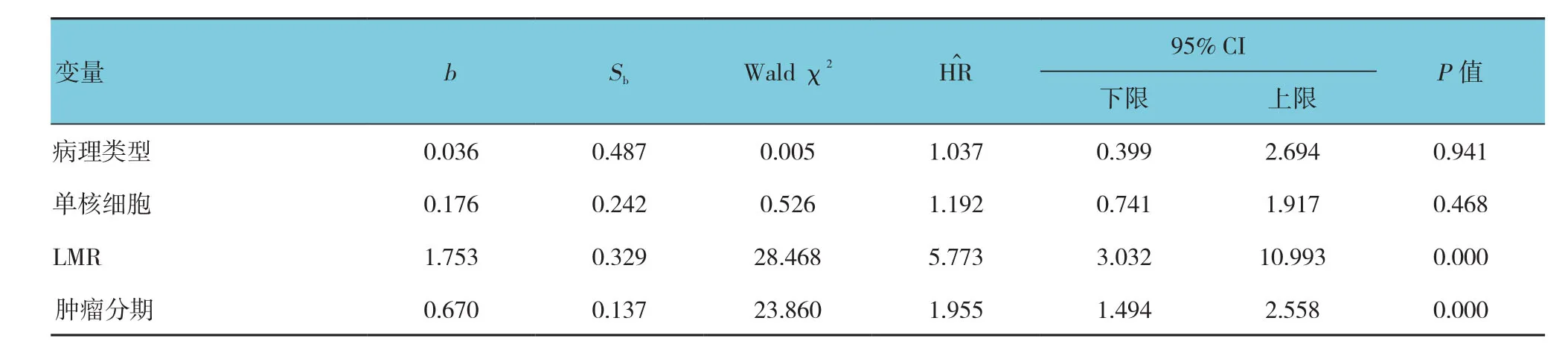
表6 影响宫颈癌患者OS的多因素Cox分析参数
3 讨论
慢性炎症被证实参与肿瘤的发生、发展、侵袭转移、血管形成及细胞间质转化[4]。炎症环境中的各种炎症细胞及其分泌各种炎症细胞因子,如白细胞介素-6、血管内皮生长因子、细胞生长因子等可促进肿瘤生长、侵袭和转移,且相互作用并形成肿瘤相关炎症微环境[5-6]。炎症微环境不仅促进癌症的血管形成及侵袭转移,而且改变癌细胞对激素及各种化疗药物的反应[2]。淋巴细胞及单核细胞作为炎症细胞之一被证实与各种恶性肿瘤患者的生存预后密切相关[7-10]。越来越多的证据显示,肿瘤相关炎症因子如淋巴细胞、中性粒细胞、血小板、单核细胞等与宫颈癌患者的预后不良有关[3,8,11-13]。但是,目前除鳞状细胞相关抗原以外,尚无公认可用于判断宫颈癌预后的有效生物标志物。因此笔者预测,与单一淋巴细胞及单核细胞比较,淋巴细胞与单核细胞的炎症组合体将对恶性肿瘤患者的生存预后显示出更大的预后价值。LMR作为肿瘤相关的综合炎症指标,已被证实与多种肿瘤的预后相关,然而国内关于LMR与宫颈癌预后的关系尚不明确。本研究为国内首次报道分析LMR在宫颈癌患者中的潜在预后价值。
LMR是一种易测量、重复好且价格低廉的肿瘤相关性炎症指标。尽管CHEN等[14]报道LMR是宫颈癌的独立预后因子,但该研究仅纳入了行根治性手术治疗的Ⅰb1~Ⅱa期宫颈癌患者,且国内尚无LMR与宫颈癌预后关系的相关研究报道。为进一步证实LMR与宫颈癌患者的关系,本研究统计分析254例宫颈癌患者诊断前LMR水平和临床病理参数对生存预后的影响,结果表明LMR值与淋巴细胞及单核细胞的数量相关,而与肿瘤分期、病理类型、组织学分级、淋巴脉管浸润、淋巴结转移及间质浸润深度无关。生存分析结果显示,高LMR值患者的PFS和OS高于低LMR值患者,显示较好生存优势。这些结果提示宫颈癌患者的LMR值越低则越容易出现肿瘤细胞的侵袭、转移,从而导致宫颈癌患者不良预后的发生。
该研究重大意义在于进一步肯定LMR在宫颈癌患者中的预后价值。LMR作为一种独立的炎症组合体,与肿瘤的分期、病理类型、淋巴脉管浸润、淋巴结转移及间质浸润深度等均无相关性,由此更加明确LMR在宫颈癌中的独立预后意义。然而,回顾性和单中心研究是本研究的不足之处。为缩小不可避免的选择偏倚,笔者纳入相对较大的样本量。尽管如此,仍需要具有较大规模样本的多中心前瞻性研究来验证实验结果,同时与其他有意义的各种炎症指标联合分析出更有独立意义的预后指标。
综上所述,LMR与宫颈癌的发生、发展息息相关,其水平高低可有助于精确判断宫颈癌患者的预后,在临床应用中具有良好的指导作用。
