食管鳞状细胞癌患者microRNA-127-3p的表达水平及临床意义
2019-10-24符佳汪砥江金琼刘劲段华新
符佳,汪砥,江金琼,刘劲,段华新
(1.湖南省人民医院 肿瘤科,湖南 长沙 410005;2.长沙市中心医院 肿瘤科,湖南 长沙 410004)
我国食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)发病率较高,严重威胁患者生命健康[1-2]。其发病机制复杂,与诸多分子机制有关[3-5]。明确其发生、发展的分子机制,有利于ESCC早期诊断与靶向治疗[6]。有研究表明,microRNA(miRNA)与胚胎发育、器官形成及肿瘤形成关系密切,其中miR-127-3p与乳腺癌、宫颈癌等肿瘤形成密切相关[7]。有研究表明SKI基因是miR-127-3p潜在的靶基因,但在ESCC中鲜有报道[8]。因此,本研究探讨ESCC患者癌组织中miR-127-3p及SKI蛋白表达水平与肿瘤分期、患者预后的关系,现报道如下。
1 资料与方法
1.1 一般资料
选取2013年2月—2015年2月于湖南省人民医院和长沙市中心医院行外科手术的ESCC患者80例。其中,男性52例,女性28例;平均年龄(57.1±7.6)岁。患者均未合并影响生存的重大疾病,术中取适量切除的癌组织及癌旁组织(距癌组织≥5 cm正常食管上皮组织),放置于液氮中保存。ESCC诊断最终经病理证实且分化程度明确。参照2009年第7版国际抗癌联盟TNM分期标准[9],其中Ⅰ期患者22例,Ⅱ期患者31例,Ⅲ期27例;淋巴结转移21例,无淋巴结转移59例。本研究经医院伦理委员会批准,受试者均自愿签署知情同意书,并对患者随访至2018年2月。
1.2 试剂与仪器
DMEM培养液(美国Gibco公司),0.25%胰酶(美国Invitrogen公司),ALP活性检测试剂盒(南京建成生物工程有限公司),二氧化碳CO2细胞培养箱(德国HeraeusHolding公司),Olympus倒置显微系统(TH4-200,南京天龙光电仪器厂),实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)仪(LightCycler480,德国罗氏诊断有限公司),TaqMan® MicroRNA Reverse Transcription Kit试剂盒(美国应用生物系统公司)。
1.3 细胞复苏及培养
本研究中使用的ESCC细胞株Eca109、Kyse150及正常食管上皮细胞Het-1a均购自中国科学院上海细胞库。由液氮罐中迅速取出冻存的细胞,37℃水浴锅解冻,接种于一次性细胞培养瓶(25 cm2)中,加入 5 ml DMEM 培养液,放入 37℃培养箱在 5% CO2条件下培养,换液频率为2 d/次。当贴壁细胞汇合度达到约90%时,用0.25%胰酶消化传代,计数细胞后按1×105个/ml浓度接种继续培养,将传至第3~5代的细胞进行诱导分化实验。
1.4 RNA 提取
1.4.1 组织中提取由液氮中取出食管癌患者组织,加入研钵中,迅速磨成粉末状;取出100 mg新鲜研磨的粉末加入含1 ml Trizol裂解液的EP管中,混合均匀。室温静止5 min,加入200μl氯仿,充分混匀后室温放置 10 min ;4℃、3 500 r/min 离心 15 min,取上层水相,装于含1.5 ml RNase-free水的离心管中,加入等体积异丙醇,混匀,置于冰上30 min;取出离心管,4℃、3 500r/min 离心 15 min,得到 RNA 沉淀 ;75% 酒精500μl洗涤RNA,沉淀2次,风干;加入RNase-free的水50μl,室温溶解RNA;NanoDrop测定RNA浓度,置于-20℃条件下备用。
1.4.2 细胞中提取对各组细胞予以 0.25% 胰酶消化,将消化后的细胞悬液置于15 ml离心管中;在4℃、500 r/min低速离心2 min,弃上清,放置冰上;滴入1 ml Trizol裂解液重悬,混匀细胞,放置冰上;向Trizol裂解液中加入200μl氯仿,剧烈震荡细胞悬液,室温放置 5~10 min,在 4℃、3 500 r/min 离心 15 min ;取上层水相,装入含 1.5 ml RNase-free水的离心管中,放入等体积异丙醇,混匀后,放置冰上30~35 min ;在 4℃、3 500 r/min 离心 15 min,获取RNA沉淀;75%酒精500μl洗涤RNA沉淀2次,风干;放入50μl RNase-free水,室温溶解RNA;NanoDrop测定RNA浓度,置于-20℃条件下备用。
1.5 qRT-PCR
参考 TaqMan® MicroRNA Reverse Transcription Kit试剂盒说明书进行操作,对抽提的RNA进行体外逆转录实验,得到cDNA产物。反应条件:16℃孵育 30 min,42℃孵育 30 min,85℃加热 5 min,4℃保存。以得到的cDNA为模版,予以qRT-PCR,采用 TaqMan® Universal PCR Master Mix 20 μl反 应 体系,在PCR仪上操作,以U6作为表达检测的内参,ΔCT表示miR-127-3p的相对表达,其中ΔCT=CTU6-CTmiR-127-3p,反应条件 :95℃预变性 10 min,95 变性15 s,60℃退火 30 s,70℃延伸 30 s,共40个循环。见表1。
1.6 免疫组织化学染色检测 SKI蛋白
对石蜡切片进行2次脱蜡过程,对脱蜡后的组织进行酒精梯度清洗:二甲苯孵育5 min,弃去二甲苯,加入新的二甲苯继续孵育5 min,无水乙醇洗涤3 min,无水乙醇Ⅱ洗涤3 min,95%乙醇洗涤3 min,80%乙醇洗涤 3 min,磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤 3次,3 min/次 ;将切片至于含0.01 mmol/L的柠檬酸缓冲液中,对切片进行恢复,并放入微波炉,加热15 min,冷却至室温;取出石蜡切片,置于含3%双氧水中10~15 min,以防止内源性过氧化物酶对切片组织的损伤,用1×PBS缓冲液冲洗3次,3 min/次;按照1∶500加入SKI抗体,对石蜡组织切片进行室温孵育1 h或者4℃孵育过夜,用1×PBS缓冲液冲洗3次,3 min/次;按照1∶1 000加入辣根过氧化物酶标记的二抗,对石蜡组织切片进行室温孵育40 min,用1×PBS缓冲液冲洗3次,3 min/次;加入DAB试剂盒中的显色剂,室温孵育5~10 min,然后清水冲洗;苏木精复染室温孵育3~5 min,清水冲洗;对染色后的切片进行梯度酒精水化处理,然后树胶封片观察。采用上述同样的操作方法,对组织切片中的SKI进行免疫组织化学染色。同时以1×PBS缓冲液为一抗进行孵育,作为免疫组织化学染色的阴性对照。对每张切片随机选取5个高倍镜视野(400倍),计算SKI蛋白阳性细胞所占总细胞数目的比例,阳性表达的细胞数目>10%为阳性,<10%为阴性。
1.7 统计学方法
数据分析采用SPSS 21.0统计软件。计量资料以均数±标准差(±s)表示,比较用t检验或方差分析;计数资料以率(%)表示,比较用χ2检验;Kaplan-Meier法绘制生存曲线,比较用Log-rank χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 各细胞系中 miR-127-3p 相对表达量比较
Het-1a细胞中miR-127-3p相对表达量为(3.04±0.78),Eca109 为(2.38±0.53),Kyse150 为(1.42±0.51),经方差分析,差异有统计学意义(F=5.506,P=0.000);Het-1a高 于 Kyse150(P<0.05),Eca109高于 Kyse150(P<0.05)。见图1。

图1 各细胞系中 miR-127-3p 相对表达量比较(±s)
2.2 食管鳞癌与癌旁组织miR-127-3p相对表达量比较
食管鳞癌组织中miR-127-3p相对表达量为(0.86±0.23),癌旁组织为(1.84±0.35),经t检验,差异有统计学意义(t=11.547,P=0.000),癌组织高于癌旁组织。见图2。

图2 食管鳞癌与癌旁组织miR-127-3p相对表达量比较(±s)
2.3 食管鳞癌与癌旁组织 SKI蛋白表达的比较
患者癌组织及癌旁组织中SKI蛋白主要表达于细胞质。食管鳞癌中SKI蛋白表达阳性率为78.75%,阴性率为21.25%,癌旁组织中阳性率为13.75%,阴性率为86.25%,经χ2检验,差异有统计学意义(χ2=67.982,P=0.000),癌组织高于癌旁组织。见图3。

图3 SKI蛋白光镜图(免疫组织化学×400)
2.4 不同临床指标患者的miR-127-3p低表达率比较
不同临床分期患者miR-127-3p低表达率比较,差异有统计学意义(P<0.05),Ⅲ期高于Ⅱ期和I期。是否有淋巴结转移和饮酒史患者miR-127-3p低表达率比较,差异有统计学意义(P<0.05),有淋巴结转移和饮酒史患者较高。见表2。
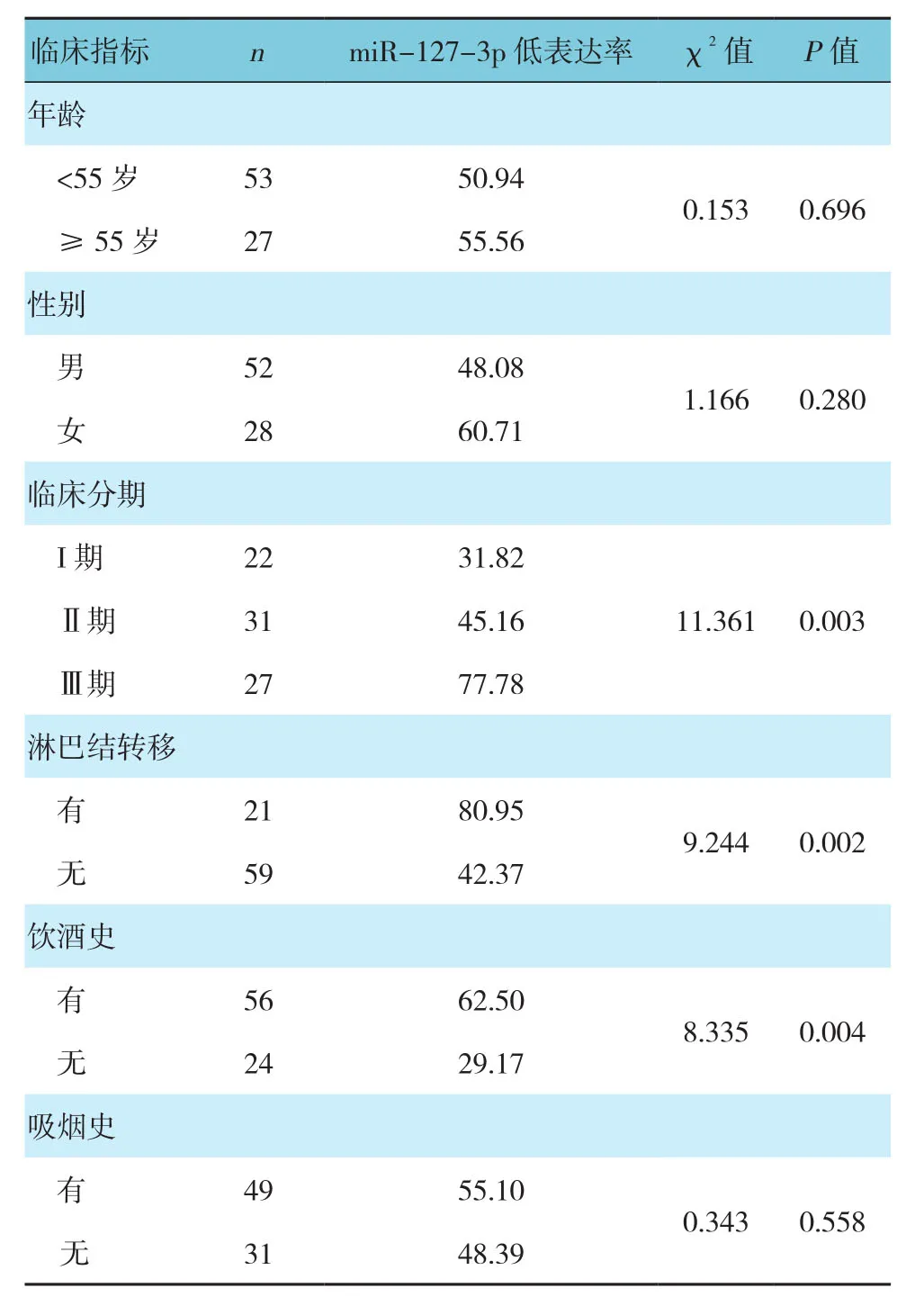
表2 不同临床指标患者的 miR-127-3p 低表达率比较 %
2.5 食管鳞癌患者 miR-127-3p 的表达与预后
42例食管鳞癌患者癌组织miR-127-3p低表达,38例患者高表达。20个月时miR-127-3p低表达患者生存率为47.6%,高表达患者为73.7%,经Log-rank χ2检验,差异有统计学意义(χ2=4.946,P=0.026)。miR-127-3p低表达患者中位无进展期(20个月)短于miR-127-3p高表达患者(30个月)。见图4。
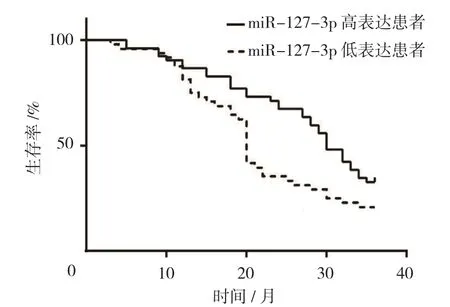
图4 癌组织中miR-127-3p表达水平与食管鳞癌患者预后的关系
3 讨论
我国食管癌发病例数占全球一半以上,为食管癌高发国家,目前miRNA与食管癌关系的研究日益深入[10]。miRNA在食管癌中的表达存在差异,并且能调节食管癌的增殖、凋亡、侵袭及迁移等生物学特性,这些证据表明miRNA参与食管癌发生、发展等病理过程[11-12]。对miRNA与食管癌关系的研究,目前主要集中在 miR-21、miR-203、miR-375、miR-106b-25、miR-143及miR-196a等的异常表达[13]。王江峰等[14]研究结果提示在84例食管鳞癌组织中,相比于癌旁组织,癌组织中miR-29b低表达48例,正常表达28例,而高表达只有8例;进一步分析发现癌组织中miR-29b低表达的患者,其肿瘤浸润程度低,TMN分期早,预后效果较好;罗君等[15]在食管鳞癌患者组织中检测miR-31的表达发现,其相比正常组织中表达上调,推测其表达上调可能会促进鳞癌发生、发展过程。KURASHIGE等[16]对患者血浆中的miR-21进行检测发现,食管鳞癌患者术后血浆miR-21明显表达下调,暗示其可能与食管癌患者预后相关。赵鑫等[17]通过对在大鼠星形胶质细胞的研究发现,加入脂多糖对大鼠进行诱导,可上调细胞中SKI蛋白的表达,表明其可能参与炎症的发生;JIANG等[18]通过第二代测序技术对miRNAs进行测序,发现miR-127-3p在胶质瘤细胞中表达下调,其表达水平的下调是由于DNA甲基化与组蛋白乙酰化的作用,从而导致基因的转录表达被抑制;对其进一步研究发现,miR-127-3p可通过靶向调控SKI蛋白,激活TGF-β信号的传导过程,抑制胶质瘤细胞的增殖,但对食管鳞癌的研究鲜有报道。
本研究对80例ESCC患者进行miR-127-3p的表达检测,结果癌组织中存在低表达;进一步通过细胞学培养实验发现,miR-127-3p在食管鳞癌细胞中低表达,且在临床分期Ⅰ期中表达最低;分析患者的临床特征与miR-127-3p在癌组织中的表达关系发现,miR-127-3p的表达水平与患者性别、年龄以及吸烟史无关,而与患者食管鳞癌的分期、有无转移及饮酒史相关。表明食管鳞癌组织中miR-127-3p的表达与食管癌的发生有关,其表达上调与食管鳞癌的发展、转移相关,暗示其在食管鳞癌的发生、发展过程中起重要作用;笔者同时对80例患者进行了随访观察,其中42例患者食管鳞癌组织中的miR-127-3p存在低表达,而38例患者食管鳞癌组织中的miR-127-3p相比于癌旁组织变化无差异;绘制生存曲线进行分析发现,高表达miR-127-3p患者中位无进展期长于miR-127-3p低表达患者。
综上所述,在ESCC患者中,相比癌旁组织,癌组织中miR-127-3p存在低水平表达。进一步体外细胞实验验证,miR-127-3p在食管鳞癌细胞中存在低表达,并且与食管癌的发生、发展及预后密切相关。
