核仁素在血管紧张素Ⅱ诱导的血管平滑肌细胞表型转化中的作用*
2019-10-24张银妆刘伟伟
方 立, 黄 钦, 张银妆, 黄 芳, 苑 聪, 刘伟伟
(长沙市第一医院心血管内科二病区, 湖南 长沙 410005)
研究表明血管平滑肌细胞(vascular smooth muscle cells, VSMCs)表型转化是高血压、动脉粥样硬化和血管成形术后再狭窄等心血管病VSMCs增殖和迁移的关键性起始步骤,也是该类疾病的共同发病基础[1-2],因此,如何控制和逆转VSMCs表型转化是控制VSMCs异常增殖的关键性措施。核仁素(nucleolin)是细胞核仁中含量最多的一种RNA结合蛋白,其主要功能涉及核糖体RNA合成、核糖体装配等的调控[3]。近期的研究表明核仁素还参与细胞生长、增殖、凋亡和炎症免疫等生理病理过程[4]。研究表明核仁素的RNA结合特性是赋予核仁素具有多种生物学功能的重要特性,其特异的核酸结合元件为“(T/G)CCCG(A/G)”[5-7]。核仁素在不同类型或者同一类型细胞的不同状态之间具有穿梭的特点,在大多数细胞中以细胞核表达为主,也可以糖基化或磷酸化的形式存在于细胞膜或细胞浆[8]。核仁素的表达水平与细胞分裂的速率呈正相关,在肿瘤以及其它快速分裂的细胞中核仁素的表达量相当高,而在非分裂细胞中却非常低,因此核仁素常被用来衡量细胞增殖的程度,这些均充分提示RNA结合蛋白核仁素可能在调节细胞的增殖或表型转化方面发挥重要作用,并且核仁素的细胞穿梭功能参与了上述生物学过程。核仁素是否具有调节VSMCs表型转化及如何发挥作用,目前尚不清楚。
本研究拟采用血管紧张素Ⅱ(angiotensin II,AngⅡ)诱导VSMCs表型转化为细胞模型,观察VSMCs表型转化时核仁素mRNA和蛋白的时空表达模式;采用基因过表达及RNA干扰技术从正反两方面观察细胞内核仁素对AngⅡ介导的VSMCs表型转化的影响,旨在探讨核仁素在VSMCs表型转化中的作用,并初步探讨其促表型转化机制。
材 料 和 方 法
1 细胞培养
VSMCs购于上海天呈生物信息科技有限公司(ATCC来源,货号CRL-1476TM)。正常生长培养基为DMEM(高糖)+10% 胎牛血清,细胞呈梭形,贴壁生长。放于CO2浓度为5%、温度为37 ℃的细胞培养箱中。根据实验设计的要求,将AngⅡ稀释成10-5mmol/L、10-6mmol/L、10-7mmol/L和10-8mmol/L不同浓度,分别刺激血管平滑肌细胞48 h。10-5mmol/L AngⅡ分别诱导培养VSMCs不同时间。
2 主要试剂
兔抗鼠核仁素多克隆抗体购自Sigma-Aldrich;鼠抗α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)单克隆抗体购自武汉博士德生物技术有限公司;兔抗鼠平滑肌蛋白22α(smooth muscle protein 22α, SM22α)多克隆抗体、鼠抗钙调理蛋白(calponin)单克隆抗体、鼠抗β-肌动蛋白(β-actin)单克隆抗体和兔抗鼠β-微管蛋白(β-tubulin)多克隆抗体均购自Abcam;鼠抗骨桥蛋白(osteopontin,OPN)单克隆抗体和山羊抗兔或抗小鼠IgG购自Santa Cruz;小鼠抗增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)单克隆抗体购自BD Biosciences;BCA蛋白浓度测定试剂盒和BeyoECL Plus化学发光试剂盒购自碧云天生物技术研究所;总RNA提取试剂盒和质粒提取试剂盒购自由北京博大泰克生物技术有限公司;实时荧光定量PCR试剂盒购自 TaKaRa;MegaTran 1.0试剂盒购自OriGene。
3 方法
3.1细胞核蛋白、胞浆蛋白的分离以及细胞总蛋白的提取 细胞处理后采用NE-PERTM细胞核和细胞浆提取试剂盒收集细胞浆和核蛋白质成分,在-70 ℃下储存。细胞总蛋白的提取过程:VSMCs经相应处理后,用4 ℃预冷的PBS洗涤3次,根据细胞浓度,每瓶细胞加50~80 μL 12× SDS裂解液(100 mmol/L Tris-HCl, pH 6.8;200 mmol/L DTT;40 g/L SDS;20%甘油)裂解细胞。裂解完毕后,用加样枪将细胞碎片和裂解液转移至1.5 mL离心管中,100 ℃煮沸变性10 min,于4 ℃下12 000 ×g离心10 min。将离心后的上清分装转移到0.5 mL的离心管中放于-70 ℃保存,使用Bicinchoninic Acid Protein Assay试剂盒测定蛋白质浓度。
3.2细胞总RNA的提取,逆转录和RT-qPCR分析 细胞处理后使用RNeasy试剂盒提取细胞总RNA。根据目的基因设计特异性引物,由上海生工生物工程股份有限公司合成。α-SMA的上游引物序列为5’-ACTGGGACGACATGGAAAAG-3’,下游引物序列为 5’-CATCTCCAGAGTCCAGCACA-3’;calponin的上游引物序列为 5’-ACTTCATGGATGGCCTCAAG-3’,下游引物序列为 5’-GTGCCAGTTCTGGGTTGACT-3’;SM22α的上游引物序列为5’-TTCTGCCTCAACATGGCCAAC-3’,下游引物序列为5’-CACCTTCACTGGCTTGGATC-3’;OPN的上游引物序列为 5’-ATGGCTTTCATTGGAGTTGC-3,下游引物序列为 5’-CCTCGCCTTTGCCGATCC-3’;β-actin的上游引物序列为 5’-CCTCGCCTTTGCCGATCC-3’,下游引物序列为 5’-GGATCTTCATGAGGTAGTCAGTC-3’;nulceolin的上游引物序列为 5’-CAATCAGGCTGGAGTTGCAAG-3’,下游引物序列为 5’-TGGCCCAGTCCAAGGTAACTT-3’。提取的总RNA经微量紫外分光光度计测量浓度后按TaKaRa逆转录试剂盒推荐步骤进行逆转录,逆转录为cDNA后,进行real-time PCR扩增。反应体系5 μL:cDNA 2 μL,正、反引物(10 pmol/L)各0.2 μL,Dye II 0.2 μL,加蒸馏水补充至10 μL。扩增条件为:95 ℃ 10 s预变性;95 ℃ 5 s变性,60 ℃ 30 s退火延伸,扩增40个循环。反应和数据处理均在Applied Biosystems 7500 Real-time PCR System上进行。用循环阈值(cycle threshold,Ct)来计算样本中目的基因的mRNA表达量。每个目的基因均重复3次,Ct值取均值进行比较和统计分析。采用相对表达量计算法(2-ΔΔCt)计算各基因表达量的差异,设对照组基因表达量为1,并选择β-actin作为内参照。
3.3间接细胞免疫荧光检测核仁素的定位 消化VSMCs后,接种在放置有无菌盖玻片的6孔板中;细胞长满约80%后,吸尽培养液,用PBS洗涤3次,各孔加入1 mL 4%多聚甲醛固定20 min;用PBS洗3次,每次5 min,去固定液;0.5%Triton X-100孵育10 min;PBS洗涤后用2%BSA室温封闭60 min;去封闭液,分别在盖玻片上加入1∶100稀释的抗核仁素抗体(50 μL)作用60 min;用PBS洗涤3次,每次5 min,去除未结合的 I 抗;然后再加入1∶100稀释的FITC标记荧光 II 抗(50 μL)作用60 min;用PBS洗涤3次,每次5 min,去除未结合 II 抗;加入Hoechst 33258孵育20 min,抗荧光淬灭液封片,置于倒置荧光显微镜下观察拍照。
3.4Western blot实验 按照实验室常规方法进行,各处理组细胞经相应处理后移去培养液,用 4 ℃ PBS洗涤2次;加入100 μL 2× SDS蛋白裂解液裂解细胞,将裂解液转移至Eppendorf管,超声10~15 s,12 000 r/min离心5 min,将上清液转移到另一干净Eppendorf管;用BCA法测定蛋白浓度;将 20 μg蛋白与 2× SDS加样缓冲液混合,100 ℃煮沸5 min;样品经10%SDS-PAGE分离后,电转移法转移到硝酸纤维素膜上;室温下封闭4 h后,分别加入兔抗鼠核仁素多克隆抗体、鼠抗calponin单克隆抗体、兔抗鼠SM22α多克隆抗体、鼠抗osteopontin单克隆抗体、鼠抗α-SMA单克隆抗体和鼠抗β-actin单克隆抗体(均为1∶1 000稀释),4 ℃过夜;洗去 I 抗后,加入辣根过氧化物酶偶联的相应 II 抗,反应2 h,化学发光法显色,扫描结果。
3.5pcDNA3.1-Nuc/siRNA-Nuc重组质粒的扩增和提取 pcDNA3.1-Nuc/siRNA-Nuc重组质粒由中南大学湘雅医学院病理生理学教研室王慷慨教授惠赠。将核仁素过表达质粒pcDNA3.1-Nuc或核仁素干扰RNA片段(siRNA-Nuc:5’-ACCTGCCTTCGCGA-GCTTCACCAT-3’;siRNA:5’-CATGGTGAAGCTCG-CGAAGGCAGGT-3’)转入到感受态细胞中,之后挑取单克隆菌落放于含相应抗生素的5 mL LB培基中,置于37 ℃的摇床上,250 r/min培养过夜,之后转移到含相应抗生素的200 mL LB培养基中扩大培养,浑浊度达到标准后收集细菌用于质粒的抽提,摇动14~16 h。按质粒提取试剂盒说明书提取siRNA-Nuc/pcDNA3.1-Nuc质粒,基本步骤为将大肠杆菌菌液分装入EP管,离心获得细菌沉渣,循序加入solution试剂提取出质粒,Wash buffer清洗,无菌超纯水37 ℃孵育后洗脱,获得质粒。提取出的质粒分光光度计测定DNA浓度,分装冻存于-70 ℃冰箱备用。
3.6细胞的瞬时转染 按照MegaTran 1.0转染试剂操作说明书进行。转染前给融合度为70%~90%(具体根据处理因素及处理时间)的VSMCs培养板换液。转染时(以6孔板为例)每孔取2 μg质粒,将其溶解在200 μL无血清DMEM培养基中,再将6 μL的MegaTran 1.0加入上述混合物中,混匀后室温放置约10 min,将混合液加入6孔板中,轻轻混匀后,将6孔板置于37 ℃、5%CO2的培养箱中,24 h后进行下一步实验。
4 统计学处理
采用SPSS 12.0统计学软件进行数据处理分析。数据以均数±标准差(mean±SD)表示,根据资料性质采用合适的统计学方法,两组间比较采用独立样本t检验,多组间采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 AngⅡ对VSMCs表型转化的影响
不同浓度AngⅡ刺激48 h后,VSMCs收缩表型标志物α-SMA、calponin 和 SM22α的mRNA和蛋白表达逐渐减少,而合成表型标志基因OPNmRNA和蛋白表达逐渐增加,其中AngⅡ的浓度为10-5mmol/L时效果最明显,见图1A、C。10-5mmol/L AngⅡ处理VSMCs不同时间后,VSMCs收缩表型标志物α-SMA、calponin 和 SM22α的mRNA和蛋白表达逐渐减少,而合成表型标志物OPN的mRNA和蛋白表达逐渐增加,其中72 h 时的效果最明显(P<0.05),见图1B、D。上述结果证实AngⅡ有明显的促进VSMCs表型转化的作用。
2 AngⅡ对血管平滑肌细胞中核仁素表达的影响
不同浓度AngⅡ刺激48 h后,VSMCs中核仁素mRNA和蛋白的表达在一定程度上逐渐升高,10-6mmol/L AngⅡ能明显上调核仁素mRNA和蛋白的表达(P<0.05)。10-6mmol/L AngⅡ处理VSMCs不同时间后,核仁素mRNA和蛋白的表达也在一定程度上逐渐升高,在48 h AngⅡ能明显上调核仁素mRNA和蛋白的表达,并持续至将近72 h(P<0.05),见图2A、B。利用10-6mmol/L AngⅡ处理VSMCs 12、24、 48和72 h,细胞成分分离后提取细胞核蛋白和细胞浆蛋白,采用Western blot分析核仁素蛋白的表达,结果显示正常情况下,绝大部分的核仁素位于细胞核中,胞浆中含量较少,而AngⅡ处理后,可见胞浆中的核仁素的含量逐渐增多,细胞核内的核仁素的含量逐渐减少(P<0.05),见图2C。β-tubulin和PCNA分别为胞浆蛋白和胞核蛋白的内参照,提示成分之间无明显污染。进一步采用间接免疫荧光证实,正常情况下绝大部分核仁素(绿色荧光物质)位于细胞核中,细胞浆中的含量较少;而10-6mmol/L AngⅡ处理VSMCs 48 h后,细胞浆中的核仁素(绿色荧光物质)明显增多,而细胞核中的核仁素(绿色荧光物质)明显减少,见图2D,提示AngⅡ可诱导核仁素从细胞核向细胞浆移位。核仁素过表达能增加核仁素在细胞核和细胞浆的表达及其胞浆移位;核仁素干扰后则细胞核和细胞浆表达量及其胞浆移位减少,见图2D。

Figure 1. RT-qPCR (A, B) and Western blot (C, D) were used to determine the effect of different concentrations (A, C) of Ang II for various time (B, D) on the expression of VSMC phenotypic transformation markers α-SMA, calponin, SM22α and OPN. Mean±SD.n=5.*P<0.05vs0 mmol/L group.
图1 RT-qPCR和Western blot 检测AngⅡ对VSMCs表型转化标志物α-SMA、calponin、SM22α和OPN mRNA和蛋白的影响
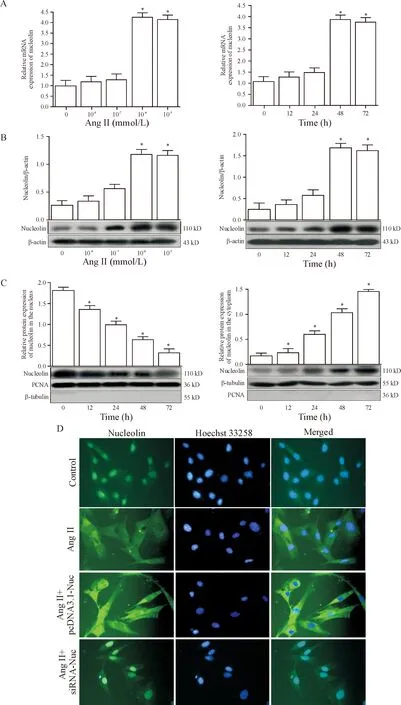
Figure 2. The effect of Ang II on the expression and subcellular localization of nucleolin in the VSMCs. A and B: RT-qPCR and Western blot were used to determine the effect of Ang II on the mRNA and protein expression of nucleolin in the VSMCs; C and D: Western blot and indirect immunofluorescence were used to observe the subcellular localization of nucleolin. β-tubulin and PCNA were used as the internal controls of cytoplasmic protein and nuclear protein, respectively. Nucleolin was detected with fluorescein isothiocyanate-labeled antibody (green), and nuclei were counterstained with Hoechst 33258 (violet). The magnification of the images in D was ×400. Mean±SD.n=5.*P<0.05vscontrol group.
图2 AngⅡ对VSMCs中核仁素表达及亚细胞移位的影响
3 核仁素过表达对Ang II诱导的VSMCs表型转化的影响
与正常对照细胞相比,转染pcDNA3.1-Nuc质粒后,VSMCs中核仁素的蛋白表达明显升高(P<0.05),见图3A。给予10-6mmol/L Ang II处理48 h,结果显示单纯Ang Ⅱ处理组及转空载体的对照细胞经AngⅡ处理后核仁素蛋白的表达明显上调,而转染核仁素基因的VSMCs经过Ang Ⅱ处理后核仁素蛋白的表达上调更为明显(P<0.05),见图3B。同时,Western blot检测结果显示,单纯Ang II处理和转空载体的对照细胞经Ang II处理后,OPN蛋白的表达明显上调,而转染核仁素基因的VSMCs经过Ang II处理后OPN蛋白的表达上调更为明显(P<0.05);与此相反,单纯Ang II处理和转染空载体的对照细胞经Ang II处理后α-SMA、calponin和SM22a表达下调,而转染核仁素基因的VSMCs经过Ang II处理后α-SMA、 calponin和SM22a蛋白的表达下调更为明显(P<0.05),见图3C。这些结果提示核仁素过表达可促进Ang II诱导的VSMCs表型转化。
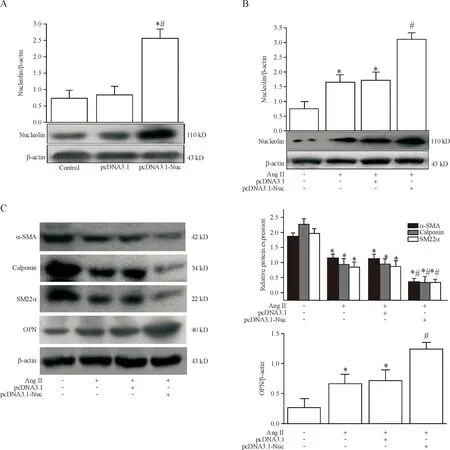
Figure 3. The effect of nucleolin over-expression on Ang II-induced phenotypic transformation of VSMCs. A: the effect of nucleolin over-expression on the expression of nucleolin in VSMCs; B: the effect of nucleolin over-expression on Ang II-induced expression of nucleolin in VSMCs; C: the effect of nucleolin over-expression on Ang II-induced expression of VSMC phenoty-pic transformation markers α-SMA, calponin, SM22α and OPN. Mean±SD.n=5.*P<0.05vscontrol group (without treatment);#P<0.05vspcDNA3.1 group, Ang II group or Ang II+pcDNA 3.1 group.
图3 Nucleolin过表达对Ang II诱导的VSMCs表型转化的影响
4 敲减核仁素表达对Ang II诱导的VSMCs表型转化的影响
与正常VSMCs相比,转染核仁素的RNA干扰载体siRNA-Nuc质粒48 h后,VSMCs中核仁素蛋白的表达明显受到抑制(P<0.05),见图4A。再给予10-6mmol/L AngⅡ处理48 h后,单纯AngⅡ处理组及转染对照质粒的细胞经过Ang II处理后,核仁素蛋白的表达明显上调,而转染siRNA-Nuc的VSMCs经过Ang II处理后核仁素蛋白的表达明显下降(P<0.05),见图4B。单纯Ang II处理和转染空载体的对照细胞经Ang II处理后,OPN蛋白的表达明显上调,而转染核仁素RNA干扰载体后OPN蛋白的表达上调受到明显抑制(P<0.05);与此相反,单纯Ang II处理和转染空载体的对照细胞经Ang II处理后α-SMA、calponin和SM22α的表达下调,而转染核仁素RNA干扰载体后α-SMA、calponin和SM22α蛋白的表达下调受到明显抑制(P<0.05),见图4C。这些结果提示核仁素表达下调后,其促进表型转化作用被解除。

Figure 4. The effect of nucleolin silencing on Ang II-induced phenotypic transformation of VSMCs. A: the effect of silencing of nucleolin on expression of nucleolin in VSMCs; B: the effect of silencing of nucleolin on Ang II-induced expression of nucleolin in VSMCs; C: the effect of silencing of nucleolin on Ang II-induced expression of VSMC phenotypic transformation markers α-SMA, calponin, SM22α and OPN. Mean±SD.n=5.*P<0.05vscontrol group (without treatment);#P<0.05vssiRNA group, Ang II group or Ang II+siRNA group.
图4 Nucleolin低表达对Ang II诱导的VSMCs表型转化的影响
讨 论
当血管受到损伤或体外培养的VSMCs受到生长因子刺激时,VSMCs从分化型转化为去分化型并获得增殖能力,这个过程称为表型转化。目前在VSMCs表型转化机制研究中取得较大的进展,普遍认为机体内存在内源性活性物质对VSMCs的增殖或表型转化起着自发的调控作用,因此,寻找并研究介导VSMCs表型转化新的内源性调控蛋白是阐明其作用机制的关键。尽管现己证实多种细胞因子、生长因子和血管活性物质参与VSMCs表型转化,然而VSMCs表型转化中究竟何种物质起关键作用,如何起作用以及多种调控因子之间存在怎样的相互作用,尚缺乏系统研究。核仁素是目前发现的271种核仁蛋白质中含量最多的一种,约占核仁蛋白质总量的10%,是真核细胞核仁中最主要的一种磷酸蛋白质。核仁素的重要功能之一是调控核糖体的生物合成与成熟,调控细胞增殖、生长、调控胚胎发生、胞质分裂、染色质复制与核仁的发生等过程[9]。大量研究表明核仁素高表达于增殖较快的组织和细胞,包括干细胞和肿瘤细胞,并能促进干细胞的更新和肿瘤细胞的生长[10]。核仁素的表达水平与细胞分裂的速率呈正相关。在肿瘤以及其它快速分裂的细胞中核仁素的表达量相当高,而在非分裂细胞中却非常低,因此作为一种有效的标记,核仁素常被用来衡量细胞增殖的程度[11],上述研究结果提示,在病理条件下核仁素可能具有调节血管平滑肌细胞表型转化的作用,而核仁素是否具有调节VSMCs表型转化,目前尚不清楚。
为了明确核仁素在VSMCs表型转化中的作用,本研究首先以AngⅡ刺激VSMCs诱导其发生表型转化,发现不同浓度和作用时间的AngⅡ刺激VSMCs后,VSMCs收缩表型标志物α-SMA、calponin和SM22α的mRNA和蛋白表达逐渐减少,而合成表型标志物OPN的mRNA和蛋白表达逐渐增加,上述结果证实AngⅡ有明显的促进VSMCs表型转化作用。为了证明AngⅡ刺激VSMCs表型转化与核仁素表达水平的关系,本研究采用RT-qPCR及Wetern blot检测发现,不同浓度和不同作用时间的AngⅡ刺激VSMCs后,核仁素的mRNA和蛋白的表达也在一定程度上逐渐升高。核仁素的表达改变是VSMCs表型转化中的伴随现象,还是核仁素在VSMCs表型转化中发挥了重要作用目前还不清楚。根据核仁素的表达模式分析,我们假定核仁素的表达上调在AngⅡ诱导的VSMCs表型转化发挥了作用。AngⅡ刺激可促进核仁素表达上调,其机制是什么呢?研究发现丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)通路的活化,也可使核仁素的表达上调,而多项研究亦证实AngⅡ诱导的VSMCs增殖和表型转化与MAPK信号通路成员细胞外信号调节激酶1/2(extracellular signal regulated kinase,ERK1/2)、氨基末端激酶(Jun NH2 terminal kinase,JNK)、p38和核因子-κB(nuclear factor-κB, NF-κB)的激活有关[12-13]。因此,AngⅡ可能通过激活MAPK和NF-κB等信号通路,进而使核仁素表达上调,但其具体机制还有待于进一步探讨。
核仁素含有氨基端、中心区和羧基端3个主要的功能结构域,其中心区含有4个较为保守的序列一致型RNA结合结构域(consensus sequence type RNA binding domain,CS-RBD)。目前认为,核仁素氨基端的核定位信号(nuclear localization signal,NLS)、中心区的RNA 结合结构域以及羧基端的甘氨酸富集区不但决定着核仁素的核仁定位,还赋予了核仁素在细胞浆和细胞核之间进行双向移位的特性[14]。由此可见,核仁素的细胞穿梭功能参与调节细胞的增殖与生长和凋亡等生物学过程。本研究也发现,在正常情况下,核仁素大部分位于血管平滑肌细胞胞核中,而AngⅡ可诱导核仁素从细胞核向细胞浆移位,提示核仁素可能在AngⅡ诱导的VSMCs表型转化中也起作用,而且其作用机制可能有赖于它的胞浆定位功能。有研究表明核仁素向细胞浆的移位取决于Cdc2激酶诱导其氨基端苏氨酸的磷酸化,相反去磷酸化则促进其向核转位[15]。因此,AngⅡ可能通过激活某些激酶,导致核仁素的移位,从而发挥调节VSMCs表型转化作用,上述问题有待于进一步研究阐明。为了探讨核仁素在VSMCs表型转化中的作用,我们采用了核仁素过表达和RNA干扰策略观察核仁素在VSMCs表型转化中的作用,结果显示核仁素过表达可明显促进AngⅡ诱导的VSMCs表型转化,而核仁素表达下调后其促进表型转化作用被解除。上述研究在国内外首次证明了核仁素的表达上调及其胞浆移位在AngⅡ所致VSMCs表型转化作用中起着关键的作用。
有文献报道,核仁素的RNA结合结构域CS-RBD即“(T/G)CCCG(A/G)”是其参与rRNA原初转录本剪接和成熟调节的结构基础[6-7]。除此之外,大量研究表明,这一结构还介导了核仁素对某些基因表达的转录后调节(调控靶基因mRNA稳定性),如核仁素与IL-2 mRNA的5’-非翻译区(5’-untranslated region,5’-UTR)结合[16]、GADD45α(growth arrest and DNA damage inducible gene 45α)mRNA编码区[17]结合,通过调控这些靶基因mRNA的稳定性来调节靶基因蛋白质的表达。核仁素的RBD结构域可与bcl-2、AKT1和p53等多种凋亡相关基因mRNA的 5’-和 3’-UTR结合,使相应的mRNA稳定或去稳定,从而发挥促细胞增殖和抗细胞凋亡作用[18]。核仁素通过其第4个RNA结合域与端粒酶RNA组分人类端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)结合,调节端粒酶的细胞核及核仁定位,从而调节细胞的生长与增殖[19]。最近研究还表明核仁素通过增强ABCA1的mRNA稳定性,随后增加胆固醇流出,抑制泡沫细胞的形成[20]。上述研究表明,核仁素的RNA结合特性,是其调节细胞的生长与增殖等多种生物学功能的关键。做为RNA结合蛋白,核仁素是否通过RNA结合域与表型转化相关基因的mRNA相结合,调控他们的稳定性及表达,进而在AngⅡ所致VSMCs表型转化作用中起作用呢?这些均需要进一步研究。
本研究初步证实了核仁素在AngⅡ所致VSMCs表型转化中发挥重要作用, 而核仁素的表达上调和移位可能参与Ang II诱导的VSMCs表型转化。VSMCs表型转化过程极其复杂,我们的研究很可能为VSMCs表型转化的调节机制研究提供了一个新的视角,根据目前结果结合相关文献推测核仁素可能通过其胞浆定位功能参与介导VSMCs表型转化相关基因的调控,影响相关基因表达,进而发挥促进表型转化作用。因此,核仁素也很有可能成为高血压、动脉粥样硬化和血管成形术后再狭窄等心血管病治疗的一个新的药物治疗靶点。
