益气养阴方通过激活ERK/Nrf2/HO-1通路减轻糖尿病大鼠心肌缺血再灌注损伤*
2019-10-24柴松波司富春王振涛张淑娟刘舜禹
柴松波, 司富春, 王振涛, 张淑娟, 刘舜禹
(1河南省中医院/河南中医药大学第二附属医院心病科, 河南 郑州 450002; 2河南中医药大学, 河南 郑州 450046)
糖尿病(diabetes mellitus,DM)属于临床常见代谢疾病。调查显示,近年来DM发病率逐渐升高,患者机体糖脂长期代谢紊乱会引发器官病理性损伤,其中心脏是受累较常见的器官之一[1]。研究发现DM患者中因心衰或心肌梗死死亡的患者为非DM患者数量的3倍,因此探究DM并发心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury,MIRI)的发生机制对于冠心病的治疗、预后有十分积极的意义[2]。益气养阴方由人参、黄芪、山药和丹参等中药组成,具有益气养阴和降脂降糖的功效,能够降低DM患者的血糖和血脂[3],然而其对DM合并MIRI是否也具有功效,目前尚不明确。本研究通过制备DM+MIRI大鼠,给予益气养阴方治疗,以期观察其对DM+MIRI大鼠的心肌保护作用,为DM合并MIRI的临床治疗提供一定的参考。
材 料 和 方 法
1 实验动物
雄性SD大鼠,SPF级,8周龄,体重200~220 g,由河南中医药大学实验动物中心提供,许可证号为SYXK(豫)2017-0005。所有大鼠均置于22~25 ℃,湿度50%~60%,光暗循环12 h(12 h黑暗、12 h光照)的环境内统一饲养,期间大鼠自由饮水、摄食,适应1周后,用于模型制备。本研究经河南中医药大学第二附属医院实验动物伦理委员会批准同意,且实验处理符合动物伦理学标准,伦理审批号为IACUC-20170208038。
2 主要试剂与仪器
益气养阴方(黄芪、山药、熟地、山萸肉、丹参各15 g,黄精、枸杞各12 g,人参、当归、知母、泽泻、川芎、地骨皮各10 g,在水中浸泡30 min,水煎2次,每次30 min,纱布过滤后去渣,置于旋转蒸发仪中浓缩,生药终浓度分别为750 g/L、1 500 g/L和3 000 g/L,高压灭菌后储存备用);链脲佐菌素(streptozotocin,STZ)和伊文思蓝(Sigma);心肌肌钙蛋白I(cardiac troponin I,cTnI)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素 10(interleukin-10,IL-10)和白细胞介素1β(interleukin-1β,IL-1β)ELISA检测试剂盒(武汉华美生物工程公司);核因子E2相关因子2(nuclear factor E2-related factor 2, Nrf2)激活剂bardoxolone methyl(北京百奥莱博科技有限公司);苏木精-伊红 (hematoxylin-eosin, HE) 染色试剂盒和氯化三苯基四氮唑(triphenyltetrazolium chloride,TTC)染液(中杉金桥);末端脱氧核苷酸转移酶介导的dUTP 缺口末端标记测定法 [terminal dexynucleotidyl transferase (TdT)-mediated dUTP nick end labeling,TUNEL] 染色试剂盒(北京市中山生物技术有限公司);蛋白抽提试剂盒和BCA蛋白质定量检测试剂盒(TaKaRa);超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)检测试剂盒(南京森贝伽生物科技有限公司);活性氧簇(reactive oxygen species,ROS)检测试剂盒(上海研拓生物科技有限公司);抗磷酸化细胞外信号调节激酶(phosphorylated extracellular signal-regulated kinase,p-ERK)、Nrf2、血红素加氧酶1(heme oxygenase-1,HO-1)和β-肌动蛋白(β-actin)抗体(R&D);山羊抗兔HRP标记 II 抗(CST)。全自动生化检测仪和垂直电泳仪(Beckman Coulter);免疫荧光显微镜和光学显微镜(Olympus)。
3 方法
3.1糖尿病模型的制备 参照文献[4]复制DM大鼠,所有大鼠饲养4周后,禁食12 h,选取95只大鼠腹腔注射55 mg/kg STZ,72 h后取大鼠尾静脉血检测空腹血糖(fasting blood glucose,FBG),以FBG水平≥16.7 mmol/L评定DM大鼠制备成功[5]。另外设定正常对照(control)组,仅注射等量枸橼酸-磷酸氢二钠缓冲液。
3.2DM+MIRI模型的制备 DM大鼠正常喂养3周后制备MIRI模型[6],腹腔注射2% 2 mL/kg的戊巴比妥钠麻醉大鼠,记录Ⅱ导联心电图,气管切开连接小动物呼吸机,开胸暴露心脏,于左心耳根部下4 mm用6-0丝线结扎冠状动脉左前降支,心电图示R波升高同时伴ST段抬高,表明心肌缺血成功,结扎持续45 min后解开丝线,心电图示ST段明显回落表明心肌缺血再灌注,持续灌注3 h,之后还纳心脏,逐层缝合胸部肋骨、肌肉和皮肤,其中5只大鼠因感染死亡,共成功制备DM+MIRI模型大鼠75只,另将15只DM大鼠仅以丝线穿过左前降支根部,不结扎,作为DM假手术(DM-sham, DM-S)组。
3.3动物给药与分组 将3.2中DM+MIRI模型大鼠分为:DM+MIRI组,益气养阴方低、中、高剂量(TL、TM和TH)组,Nrf2激活剂(bardoxolone methyl)组。每组均15只。另设DM-S组和control组各15只。益气养阴方组:于DM+MIRI模型制备后灌胃大鼠7.5、15和30 g/kg益气养阴方水煎液,灌药量10 mL/100 kg,每天1次,连续给药7 d。Nrf2激活剂组:每天灌胃大鼠30 mg/kg bardoxolone methyl,每天1次,连续给药7 d。control组、DM-S组和DM+MIRI组大鼠仅灌胃等量生理盐水,持续7 d。
3.4FBG、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)和高密度脂蛋白胆固醇(high- density lipoprotein cholesterol,HDL-C)水平的测定 末次给药后采集尾静脉血1 mL,葡萄糖氧化酶法检测FBG含量;全自动血液分析仪检测血清中TC、TG和HDL-C水平。
3.5超声检测大鼠心脏功能的变化 末次给药后,腹腔注射戊巴比妥钠(40 mg/kg)充分麻醉大鼠,采用多普勒彩色超声检测仪,选取二维模式测定左心长轴切面,检测心率(heart rate, HR)、左心室收缩压(left ventricular systolic pressure,LVSP)、左心室舒张末压(left ventricular end-diastolic pressure,LVEDP)、平均动脉压(mean arterial pressure,MAP)和左室射血分数(left ventricular ejection fraction, LVEF),连续3个完整心动周期,取平均值。
3.6血清cTnI、TNF-α、IL-1β和IL-10水平的检测 采用ELISA试剂盒检测血清中cTnI、TNF-α、IL-1β和IL-10水平,具体参照试剂盒说明书进行操作。
3.7心脏的TTC染色 末次给药后,每组随机挑选6只大鼠,麻醉处死迅速解剖获取心脏,于-20 ℃放置过夜。横向切割左心室成5片,添加1%TTC染液,室温孵育20 min后置于4%中性甲醛溶液中固定。蓝色部分为正常心肌组织,红色部分为缺血危险组织,白色部分为梗死组织。采用ImageJ软件定量大鼠梗死体积,计算心肌梗死体积百分比(%)=白色区域体积/红色区域体积×100%。
此次中国艺术家代表团由中国《雕塑》杂志社社长范伟民先生率领23位成员出席,参加作品展出的艺术家有张英超(鲁迅美术学院教授)、李倩(美国克利夫兰大学教授)、武非(北京工业大学艺术设计学院副院长)、李永康(新疆艺术学院副教授)、李建国、朱林、罗泽仁、邓华山、张文山、鱼苗、罗彬文、胥文武、刘钦等著名立体造型艺术家和相关专业艺术同仁。
3.8标本采集 末次给药后,将各组剩余9只大鼠充分麻醉后,于大鼠颈总动脉逆行注射1 mL 0.5%伊文思蓝,迅速解剖获取心脏,获取心脏组织清洗后,将非心肌组织去除,取心室横径最大部分心肌组织,置于4%多聚甲醛中固定24 h后,制备心肌组织石蜡切片;部分心肌梗死区组织用于冷冻切片制备,剩余组织置于液氮中保存。
3.9HE染色观察心肌组织病理形态学的变化 将心肌组织石蜡切片烘烤后、脱蜡、脱水后,参照HE染色试剂盒进行染色,将切片置于显微镜下,观察心肌组织病理形态学变化。
3.10TUNEL法检测心肌细胞凋亡情况 心肌组织石蜡切片脱蜡脱水后添加不含DNase的蛋白酶K,用TUNEL检测液37 ℃孵育30 min,PBS洗涤3次,于荧光显微镜镜下观察心肌细胞凋亡数情况,ImageJ软件定量细胞阳性数量,计算心肌细胞凋亡率(%)=凋亡细胞阳性数/细胞总数×100%。
3.11Western blot检测心肌组织p-ERK1/2、Nrf2和HO-1蛋白的水平 取出保存心肌组织,添加RIPA蛋白裂解液裂解30 min,抽提总蛋白,BCA法测定蛋白浓度后,SDS-PAGE分离等量蛋白,冰上行转膜反应,添加BSA封闭,清洗后添加抗p-ERK1/2、Nrf2、HO-1和β-actin的抗体(1∶500),4 ℃过夜孵育,添加HRP标记 II 抗(1∶5 000),室温下孵育2 h,ECL发光显影后置于凝胶成像仪中,以β-actin为内参照,采用Image-Pro Plus软件对蛋白表达进行定量分析。
3.12心肌组织中SOD活性及MDA和ROS水平的检测 称取1 mg心肌组织,添加预冷PBS(9 mL)在匀浆机中制备组织匀浆液,离心后取上清进行检测,参考SOD检测试剂盒采用氮蓝四唑显色法检测SOD活性,硫代巴比妥酸比色法检测匀浆液中MDA水平,铁离子还原法检测匀浆液的ROS水平,分别绘制SOD、MDA和FeSO4标准液标准曲线,根据样品测定结果分别计算待测组织匀浆中的SOD活性(×103U/g)、MDA含量(μmol/g)和ROS水平(μmol/g)。
4 统计学处理
实验数据采用SPSS 22.0软件进行分析。计量资料以均数±标准差(mean±SD)描述,多组间比较行单因素方差分析,进一步的两两比较采用SNK-q检验,当P<0.05时则认为差异具有统计学意义。
结 果
1 各组大鼠血清FBG、TC、TG和HDL-C水平的比较
与control组相比,DM-S组和DM+MIRI组的FBG、TC和TG水平均升高,HDL-C水平降低(P<0.05);与DM-S组和DM+MIRI组相比,益气养阴方各组和bardoxolone methyl组的FBG、TG和TC水平均降低,HDL-C水平升高 (P<0.05),见图1。
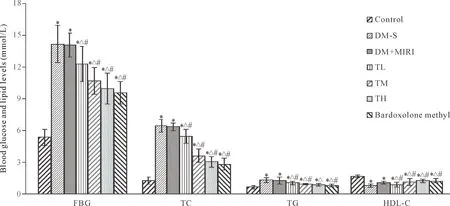
Figure 1. Comparison of FBG, TC, TG and HDL-C levels in each group. Mean±SD.n=15.*P<0.05vscontrol group;△P<0.05vsDM-S group;#P<0.05vsDM+MIRI group.
图1 各组大鼠血清FBG、TC、TG和HDL-C水平的比较
2 各组大鼠心脏功能的变化
与control组和DM-S组相比,DM+MIRI组的HR和LVEDP升高,MAP、LVSP和LVEF降低(P<0.05);与DM+MIRI组相比,益气养阴方各组和bardoxolone methyl组的HR和LVEDP降低,MAP、LVSP和LVEF升高(P<0.05),见图2。
3 血清cTnI、TNF-α、IL-1β和IL-10水平的比较
与control和DM-S组相比,DM+MIRI组的cTnI、TNF-α、IL-1β和IL-10水平升高(P<0.05);与DM+MIRI组相比,益气养阴方各组和bardoxolone methyl组的cTnI、TNF-α、IL-1β和IL-10水平降低(P<0.05),见图3。
4 各组大鼠心肌梗死体积的变化
与control和DM-S组相比,DM+MIRI组的心肌梗死体积百分比升高(P<0.05);与DM+MIRI组相比,益气养阴方各组和bardoxolone methyl组的心肌梗死体积百分比降低(P<0.05),见图4。

Figure 2. Comparison of the cardiac functions of the rats in each group. Mean±SD.n=15.*P<0.05vscontrol group;△P<0.05vsDM-S group;#P<0.05vsDM+MIRI group.
图2 各组大鼠心脏功能的变化情况比较
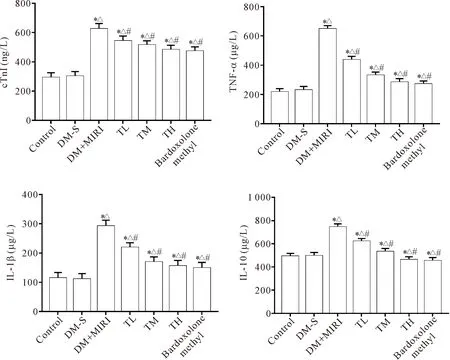
Figure 3. Comparison of the serum levels of cTnI, TNF-α, IL-1β and IL-10 in each group. Mean±SD.n=15.*P<0.05vscontrol group;△P<0.05vsDM-S group;#P<0.05vsDM+MIRI group.
图3 各组血清CTnI、TNF-α、IL-1β和IL-10水平的比较
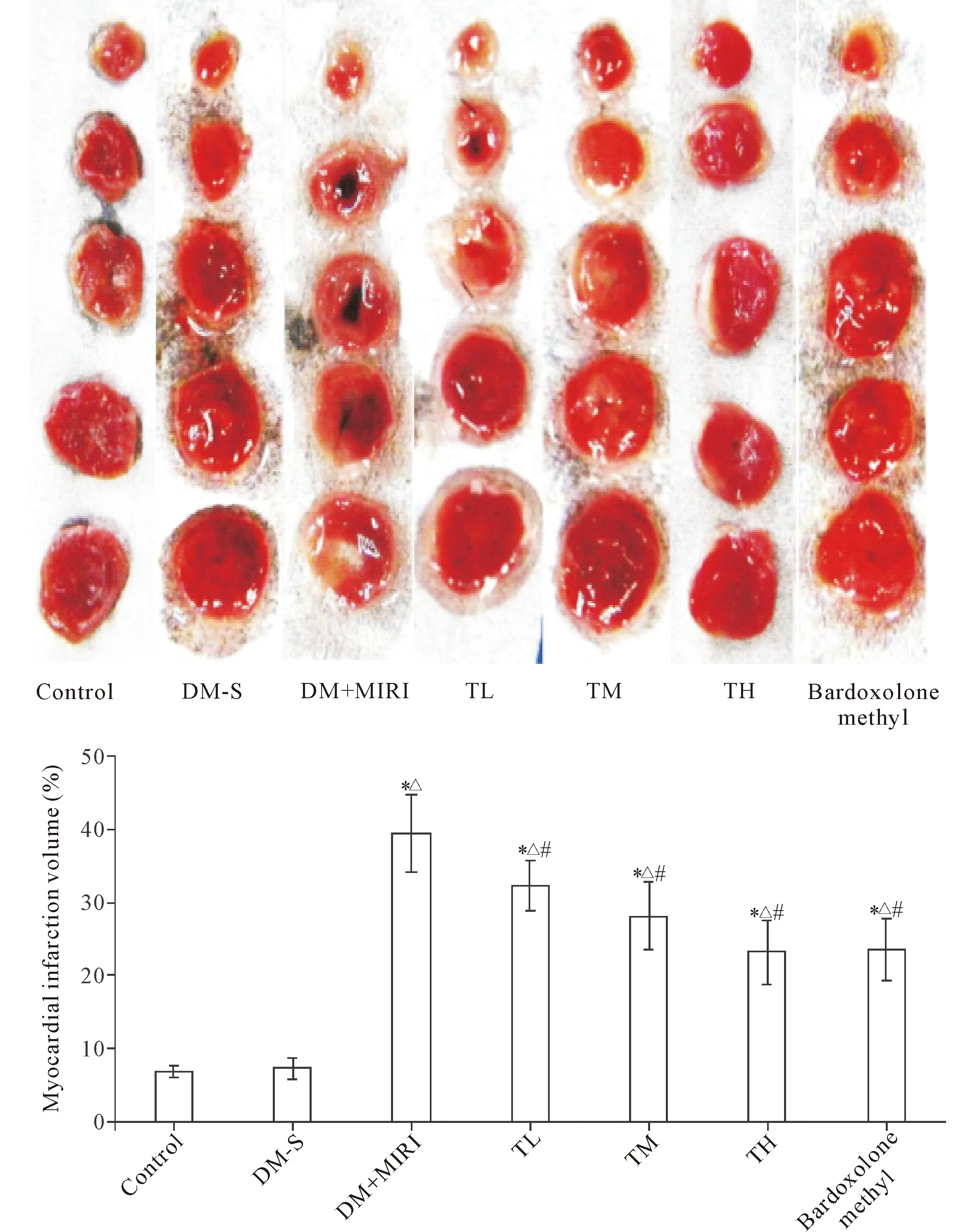
Figure 4. Assessment of myocardial infarction volume in the rats by TTC staining and comparison of the quantitative analysis data in each group. Mean±SD.n=6.*P<0.05vscontrol group;△P<0.05vsDM-S group;#P<0.05vsDM+MIRI group.
图4 TTC染色评价各组大鼠心肌梗死体积的变化
5 大鼠心肌组织病理形态学变化的观察
HE染色结果显示,control组和DM-S组大鼠的心肌细胞形态结构完整,细胞排列紧密,纤维结构排列规则;DM+MIRI组大鼠心肌细胞破碎、坏死,细胞排列不规则,心肌纤维断裂,伴有炎性细胞浸润;TL组、TM组、TH组和bardoxolone methyl组可见破碎和坏死心肌细胞有所减少,纤维断裂减少,细胞形态逐渐恢复正常,见图5。
6 大鼠心肌细胞凋亡情况的比较
与control和DM-S组相比,DM+MIRI组心肌细胞的凋亡率升高(P<0.05);与DM+MIRI组相比,益气养阴方各组和bardoxolone methyl组心肌细胞的凋亡率均降低(P<0.05),见图6。
7 大鼠心肌组织中p-ERK1/2、Nrf2和HO-1蛋白水平的变化
与control和DM-S组相比,DM+MIRI组p-ERK1/2、Nrf2和HO-1的蛋白水平均降低(P<0.05);与DM+MIRI组相比,益气养阴方各组和bardoxolone methyl组p-ERK1/2、Nrf2和HO-1的蛋白水平均升高,见图7。

Figure 5. Assessment of myocardial pathomorphological changes in the rats by HE staining (×200).
图5 HE染色评价大鼠心肌组织病理形态学变化
8 各组心肌组织中SOD活性及MDA和ROS水平的变化情况
与control和DM-S组相比,DM+MIRI组MDA和ROS水平均升高,SOD活性降低(P<0.05);与DM+MIRI组相比,益气养阴方各组和bardoxolone methyl组MDA和ROS水平均降低,SOD活性升高(P<0.05),见图8。
讨 论
本研究首先制备DM大鼠,结果发现与control组相比,DM-S组FBG、TC和TG水平均升高,HDL-C水平降低,表明DM大鼠血糖血脂水平均升高,符合DM病变特征,提示DM大鼠模型复制成功[7]。进一步结扎大鼠冠状动脉左前降支近端制备MIRI模型发现,与DM-S组相比,DM+MIRI组HR和LVEDP升高,MAP、LVSP和LVEF降低,血清炎症因子水平升高,大鼠心肌组织梗死区域体积比增加,心肌细胞破碎、坏死增多伴有大量炎性细胞浸润,表明结扎法能够成功复制MIRI模型,引发大鼠心肌损伤,提示DM+MIRI模型复制成功。
益气养阴方由人参、黄芪、山药、丹参、黄精和当归等组成。药理研究显示,人参能够降糖降脂;黄芪具有双向调节血糖的作用,还能够降低糖尿病患者的血液黏度,保护患者内皮细胞;丹参、当归可祛癖止痛、活血通经,缓解心绞痛,改善心肌缺血等[8]。牛新萍等[9]研究发现益气养阴方可改善心肌梗死患者心功能,降低炎症反应。益气养阴活血方能够通过激活PI3K-Akt通路缓解大鼠离体心脏缺血再灌注损伤[10]。本研究发现,与DM+MIRI组相比,益气养阴方各组HR和LVEDP降低,MAP、LVSP和LVEF升高,血清cTnI、TNF-α、IL-1β和IL-10水平降低,心肌梗死体积百分比降低,大鼠心肌细胞破碎、坏死减少,提示益气养阴方可通过减轻DM+MIRI大鼠心肌损伤,降低其血糖水平,发挥心肌保护作用,然而其具体机制目前尚不清楚。
心肌组织损伤是由多因素共同作用的结果,较多研究显示MIRI与细胞凋亡密切相关,机体正常状态下,细胞凋亡主要发挥清除衰老及病变细胞,维持机体健康的作用;当机体遭受外界、内部刺激或病理损伤后,细胞失去对其生长和凋亡的正常调控,凋亡过程出现紊乱,引发细胞异常凋亡,最终导致组织发生病理性损伤[11-12]。本研究发现,与control和DM-S组相比,DM+MIRI组心肌细胞凋亡率升高,益气养阴方处理后心肌细胞凋亡率降低,提示益气养阴方可有效抑制DM合并MIRI大鼠心肌细胞凋亡。
Figure 6. The images of TUNEL staining (×100) for observing the cardiomyocyte apoptosis in the rats and the quantitative analysis of the apoptotic rates in the rats of different groups. Mean±SD.n=9.*P<0.05vscontrol group;△P<0.05vsDM-S group;#P<0.05vsDM+MIRI group.
图6 TUNEL法观察各组大鼠心肌细胞的凋亡情况
ERK1/2信号通路为MAPK家族中重要亚族,在调控细胞增殖、分化以及氧化应激反应中发挥重要作用。大量研究表明ERK1/2信号通路在MIRI激活/抑制中发挥重要作用[13]。ERK1/2一般在心肌细胞中呈低表达,当受到MIRI刺激后被激活发生磷酸化。蒋智等[14]研究发现EdCC通过激活ERK1/2信号通路缓解小鼠MIRI,其机制可能与抑制心肌细胞凋亡有关。Nrf2/ARE通路为重要抗氧化应激通路,近期在脑缺血再灌注损伤中发现ERK1/2信号通路活化后可改变Nrf2构象,进而激活Nrf2导致Nrf2与Keap1解离,且活化Nrf2,进入细胞核中与Are结合,调控抗氧化蛋白如HO-1和NQO1蛋白等发挥抗氧化作用[15]。Wang等[16]研究发现在脑缺血再灌注损伤后,激活ERK1/2后ERK1/2发生磷酸化可进一步活化Nrf2/HO-1抗氧化通路,进而减少脑神经毒性损伤。本研究发现,与control和DM-S组相比,DM+MIRI组Nrf2、HO-1蛋白表达降低,ERK1/2磷酸化水平降低,益气养阴方处理后Nrf2和HO-1蛋白表达均升高,ERK1/2磷酸化水平升高,且与bardoxolone methyl组作用一致,提示ERK/Nrf2/HO-1通路参与MIRI,且益气养阴方可通过激活ERK/Nrf2/HO-1通路缓解大鼠MIRI,发挥心肌保护作用。另外,本研究结果还显示,与control和DM-S组相比,DM+MIRI组心肌组织MDA和ROS水平均升高,SOD水平降低;给予益气养阴方后,MDA和ROS水平均降低,SOD水平升高。这提示益气养阴方可减少MIRI引发的氧自由基堆积,发挥抗氧化作用,由此推测益气养阴方可缓解MIRI引发的氧化应激损伤。
Figure 7. The images of Western blot for determining the protein levels of p-ERK1/2, Nrf2 and HO-1 in each group and the results of quantitative analysis. Mean±SD.n=9.*P<0.05vscontrol group;△P<0.05vsDM-S group;#P<0.05vsDM+MIRI group.
图7 Western blot检测各组大鼠心肌p-ERK1/2、Nrf2和HO-1蛋白水平的变化
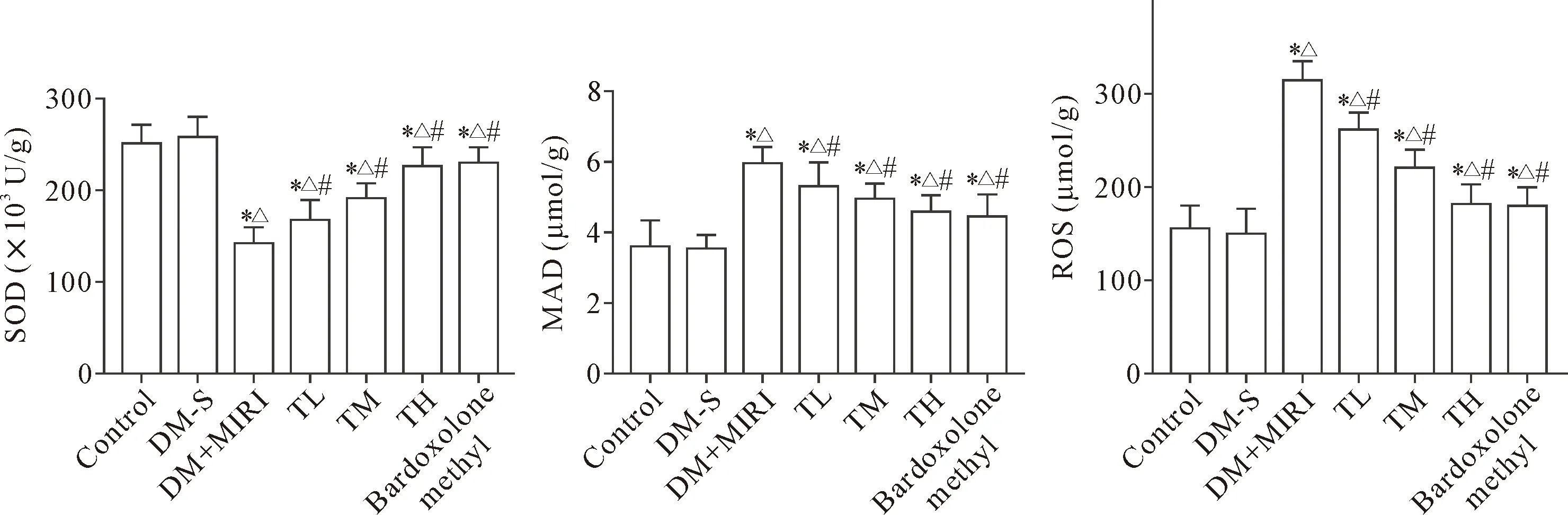
Figure 8. The myocardial levels of SOD, MDA and ROS in the rats of each group. Mean±SD.n=9.*P<0.05vscontrol group;△P<0.05vsDM-S group;#P<0.05vsDM+MIRI group.
图8 各组大鼠心肌组织SOD活力及MDA和ROS水平的变化
综上所述,益气养阴方可能通过激活ERK/Nrf2/HO-1通路,减轻MIRI引发的氧化应激损伤,进而发挥心肌保护作用。本研究也存在一定的缺陷,氧化应激指标过少,此外DM合并MIRI发生机制较复杂,是否还有其它信号通路参与益气养阴方对MIRI的作用,还有待后续进一步研究。
