羊水干细胞拟胚体与耳蜗基底膜共培养向神经元分化的可行性
2019-10-24宗凌姜鸿彦
宗凌 姜鸿彦
1广州医科大学附属第二医院耳鼻咽喉科
2中山大学附属第一医院耳鼻咽喉科,中山大学耳鼻咽喉科学研究所
3海南省人民医院耳鼻咽喉医院
胚胎干细胞向神经元方向分化的研究已经较为深入,拟胚体能再现神经细胞分化的许多事件[1-3]。Okabe等将胚胎干细胞悬滴培养形成拟胚体,表达神经元和神经胶质细胞的共同前体细胞的专一性标志Nestin,这些Nestin阳性细胞可诱导分化成神经元和神经胶质细胞[4]。通过拟胚体途径进行胚胎干细胞分化诱导,是胚胎干细胞神经元分化采用最广的策略。
羊水干细胞属于多能干细胞,具有与胚胎干细胞相似的体外增殖和分化能力[5-10];与胚胎干细胞体外移植不同,羊水干细胞接种活体动物不具有致瘤性,有望成为一种新的干细胞库[11]。羊水干细胞体外悬滴培养,可形成与胚胎干细胞相似的拟胚体[12]。我们前期研究发现:人来源的羊水干细胞,接种于基底膜组织来源的内耳干细胞空心球体制备的饲养层上,饲养层细胞表达内耳支持细胞标志物P27kip1,形成支持接触的三维培养模式。不添加外源性神经生长因子及神经元信号诱导因子,DMEM∕F12培养6天,羊水干细胞定向分化为功能性神经元,并表达听觉神经元标记物GATA-3[13]。对于未经酶解消化制备饲养层的基底膜片段组织,是否依然对羊水干细胞具有神经诱导作用,目前仍未明确。羊水干细胞能形成与胚体干细胞相似的拟胚体,而拟胚体经诱导能定向分化为神经元。有研究表明,耳蜗毛细胞的存在对听觉神经元的存活是必需的[14-16]。因此,本研究拟将耳蜗基底膜组织与羊水干细胞拟胚体共培养,不添加神经生长因子及神经元信号诱导因子,观察耳蜗基底膜组织能否诱导拟胚体细胞分化为形态典型的神经元。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:新生小鼠(C57BL∕6J,出生1-3天内),由中山大学中山医学院实验动物中心提供。
1.1.2 羊水取自中山大学附属第一医院耳聋基因产前检查家庭,夫妻双方均签署了知情同意书。在孕期19-22周期间,经B超引导下,抽取孕妇羊水10ml,羊水由中山大学附属第一医院提供;中山大学附属第一医院医学伦理委员会审核并同意此项研究。
1.1.3 主要试剂:α-MEM medium、胎牛血清(FBS)购于GIBCO公司,Chang B培养基、Chang C培养基购于Irvine Scientific公司,Tuj1一抗、Sox2一抗购于Abcam公司,Nestin一抗购于Santa cruz公司,c-Kit磁珠抗体购于MiltenyiBiotec公司。
1.2 实验方法
1.2.1 分离并培养扩增羊水干细胞
用磁珠抗体分选羊水中具有c-Kit标记的羊水干细胞,培养并传代羊水干细胞[11,13]。
1.2.2 羊水干细胞悬滴培养
收集羊水干细胞制成细胞悬液,用增殖培养基(a-MEM medium+15%FBS+1%谷氨酰胺+18%ChangB+2%ChangC)重悬羊水干细胞,40μl(4×103个羊水干细胞)为每个悬滴体积,接种于60mm直径培养皿盖上,将盖子翻转并放置在充满PBS缓冲液的培养皿上,每隔两天半量换液[12]。
1.2.3 免疫荧光
鉴定拟胚体细胞,神经干性标记物Nestin、Sox2的表达。
1.2.4 耳蜗基底膜培养
将小鼠断头后,充分暴露颅底,取出听泡移入Hanks培养液,在解剖显微镜下取出全耳蜗基底膜,用尖刀切取基底膜片段。取1ml无血清培养液,加入到鼠尾胶包被好的的培养皿中,将组织块移入,并使其下沉到培养皿底部。无血清培养液配方如下:DMEM+1%serum-free supplement(sigma I-1884)+2.4%葡萄糖(sigma G-2020)+1%谷氨酰胺,隔日更换培养液[17]。
1.2.5 共培养
耳蜗基底膜培养24小时后,可见组织生长良好,外周有明显新生上皮细胞及成纤维细胞;将羊水干细胞悬滴培养4天,形成的拟胚体移入基底膜培养皿中,换用DMEM∕F12培养液;此时开始用倒置显微镜每天观察细胞,以捕获出现神经样细胞(细胞突起长度为胞体直径的5倍以上)的最初时间;耳蜗基底膜与拟胚体共培养6天(前期研究:将羊水干细胞接种于基底膜组织来源的空心球体制备的饲养层,形成支持接触的三维培养模式,DMEM∕F12仅培养6天,即可见大量形态典型Tuj1阳性神经元[13]),检测神经元标记物Tuj1的表达。
1.3 统计方法
计量资料以均值±标准差(±SD)来表示,采用One-way ANOVA检验。所有数据输入SSPSS 17.0,P<0.05为组间差异具有统计学意义。
2 结果
2.1 羊水干细胞悬滴培养可形成拟胚体样结构
我们前期已成功分离并培养羊水干细胞,多次传代干性稳定;羊水干细胞悬滴培养1天后,可见部分细胞聚集形成拟胚体,此时结构较疏松,边缘不整齐(图1A);将羊水干细胞悬滴培养4天(图1B),可以形成类似于胚胎干细胞的拟胚体,胚体饱满,边界清楚,其内细胞连接紧密,生长旺盛,呈立体球形结构,外形极其规整(图1C),形成率96%。

图1羊水干细胞悬滴培养形成拟胚体A悬滴培养1天;B悬滴培养4天;C放大图,可见规整的立体球形结构。标尺:A,B=100μm;C=25μm。Fig.1 Amniotic fluid stem cells were cultured by hanging-drop to form embryoid body like structures.(A)hanging drop culture for 1 day;(B)hanging drop culture for 4 days;(C)magnified picture,show uniform three-dimensional spherical structure.Bar:A,B=100μm;C=25μm.
2.2 拟胚体表达神经干细胞标记物
羊水干细胞悬滴培养4天,形成拟胚体,表达神经干细胞标志物Nestin、Sox2(图2),表明该拟胚体具有神经前体细胞特征[18]。of neural stem cell.(A)Nestin;(B)Sox2.Bar:A,B=50μm.

图2羊水干细胞拟胚体表达神经干细胞标志物A Nestin;B Sox2。标尺:A,B=50μm。Fig.2 Amnioticfluidstemcellscouldformembryoidbody-like structures by hanging drop culture,which express the marker
2.3 共培养
将悬滴培养4天形成的拟胚体与耳蜗基底膜组织共培养,用DMEM∕F12贴壁分化6天(图3A),拟胚体细胞有神经元标记物Tuj1的表达(图3B),呈现红色荧光,多分布于克隆边缘,胞体为椭圆形,呈梭形成纤维细胞样形态,无典型的神经元形态特征(图3C)(以细胞突起长度为胞体直径5倍以上的神经样细胞表型作为形态学评价指标),突起长度仅为18±4.7μm;将Wnt-1基因质粒转染羊水干细胞,得到稳定表达Wnt-1的单克隆形成拟胚体,与耳蜗基底膜组织共培养,同样无形态典型的神经元产生。
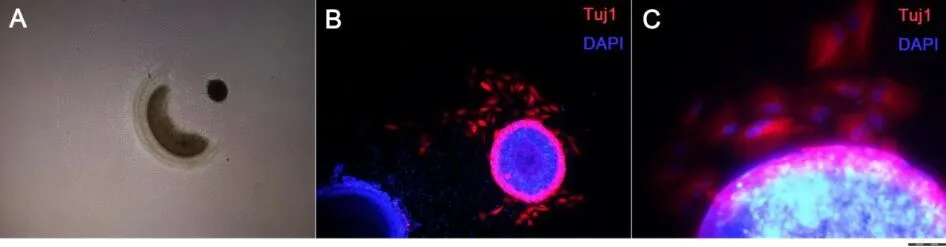
图3羊水干细胞拟胚体与耳蜗基底膜组织共培养,DMEM∕F12分化6天,(A)拟胚体与耳蜗基底膜共培养;(B)拟胚体表达神经元标记物Tuj1,但无典型的神经元形态特征;(C)放大图,可见Tuj1,呈现红色荧光,多分布于克隆边缘。标尺:A=100μm;B=50μm C=25μm。Fig.3 The embryoid body were co-cultured with the organ of corti for six days by DMEM/F12.(A)embryoid body co-cultured with the organ of corti;(B)embryoid body had the expression of Tuj1,but no typical neuronal morphological feature;(C)magnified picture,the red fluorescence of Tuj1 were mostly localized on the edge of the clone.Bar:A=100μm;B=50μm C=25μm.
3 讨论
本研究发现,将羊水干细胞体外悬滴培养,可形成形态均一且具有神经干性的拟胚体,表达神经干细胞标志物Nestin、Sox2。与耳蜗基底膜组织共培养,拟胚体细胞虽表达神经元标记物Tuj1,但突起长度仅为18±4.7μm,无典型的神经元形态特征,说明与耳蜗基底膜共培养的模式不能诱导拟胚体细胞向形态典型的神经元分化。而我们前期研究证实,羊水干细胞接种于基底膜组织来源的内耳干细胞空心球体制备的饲养层上,饲养层细胞表达内耳支持细胞标志物P27kip1,不添加外源性神经生长因子及神经元信号诱导因子,支持接触三维培养模式下,羊水干细胞可以定向分化为功能性神经元,并表达听觉神经元标记物GATA-3,神经突起平均长度91.3μm[13]。综合以上实验结果分析,羊水干细胞向神经元方向分化,可能不依赖于基底膜来源的细胞分泌的可溶性神经生长因子及信号诱导因子,而是通过细胞间的支持接触,耳蜗基底膜来源的内耳支持细胞提供的信号转导促使羊水干细胞定向分化为功能性神经元[13]。
羊水干细胞接种在基底膜来源的内耳干细胞空心球体制备的饲养层上,无需添加外源性神经生长因子及信号诱导因子,可定向分化为功能性听觉神经元;而羊水干细胞拟胚体与基底膜片段组织共培养,无法产生形态典型的神经元。推测羊水干细胞与基底膜来源的饲养层细胞间的直接接触是羊水干细胞分化为听觉神经元的前提条件。这种接触不仅仅是二维的接触(将羊水干细胞拟胚体与耳蜗基底膜片段组织共培养),更需要将羊水干细胞接种在基底膜来源的内耳干细胞空心球体制备的饲养层表面(羊水干细胞与饲养层细胞有支持接触的关系),形成立体三维结构模式。研究表明,毛细胞的存在对听觉神经元的存活是必需的[14-16],因此本研究将羊水干细胞拟胚体与耳蜗基底膜片段组织共培养,目的在于探讨耳蜗基底膜片段组织中的毛细胞为神经元分化提供的神经营养因子,是否会诱导羊水干细胞分化为听觉神经元。本研究结果说明羊水干细胞分化为听觉神经元,并不依靠基底膜细胞或是其中的毛细胞提供的神经营养因子。羊水干细胞拟胚体与内耳基底膜片段组织形成的二维培养,因为缺乏细胞间支持接触的过程,所以羊水干细胞拟胚体无法定向分化为听觉神经元。
基底膜来源的内耳干细胞空心球体制备的饲养层细胞,表达内耳支持细胞标志物P27kip1,在体外能定向诱导羊水干细胞分化为功能性听觉神经元。内耳支持细胞在体外能促使羊水干细胞定向分化,可能是通过Wnt∕β-catenin信号通路。羊水干细胞与基底膜来源的内耳支持细胞制备的饲养层,在三维培养模式中,添加抑制剂Dkk1,检测发现神经突起的数量急剧减少,只有大约21±2.5%的羊水干细胞分化为形态典型的神经元;而不添加Wnt∕β-catenin 信号通路抑制剂 Dkk1,可观察到37±3.0%的羊水干细胞分化为神经元,且具有典型的神经元形态特征(P<0.01,One-way ANOVA);阻断Wnt信号除了导致神经突起数量的显著减少外,神经突起的长度也明显变短(P<0.01),说明可能是基底膜来源的内耳支持细胞提供的Wnt信号参与调控羊水干细胞向神经元方向的分化[13]。这个定向分化体系,依赖基底膜来源的内耳支持细胞对羊水干细胞的支持接触;内耳支持细胞可以作为一种新的神经再生支架。这些体外研究数据结果,有助于将羊水干细胞基础研究向临床治疗方面转化。
干细胞体外分化为神经细胞用于神经性耳聋的细胞替代治疗的前景已引起关注[19-21],羊水干细胞耳蜗内移植的替代治疗,具有重要的临床实用价值及可行性。羊水干细胞移植豚鼠耳蜗,基底膜是完整且未经处理的,而移植的羊水干细胞要想成功分化为神经元,需要解决以下这些实际问题:将羊水干细胞移植实验鼠耳蜗,怎样使植入的干细胞更多的向蜗管内迁移,这是首要的问题;羊水干细胞与基底膜上的内耳支持细胞形成紧密的支持接触,还是悬浮于淋巴液中,是影响结局的关键;羊水干细胞定向的迁移至基底膜上的内耳支持细胞表面,并有紧密的接触,才可能启动信号转导,定向分化为功能性神经元;基底膜来源的内耳支持细胞饲养层引发了Wnt信号细胞表面感受器及信号靶点,导致了级联放大,引起了一些相关基因的活跃,产生出大量的神经元,因此在羊水干细胞移植运用于临床的过程中,过表达Wnt-1可能有利于羊水干细胞移植分化效率,这些都有待后续进一步的体内实验证实。毕竟内耳环境,比如酸碱度浓度,离子类型和浓度等是否会对羊水干细胞的体内神经元分化造成影响,还需要体内实验进一步考量。
