响应面法优化甘薯茎中可溶性蛋白的超声辅助提取工艺
2019-10-23高琦孙怡程健刘梓蘅吴嘉乐薛友林
高琦,孙怡,程健,刘梓蘅,吴嘉乐,薛友林,*
(1.辽宁大学轻型产业学院,辽宁沈阳110036;2.中共辽宁省委党校,辽宁沈阳110161)
甘薯是属旋花科甘薯属的一年生草本植物,四百多年前由南美洲传入我国,并在我国得到广泛种植,如今我国甘薯产量约占世界的80%。甘薯富含多种营养成分以及氨基酸、维生素、黏液蛋白等多种功能因子,欧洲人评价它是“第二面包”,前苏联的科学家们说它会是未来的“宇航食品”[1]。目前我国实验室中甘薯叶的利用量较大,而甘薯茎的利用量相对较少。甘薯在我国种植及其广泛,其叶在南方作蔬菜食用,而在收获季节时易变黄萎蔫不能食用,剩下的是大量的茎,甘薯茎富含多种营养物质,其中含有大量蛋白质,有很大的开发利用价值[2-9],本试验即以甘薯茎为试验对象,探讨甘薯茎蛋白提取的优化方法。
可溶性蛋白质的提取方法有很多种,其中最常用的方法就是碱提酸沉法,除此之外还有离子交换法和超滤膜法。甘薯叶可溶性蛋白可以用碱提酸沉法,乳酸发酵酸法[10],响应面法优化纤维素酶提取叶蛋白工艺方法[11],泡沫法分离提取叶蛋白等多种方式[12],而甘薯茎可溶性蛋白的提取方法尚未开发出特别的方法,所以与大多数提取甘薯块根蛋白采用的方法相同,本试验采用碱提酸沉法提取甘薯茎中的蛋白质,该方法操作简单、条件易于控制、试验成本低,是目前提取蛋白质应用最多的方法[13]。碱性环境能够使植物细胞的紧密结构变得疏松,蛋白质更容易从细胞内部溶出,同时,体系中的料液比、pH 值以及温度也会引起蛋白质提取率的变化。近年来的研究表明,超声波辅助提取蛋白质对提取率也有一定的影响,因此,本试验先进行单因素试验来初步确定碱提酸沉法提取甘薯茎中蛋白质的主要参数,然后利用响应面法对超声波辅助提取甘薯茎蛋白的工艺条件进行了优化,为日后甘薯茎的开发利用提供理论依据[14-17]。
1 材料与方法
1.1 材料与试剂
甘薯茎:市售。
亚硫酸氢钠、氢氧化钠、盐酸、考马斯亮蓝G-250、牛血清蛋白(分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
FB124 电子电子分析天平:上海舜宇恒平科学仪器有限公司;722N 可见分光光度计:上海精密仪器有限公司;TG16G 台式高速离心机:长沙英泰仪器有限公司;PHS-3CB 型pH 计:上海越平科学仪器有限公司;SZ-500A-3 超高速多功能粉碎机:永康市善竹贸易有限公司;TH-400 BQ 型数控超声波清洗机:济宁天华超声电子仪器有限公司。
1.3 方法
1.3.1 甘薯茎可溶性蛋白提取工艺流程
将新鲜的甘薯茎烘干,进行打粉过筛,得到甘薯茎粉,取一定量的甘薯茎粉,加入一定体积的含有0.05%亚硫酸氢钠的溶液将甘薯茎粉混匀。用1 mol/L 的氢氧化钠和1 mol/L 的盐酸调节溶液的pH 值达到一定的值后,将得到的溶液放入离心机中进行离心(6 000 r/min,30 min),然后将离心后得到的上清液的pH 值调到等电点进行酸沉,搅拌3 min~5 min 后,离心(6 000 r/min,30 min),得到的沉淀物加水回溶,并将pH 值调回到7,再经冷冻干燥后即可得到甘薯茎蛋白粉[18-19]。
1.3.2 理化指标测定
1.3.2.1 水分的测定
采用GB 5009.3-2016《食品安全国家标准食品中水分的测定》,标准第一法即直接干燥法,对甘薯茎粉的水分进行测定。先把洗净的锥形瓶放于105 ℃的干燥箱中,烘1 h~2 h 后取出,冷却至室温25 ℃后进行称重,并重复上述操作直至恒重。称取甘薯茎粉样品5 g放入锥形瓶中,称重后用纸巾封口放入烘箱中,在105 ℃下烘2 h,取出锥形瓶冷却至室温25 ℃后去掉纸巾进行称重,重复上述操作至两次称重差值不超过0.4 mg 为止。水分含量按以公式计算:
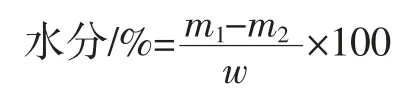
式中:m1为干燥前锥形瓶与样品的总重量,g;m2为干燥后锥形瓶与样品的总质量,g;w 为样品的质量,g。
1.3.2.2 国标法测定甘薯茎总蛋白含量
原料中蛋白质含量参照GB 5009.5-2016《食品安全国家标准食品中蛋白质的测定》[20]凯氏定氮的方法进行测定:

式中:V1为消化液消耗盐酸标准滴定液的体积,mL;V2为空白试液消耗盐酸标准滴定液的体积,mL;V3为消化液的体积,mL;c 为盐酸标准滴定溶液浓度,mol/L。
1.3.2.3 考马斯亮蓝法测定可溶性蛋白质含量
考马斯亮蓝G-250 的配制:称取考马斯亮蓝G-250样品100 mg,将其溶解于50 mL 90%的乙醇中,再加入85%的磷酸100 mL,最后在容量瓶中定容至1 000 mL,获考马斯亮蓝G-250 溶液,将制得的溶液用中性滤纸过滤,放在棕色瓶中保存以备用。
标准曲线的绘制:取6 支试管,分别加200 μg/mL牛血清蛋白标准溶液 0.0、0.02、0.04、0.06、0.08、0.10 mL,各管以去离子水补齐至0.5 mL。各管加考马斯亮蓝G-250 工作液2.5 mL,旋涡混合器混匀,2 min 后于分光光度计595 nm 处测吸光值,1 h 内测完。以试管中牛血清白蛋白微克数为横坐标,吸光值为纵坐标,绘制牛血清白蛋白标准曲线。
1.3.2.4 可溶性蛋白的提取率
本试验中蛋白质提取率以甘薯茎中可溶性蛋白占总蛋白比率为指标。甘薯茎中可溶性蛋白提取率用以下公式计算。
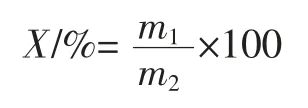
式中:X 为甘薯茎中可溶性蛋白提取率,%;m1为可溶性蛋白质量,g;m2为总蛋白的质量,g。
1.3.3 单因素试验
1.3.3.1 料液比对甘薯茎可溶性蛋白质的提取率的影响
在提取液pH 值为10.0,酸沉pH 值为4.5 的条件下,分别设定料液比为 1 ∶1、1 ∶20、1 ∶30、1 ∶40、1 ∶50、1 ∶60、1 ∶70、1 ∶80(g/mL)进行试验,计算甘薯茎蛋白在不同的料液比之下的提取率,进而得到最佳的料液比。
1.3.3.2 碱提pH 值对甘薯茎可溶性蛋白提取率的影响
称取10 份甘薯茎粉,每份5 g,配制0.05%的亚硫酸氢钠溶液 1 500 mL,以 1 ∶30(g/mL)的料液比将甘薯茎粉溶解,调节 pH 值(分别为 7.0、8.0、8.5、9.0、9.5、10.0、10.5、11.0、11.5、12.0)进行蛋白质的提取,计算出甘薯茎蛋白在不同的pH 值下的提取率,以得到最佳的碱提pH 值。
1.3.3.3 酸沉pH 值对甘薯茎可溶性蛋白质的提取率的影响
在料液比为 1 ∶40(g/mL),碱提 pH 值为 10.0 的条件下,分别设定酸沉 pH 值为 3.0、3.5、4.0、4.5、5.0 进行蛋白质提取,计算甘薯茎蛋白在不同的酸沉pH 值下的提取率,确定最佳的酸沉pH 值。
1.3.3.4 超声功率对甘薯茎可溶性蛋白质的提取率的影响
在料液比为 1 ∶40(g/mL),碱提 pH 值为 10.0,酸沉pH 值为4.0,超声温度为40 ℃的条件下,设定不同的超声功率(分别为 160、240、320、400 W)对甘薯茎中的蛋白质进行提取,计算甘薯茎蛋白在不同的超声功率下的提取率,确定最佳的超声功率。
1.3.3.5 超声时间对甘薯茎可溶性蛋白质的提取率的影响
在料液比为 1 ∶40(g/mL),碱提 pH 值为 10.0,酸沉pH 值为4.0,超声功率为240 W,超声温度为40 ℃的条件下,设定不同的超声时间(分别为10、20、30 min)对甘薯茎蛋白进行提取,计算甘薯茎蛋白在不同的超声时间下的提取率,确定最佳的超声时间。
1.3.3.6 超声温度对甘薯茎可溶性蛋白质的提取率的影响
在料液比为 1 ∶40(g/mL),碱提 pH 值为 10.0,酸沉pH 值为4.0 的条件下,分别设定超声温度为20、30、40、50 ℃对甘薯茎可溶性蛋白进行提取,计算甘薯茎可溶性蛋白不同的超声温度下的提取率,最终确定最佳的超声温度。
1.3.4 Box-Behnken 试验设计
利用Design-Expert8.0.6 软件,应用Box-Behnken设计,把甘薯茎可溶性蛋白质提取率做为响应值,比较各因素对响应值的影响,并对主要影响因素进行优化试验,从中筛选出甘薯茎可溶性蛋白质的最优提取条件。根据Box-Behnken 试验设计原理[21],对超声时间(A)、超声温度(B)、超声功率(C)3 个影响因素进行单因素试验。在单因素试验的基础上,确定响应面试验的因素和水平,进行回归拟合建立回归模型见表1。

表1 Box-Behnken 试验设计因素水平Table 1 Factors and levels used in Box-Behnken design
1.4 试验设计及数据分析
试验每组处理重复3 次,取平均值作为结果。采用OriginLab Origin Pro v7.5 软件对数据进行制图和分析;Design-Expert8.0.6 软件进行响应面设计和结果分析。
2 结果与分析
2.1 考马斯亮蓝G-250 标准曲线
测定6 个浓度的牛血清蛋白在波长595 nm 处的吸光值,以每个浓度的平均吸收值(A595)为纵坐标,蛋白质溶液浓度为横坐标,绘制标准曲线见图1。由图1可知得到曲线方程为:Y=0.007 6X-0.003,R2=0.997 9,经显著性检验,回归关系达到显著水平。
2.2 单因素试验结果
2.2.1 料液比对甘薯茎蛋白提取率的影响
料液比对甘薯茎蛋白提取率的影响见图2。
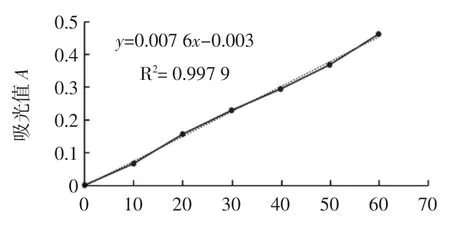
图1 考马斯亮蓝G-250 标准曲线Fig.1 The standard curve of the coomassie brilliant blue G-250 solution
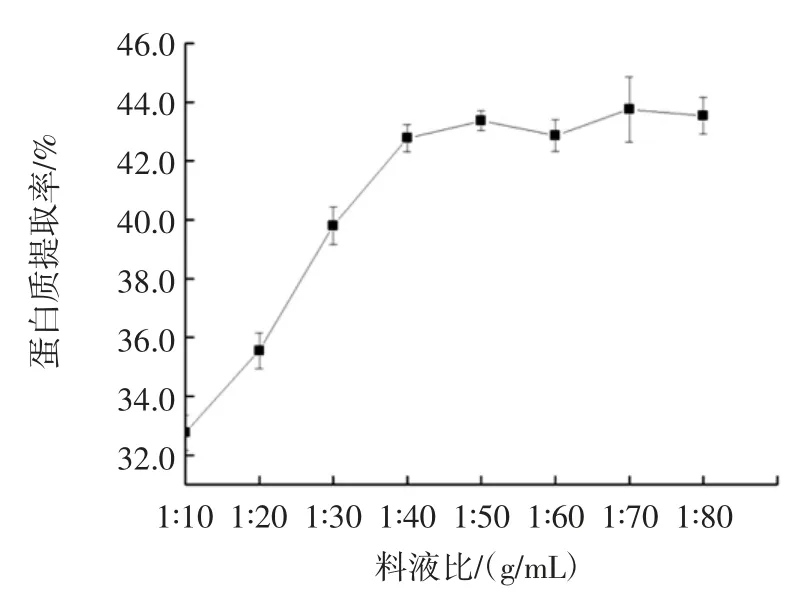
图2 料液比对甘薯茎蛋白提取率的影响Fig.2 Effect of solid/liquid ratio on the yield of sweet potato stem proteins
甘薯茎中的可溶性蛋白质的提取率随着料液比的增加而增加,其增速先快后缓慢。在料液比为1 ∶10(g/mL)时,蛋白质的提取率最低,为 33.73%,此后随着料液比的增加,蛋白质提取率也增加,在料液比为 1 ∶40(g/mL)时,提取率达到 43.05%,这是由于在料液比较低时,甘薯茎粉得不到充分的溶解,因此蛋白质的溶出速率也较低。随着提取液的量的增加,稀释作用变强,提取液的黏度降低,蛋白质的浓度也降低,蛋白质的溶出量增加,从而使提取率增加[22]。当料液比大于1 ∶40(g/mL)时,溶液的黏度以及蛋白质的浓度都很低,随着溶液的稀释,蛋白质的溶解增加作用不再显著,因此,蛋白质提取率的增加变得缓慢。综上所述,以及结合经济方面因素,选择 1 ∶40(g/mL)为最佳的料液比。
2.2.2 碱提pH 值对甘薯茎蛋白提取率的影响
碱提pH 值对甘薯茎蛋白提取率的影响见图3。
甘薯茎蛋白随着抽提pH 值的增加,提取率先升高后降低。在pH 值在7~10 时,甘薯茎的蛋白质提取率随着pH 值的增加而升高,当pH 值为10 时提取率达到最大值,为42.15%。这是由于碱液能使细胞自身的紧密结构变得疏松,破坏蛋白质的氢键,使蛋白质分子表面带同种电荷,从而提取率升高。当pH 值大于10 时,由于碱性过度引起了脱羧、脱氨和肽键的断裂,导致蛋白质变性和过度水解,同时提取物中的非蛋白质物质含量增加,蛋白质提取率降低[22-25]。因此选取pH10 为最佳的碱提pH。
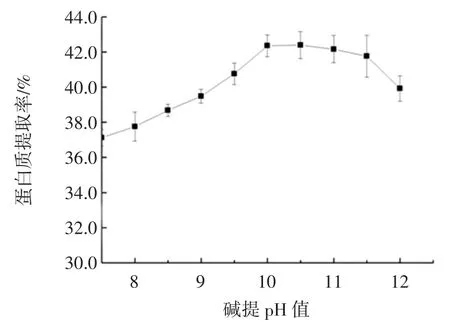
图3 碱提pH 对甘薯茎蛋白提取率的影响Fig.3 Effect of extraction pH on the precipitation of sweet potato stem proteins
2.2.3 酸沉pH 值对甘薯茎蛋白提取率的影响
酸沉pH 值对甘薯茎蛋白提取率的影响见图4。
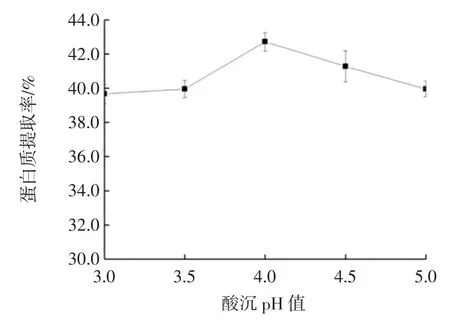
图4 pH 对甘薯茎蛋白提取率的影响Fig.4 Effect of pH on the yield of sweet potato stem proteins
随着pH 值的增加,甘薯茎蛋白的提取率先升高后降低,在pH 值等于4 时,蛋白质提取率达到最大,为43.27%,这是因为蛋白质颗粒在等电点时溶液中不存在同种电荷的相互排斥作用,容易发生相互碰撞而沉淀,因此最佳酸沉pH 值为4。
2.2.4 超声功率对甘薯茎蛋白提取率的影响
超声功率对甘薯茎蛋白提取率的影响见图5。
随着超声功率的增加,甘薯茎蛋白的提取率先升高后降低而后又有小幅上升,这可能是由于微波功率过大易造成温度过高使蛋白质分解,导致蛋白质的得率降低[26]。综上所述,选择240 W 为最佳超声功率。
2.2.5 超声时间对甘薯茎蛋白提取率的影响
超声时间对甘薯茎蛋白提取率的影响见图6。
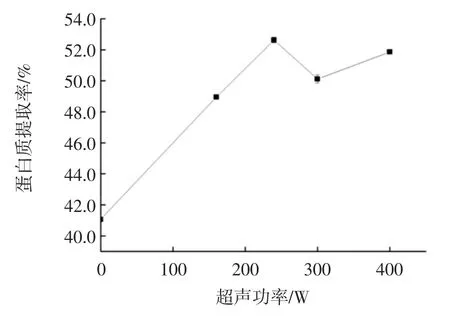
图5 超声功率对甘薯茎蛋白提取率的影响Fig.5 Effect of ultrasonic power on the yield of sweet potato stem proteins

图6 超声时间对甘薯茎蛋白提取率的影响Fig.6 Effect of ultrasonic time on the yield of sweet potato stem proteins
随着超声时间的增加,甘薯茎蛋白的提取率先升高后降低。当超声时间小于20 min 时,超声波空化作用强,使细胞破碎程度增大,加速了细胞内蛋白质的溶出,当时间超过20 min 时,随着时间的延长部分蛋白质变性,甘薯茎粉颗粒表面对蛋白的吸附力增强[26-29],使蛋白质溶出量下降。因此选择20 min 为最佳超声时间。
2.2.6 超声温度对甘薯茎蛋白提取率的影响
超声温度对甘薯茎蛋白提取率的影响见图7。

图7 超声温度对甘薯茎蛋白提取率的影响Fig.7 Effect of ultrasonic temperature on the yield of sweet potato stem proteins
随着超声温度的升高,蛋白质质量增加,但是随温度升高蛋白质纯度先升高后降低,推测多糖等物质也因超声而沉淀析出[26-29],因此选择40 ℃时为最佳。
2.3 超声协同碱提酸沉工艺的优化
2.3.1 响应面试验结果及方差分析
根据单因素试验结果,选取合理的因素和水平进行响应面试验,确定最佳的提取条件。甘薯茎蛋白提取的Box-Benhnken 试验结果见表2。
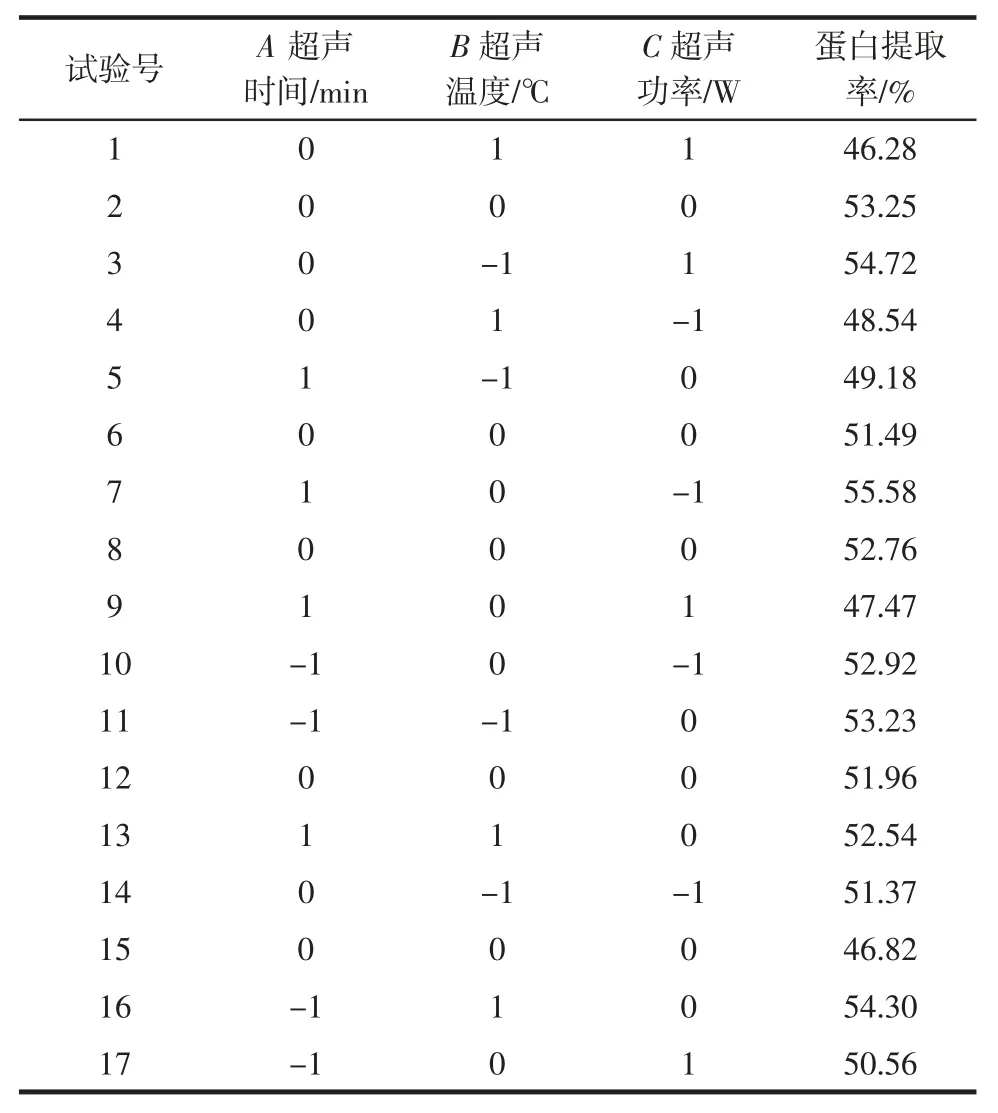
表2 Box-Behnken 试验设计结果Table 2 Box-Behnken design with experimental results
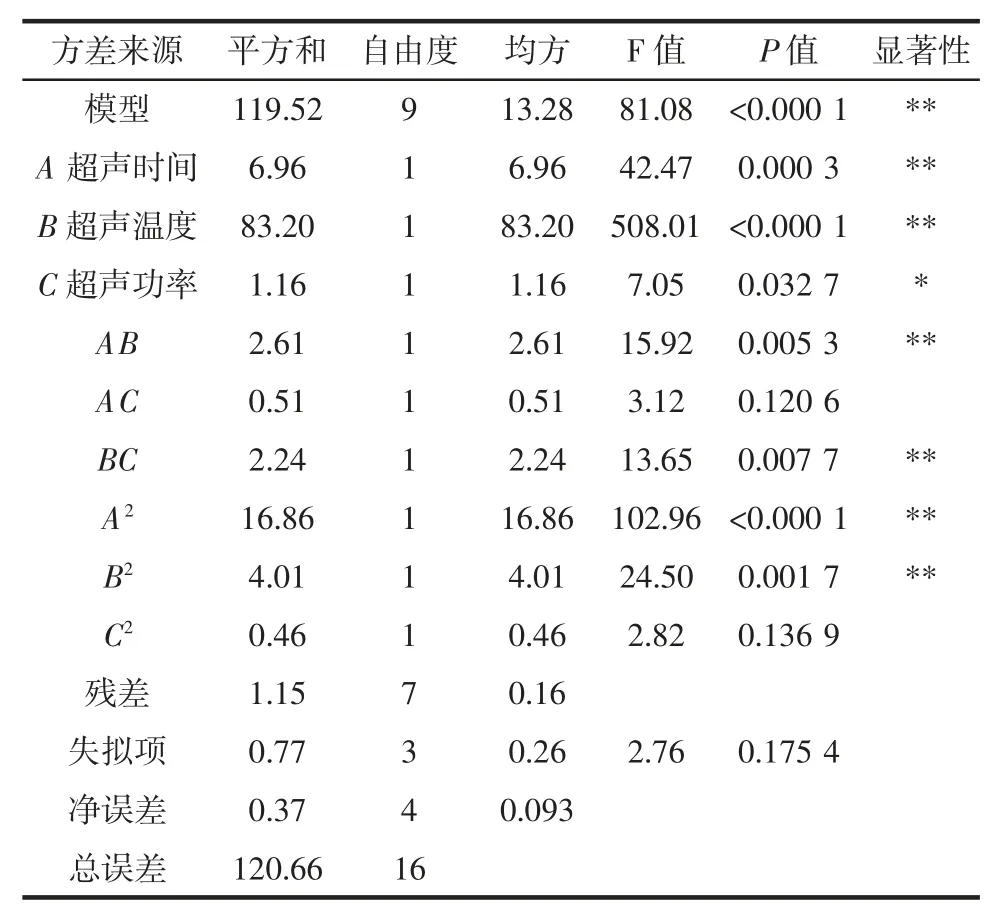
表3 响应面试验回归模型方差分析Table 3 Analysis of variance for the fitted regression model
利用设计软件Design-Expert 对数据进行多元回归拟合,获得超声时间(A)、超声温度(B)、超声功率(C)的二次回归方程为:
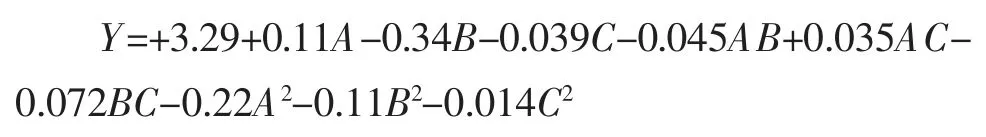
从表3 中可以看出,模型的P<0.000 1,模型显著,失拟项P=0.157 9,失拟项不显著。由F 值的大小可以看出各因素影响结果的主次顺序为B(超声温度)>A(超声时间)>C(超声功率)。模型的确定系数为R2=0.984 0,表明模型能够解释绝大多数因变量变化。综上所述,模型拟合良好,模型成立。
2.3.2 各因素交互作用的响应面分析
为了对超声时间(A)、超声温度(B)以及超声功率(C)3 者之间的交互作用进行更进一步的探究,并确定最优点,对得到的模型使用降维法,得到两种因素的回归模型,并通过Design-Expert 8.0 软件绘制出响应面曲线图,以便进行更直观的分析。图8a~d 分别显示了2 组以甘薯茎蛋白提取率为响应值的趋势图,从图中可以直观地看出两变量交互作用的显著程度。

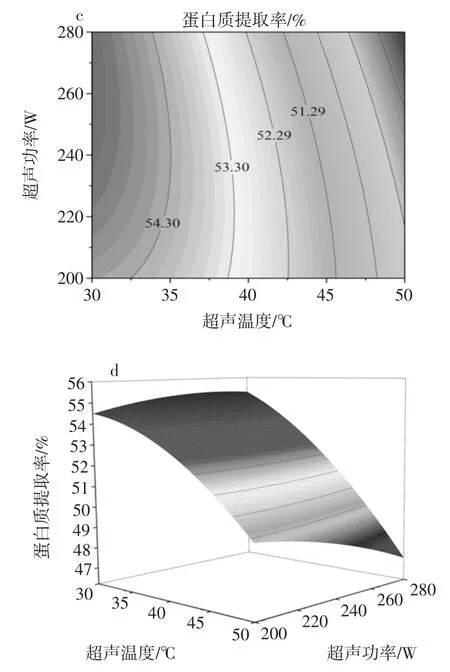
图8 响应面分析图和相应等高图Fig.8 Response surfaces and contour plots for the interactions
图8a~d 直观的反映出了各个因素之间的交互作用对响应值的影响。从图8a 和图8b 可知,当超声时间一定时,甘薯茎蛋白的提取率随着超声温度的增加先增加后减少,当超声温度一定时,随着超声时间的增加,甘薯茎蛋白提取率呈上升趋势,从等高线的图形和疏密程度可知,超声时间和超声温度的交互作用明显,超声温度对提取率的影响稍大于超声时间。从图8c 和图8d 可知,当超声功率一定时,随着超声温度的增加,甘薯茎蛋白的提取率减少,由等高线的形状及其疏密程度可知,超声温度和超声功率的交互作用较显著,超声温度对甘薯茎蛋白的提取率的影响大于超声功率的影响。
2.3.3 最优工艺的确定与验证
通过Design-Expert 8.0.6 软件分析,得到甘薯茎蛋白最佳提取工艺参数为超声温度30 ℃、超声时间25 min,超声功率280 W,此条件下得到蛋白理论提取率为51.75%,对优化参数进行3 次重复验证,蛋白提取率为48.75%,蛋白质纯度为46.27%。软件的预测值与验证试验所得的结果较为接近,偏差较小。该结果说明利用响应面法对提取工艺进行的优化,其结果较为准确、可靠,有一定的实用价值。
3 结论
依照单因素试验得出的结果确定出提取甘薯茎蛋白的最佳提取条件为:碱提pH10,料液比为1 ∶40(g/mL),酸沉 pH4,提取温度为 40 ℃,超声功率为240 W,超声时间为20 min。然后在单因素试验的基础上,利用响应面法,选取超声温度、超声时间和超声功率作为3 个影响因素进行分析,经试验得到各因素对甘薯茎蛋白提取率的影响大小依次为:超声温度>超声时间>超声功率,最佳提取工艺为超声温度30 ℃,超声时间25 min,超声功率280 W,此条件下甘薯茎蛋白提取率的理论值为51.75%。以得到的最佳条件做3 组试验进行验证,得到甘薯茎蛋白的提取率为48.75%,并测得所得的蛋白质纯度为46.27%,预测值与实际试验所得值较为接近,试验结果比较理想。
