伊曲康唑对K562 细胞增殖及HUVEC 细胞血管形成的影响
2019-10-23萨旭仁贵吴昱含滕玉鸥
张 倩,萨旭仁贵,吴昱含,杨 阳,刘 振,滕玉鸥
(天津科技大学生物工程学院,天津 300457)
伊曲康唑(图1),分子式为 C35H38Cl2N8O4,是临床应用广泛的抗真菌药物,属于三唑类抗真菌药物家族的关键成员.它存在于世界卫生组织的基本药物清单上,是基本卫生系统中最重要的药物之一,其安全性毋庸置疑[1].目前可用的口服抗真菌剂伊曲康唑是一种有效的Hedgehog 途径拮抗剂[2],通过抑制羊毛固醇14α 去甲基化酶(麦角固醇合成的关键酶)破坏真菌细胞膜结构完整性,从而使真菌生长受到有效抑制[3].
近年来的报道显示,伊曲康唑对多种肿瘤均具有抑制作用.当伊曲康唑与顺铂联合使用时,对人非小细胞肺癌原代异种移植模型中的肿瘤的抑制作用被显著增强[4];当其与贝伐单抗联合应用于胃肠癌的治疗时,抗癌作用也明显增强[5].研究[6]发现,伊曲康唑和紫杉醇协同可以抑制上皮性卵巢癌细胞原位异种移植模型中的肿瘤生长,并认为伊曲康唑是通过靶向作用于Hedgehog 和mTOR 通路在内的多种途径选择性地抑制内皮细胞而发挥抑制作用.此外,伊曲康唑还可以抑制前列腺癌小鼠模型中的肿瘤生长和转移[3],老年人面部皮肤最常见的基底细胞癌也受到明显抑制[7].因此,研究者们一致认为,古老的抗真菌药物伊曲康唑可以作为潜在的抗肿瘤药物被进一步开发[3-7].
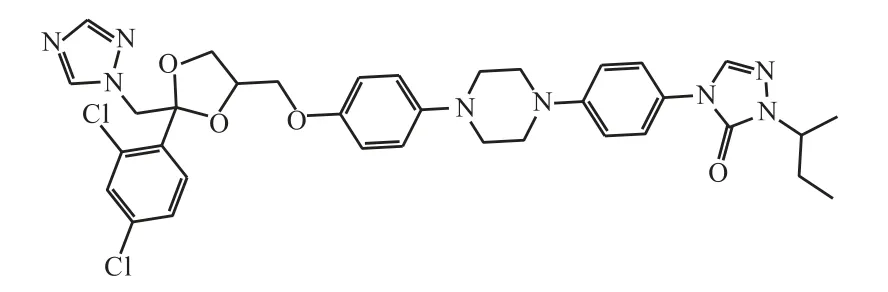
图1 伊曲康唑的结构Fig.1 Structure of Itraconazole
肿瘤患者免疫功能低下的同时还要接受放射治疗、化学治疗,极易发生真菌感染.真菌感染已成为晚期肿瘤患者常见的并发症和死亡原因.伊曲康唑联合抗肿瘤药物的治疗方案具有抗肿瘤和抑制真菌感染的双重功效.Kurosawa 等[8]前期研究发现,伊曲康唑对阿霉素和依托泊苷治疗人白血病产生的耐药性具有逆转作用,认为其可作为恢复急性白血病多药耐药性的有力候选者,并具有抗真菌作用.王静等[9]研究发现,伊曲康唑与多柔比星合用可明显抑制人急性髓系白血病细胞KG1α 的增殖.但是,单独使用伊曲康唑抑制人白血病的增殖作用却鲜有报道.
此外,白血病抑制因子(LIF)及其受体是一种与干细胞增殖密切相关的重要分子,相关研究认为LIF及其受体在血管瘤的发生、发展过程中可能发挥了积极作用[10].同时,冉玉平等[11]研究发现:6 例婴儿血管瘤患者通过口服伊曲康唑治疗后,病情都于第1 个月内得到控制,3 个月即有显著的临床改善.他们认为使用伊曲康唑治疗血管增生性疾病有望成为一种安全、方便的治疗手段,然而,具体作用机制尚不清楚.
因此,本文将在前期研究的基础上,采用MTT法测定细胞存活率、计数法绘制增殖曲线、显微镜观察法记录细胞形态学变化、Annexin V-FITC/PI 双染法检测细胞凋亡情况、PI 染色法检测细胞周期变化以及血管形成实验测定伊曲康唑对管腔形成的抑制作用,研究伊曲康唑抑制人慢性髓原白血病细胞株K562 细胞增殖的作用及对肿瘤细胞血管生成的影响.
1 材料与方法
1.1 材料
人慢性髓原白血病细胞株K562、人早幼粒白血病细胞株HL-60、人急性T 淋巴细胞白血病细胞株Jurkat、人结肠癌细胞株 HCT-116、人肝癌细胞株HepG2、人脐静脉内皮细胞HUVEC,以上细胞株均由天津科技大学生物工程学院药物设计与合成研究室保存.人乳腺癌细胞MDA-MB-468,美国菌种保藏中心(ATCC).
PRMI-1640 细胞培养基、DMEM/F12(1∶1)培养基、DMEM 低糖培养基、DMEM 高糖培养基、青霉素-链霉素溶液、巴西胎牛血清、0.25%胰蛋白酶(1×)溶液,赛默飞世尔科技公司.
伊曲康唑,分析纯,萨恩化学技术(上海)有限公司;喜树碱(CPT),分析纯,北京偶合科技有限公司;MTT、RNase,北京索莱宝科技有限公司;浓盐酸、异丙醇,分析纯,国药集团化学试剂有限公司;二甲基亚砜,分析纯,美国Amresco 公司;Annexin V-FITC凋亡试剂盒,天津三箭生物技术有限公司;无水乙醇,分析纯,天津市盛迪达贸易有限公司;碘化丙啶(PI),西格玛奥德里奇中国有限公司;Triton X-100,宝生物工程(大连)有限公司.
超净工作台,苏州净化设备厂;Model 3100 series型CO2培养箱,赛默飞世尔科技公司;TX323L 型电子分析天平,岛津国际贸易有限公司;Infinite F50 型基础酶标仪,帝肯(上海)贸易有限公司;CKX41 型奥林巴斯倒置显微镜,奥林巴斯(中国)有限公司;TISR 型尼康荧光倒置显微镜,尼康仪器(上海)有限公司;循环水式真空泵、LX-300 型迷你离心机、VORTEX-6 型漩涡混合器,海门市其林贝尔仪器制造有限公司;342976 型流式细胞仪,碧迪医疗器械(上海)有限公司;YXQ-LS-50SI 型立式压力蒸汽灭菌锅,上海博迅实业有限公司.
1.2 方法
1.2.1 细胞增殖实验
采用MTT 法检测细胞存活率.将处于对数生长期的K562 细胞、HL-60 细胞、Jurkat 细胞、HCT-116细胞、HepG2 细胞、MDA-MB-468 细胞以及HUVEC细胞,1×PBS 清洗后分别用0.25%胰蛋白酶消化(贴壁细胞),接种于96 孔培养板内,细胞密度为5×104mL-1,每孔接种体积为100µL.将孔板置于37 ℃、5% CO2培养箱中孵育一定时间(悬浮细胞孵育2 h,贴壁细胞孵育24 h).每组设3 个平行孔,每孔加入化合物体积为0.5µL.伊曲康唑实验组和CPT 阳性对照组的加药终浓度为0.01、0.1、1、10、100µmol/L.同时,设置等体积DMSO 溶剂为对照组.将孔板置于37 ℃、5% CO2培养箱孵育48 h 后,每孔加入5 mg/mL MTT 20µL,继续孵育4 h 后终止培养.贴壁细胞吸去孔内培养基,每孔加入100µL DMSO;悬浮细胞每孔直接加入100µL 盐酸-异丙醇溶液后吹打混匀,置于37 ℃培养箱中10 min 臜使甲 结晶充分溶解后,使用酶标仪(贴壁细胞选择490 nm、620 nm;悬浮细胞选择580 nm、620 nm)测定吸光度(A).按照式(1)计算细胞存活率,并计算半数有效抑制浓度IC50值.
1.2.2 K562 细胞增殖曲线绘制
将处于对数生长期的K562 细胞以细胞密度为5×104mL-1接种于24 孔板上,每孔1 mL,同时设置对照孔;37 ℃、5% CO2培养箱中培养2 h,分别加入终浓度为 1、3、10、30µmol/L 伊曲康唑,每孔5µL.对照孔为细胞悬液中仅加入含相同浓度DMSO.再将孔板置于37 ℃、5% CO2恒温培养箱中,孵育0、24、48、72、96、120 h,对不同处理时间不同加药浓度的细胞分别进行计数,每组细胞计数3次,计算平均值并使用GraphPad Prism 5 进行数据分析.
1.2.3 K562 细胞形态学观察
将处于对数生长期的K562 细胞以5×104mL-1细胞密度接种于6 孔板,每孔2 mL,同时设置对照孔.孔板置于37 ℃、5% CO2培养箱中培养2 h,分别加入伊曲康唑终浓度为1、3、10、30µmol/L,每孔10µL.对照孔细胞悬液中仅加入相同体积DMSO.再将孔板置于37 ℃、5% CO2恒温培养箱中分别孵育24 h 和48 h,在对应的时间点使用显微镜观察K562 细胞的形态变化,并进行图像采集.
1.2.4 Annexin V-FITC/PI 双染法检测伊曲康唑对K562 细胞凋亡的影响
将处于对数生长期的K562 细胞以5×104mL-1细胞密度接种于6 孔培养板,每孔2 mL,置于37 ℃、5% CO2的培养箱中培养2 h 后,分别加入终浓度为1、3、10、30µmol/L 的伊曲康唑;培养箱孵育48 h后,1 000 r/min 离心5 min,弃上清液,用预冷的1×PBS 吹悬细胞,2 500 r/min 离心5 min,再次弃去上清液,冰浴;加入100µL 1×Binding Buffer 重悬细胞,转移至室温下进行染色.首先,加入5µL Annexin VFITC,轻轻振荡混匀,避光孵育10 min;然后再加入20µg/mL PI 5µL,轻轻吹打混匀,避光孵育5 min;最后补加400µL 1×Binding Buffer 并立即使用流式细胞仪进行测试,实验需在1 h 内完成,防止FITC 及PI 荧光淬灭影响实验结果的准确性.
1.2.5 PI 染色检测伊曲康唑对K562 细胞周期的影响
将处于对数生长期的K562 细胞以5×104mL-1细胞密度接种于6 孔培养板中,每孔2 mL,置于37 ℃、5% CO2培养箱中培养2 h,分别加入伊曲康唑终浓度为1、3、10、30µmol/L;培养箱孵育48 h 后,收集细胞,2 500 r/min 离心5 min,弃去上清液,加1×PBS 缓冲液将细胞吹悬,2 500 r/min 离心5 min,再次弃去上清液;加入1 mL 75%的乙醇于4 ℃固定过夜,1 000 r/min 离心5 min,弃固定液;用1 mL 1×PBS 洗涤1 次,1 000 r/min 离心5 min,弃去PBS;用500µL PBS(含有50µg/mL PI、100µg/mL RNase A、0.2% Triton X-100)4 ℃避光染色30 min,然后使用流式细胞仪检测,最后使用Modfit 软件分析PI 荧光强度图.
1.2.6 基质胶血管形成实验检测伊曲康唑对HUVEC细胞管腔形成的影响
基质胶MatrigeL 是从小鼠肉瘤中抽提得到的可溶性的基底膜抽提物.在室温下可聚合成一种具有生物活性的基质材料,上皮细胞可以在上面形成管状结构,因此可以利用内皮细胞的这种特性来研究药物对血管形成的影响.
取出已预冷的96 孔板,向每孔中加入50µL 基质胶原液,轻轻晃动使之均匀分布,要注意避免产生气泡.再将96 孔板放入37 ℃、5% CO2培养箱内孵育30 min,使基质胶原液凝固.
使用0.25%的胰蛋白酶消化HUVEC 细胞,吹打均匀后在每组实验孔内接种100µL 细胞密度为1×105mL-1的单细胞悬液,每组设3 个复孔.待细胞贴壁后,分别加入浓度为0(用0.5% DMSO 代替)、0.1、1、10、100µmol/L 的伊曲康唑,放置于37 ℃、5%CO2培养箱培养12 h.在荧光倒置显微镜下观察各组细胞管状结构的形成情况并随机对其进行拍照记录,最后对管状结构数量进行计数并作图.
2 结果与分析
2.1 伊曲康唑对不同肿瘤细胞增殖的影响
通过MTT 法对6 株不同的肿瘤细胞进行了体外抗肿瘤活性测试,发现伊曲康唑对白血病细胞,尤其是K562 细胞的抑制作用最为显著(表1).伊曲康唑抑制K562、HL-60 细胞增殖的IC50值分别为(3.04±2.30)、(6.62±1.74)µmol/L,而伊曲康唑抑制Jurkat、HCT-116、HepG2 及MDA-MB-468 细胞增殖的IC50值均大于100µmol/L.本文选择K562 细胞株展开伊曲康唑抗肿瘤作用的后续研究.
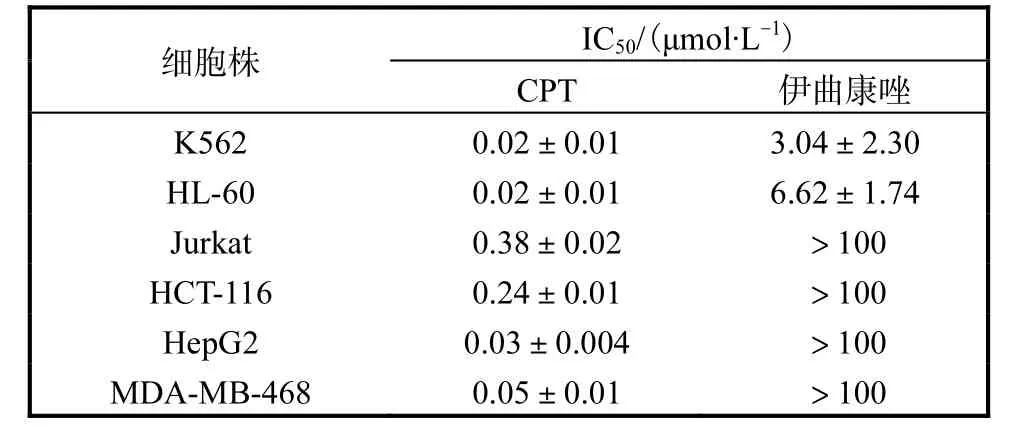
表1 MTT法检测伊曲康唑抑制肿瘤细胞增殖的IC50值Tab.1 MTT assay for IC50 values of Itraconazole on tumor cells
2.2 伊曲康唑对K562细胞增殖的影响
伊曲康唑对K562 细胞增殖的影响如图2 所示.由图2 可知:浓度为1 µmol/L 伊曲康唑作用于K562 细胞时,细胞的增殖并未受到明显抑制.然而当伊曲康唑的浓度分别提高到3、10、30 µmol/L 作用于K562 细胞0、24、48、72、96、120 h 时,细胞的增殖能力明显受到抑制,伊曲康唑浓度越大、作用时间越长,K562 细胞生长受到的抑制作用越明显.结果表明,伊曲康唑抑制K562 细胞生长的作用十分显著且呈现出了浓度与时间的依赖性.

图2 伊曲康唑对K562细胞增殖的影响Fig.2 Effect of Itraconazole on K562 cells proliferation
2.3 伊曲康唑对K562细胞形态学的影响
细胞在凋亡过程中以及周期受到阻滞时均会出现明显的形态学变化.伊曲康唑对K562 细胞形态学的影响如图3 所示.通过普通光学显微镜(放大400倍)观察发现:空白对照组的K562 细胞生长状态较旺盛,形态呈圆形,整体光亮;而伊曲康唑处理后K562 细胞出现凋亡小体、细胞变长或细胞皱缩的现象.细胞凋亡的早期主要表现为包浆形成空泡,空泡与细胞分离后最终导致细胞破碎形成凋亡小体.细胞形态呈长条状则提示伊曲康唑对K562 细胞的细胞周期可能存在阻滞的作用.于是,在接下来的实验中进一步验证伊曲康唑对K562 细胞凋亡和细胞周期的影响.
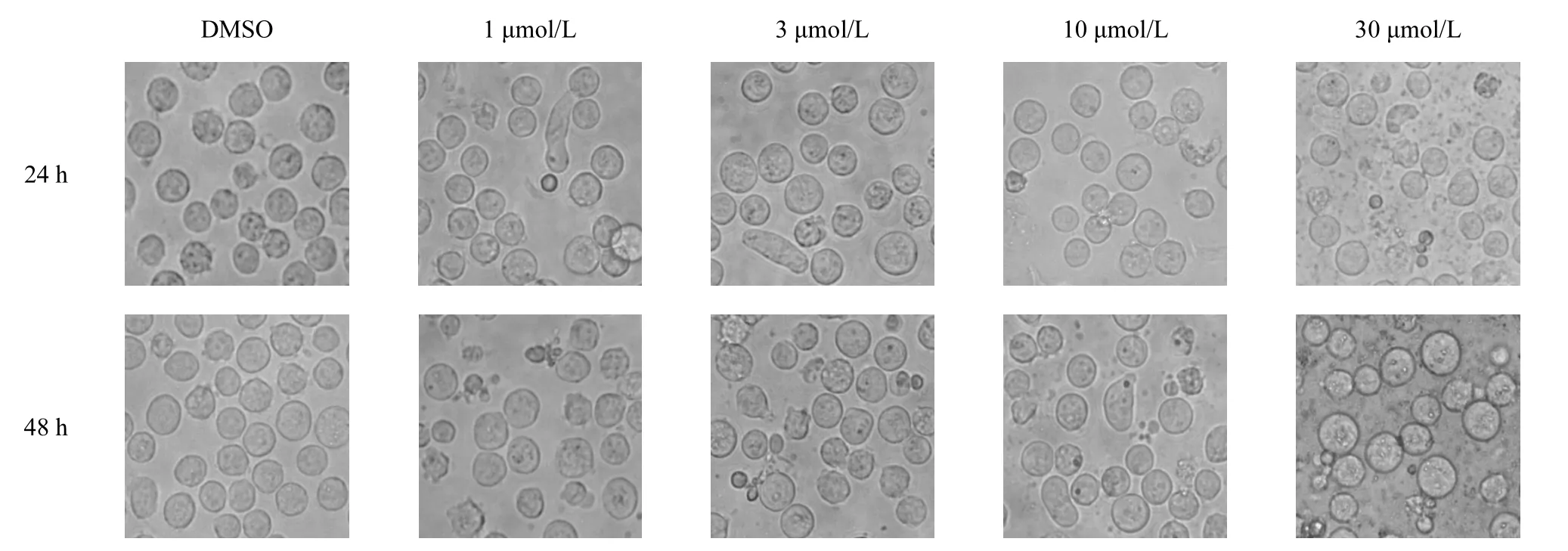
图3 伊曲康唑对K562细胞形态学的影响Fig.3 Effect of Itraconazole on K562 cells morphology
2.4 伊曲康唑对K562细胞凋亡的影响
细胞凋亡是细胞高度有组织的程序性死亡过程,故又被称为程序性细胞死亡.凋亡介导的细胞死亡在正常发育和组织稳态的维持中都具有重要意义,对于肿瘤的发生也具有十分重要的作用[12].在前期细胞形态学变化的基础上,使用流式细胞仪进一步定量检测DMSO 与伊曲康唑作用K562 细胞48 h 后细胞凋亡的结果,结果如图4 所示.正常对照细胞早期凋亡、晚期凋亡细胞比例分别为1.08%和2.48%;低浓度伊曲康唑(1µmol/L)处理的K562 细胞早期凋亡、晚期凋亡细胞比例分别为1.12%和3.92%;较高浓度伊曲康唑(3 µmol/L)作用下K562 细胞早期凋亡、晚期凋亡细胞比例分别为 2.14%和 9.53%;而 10µmol/L 伊曲康唑作用的K562 细胞早期凋亡、晚期凋亡细胞比例逐步增加,分别为4.60%和10.53%;采用更高浓度的伊曲康唑(30 µmol/L)处理后,K562 细胞细胞早期凋亡、晚期凋亡细胞比例升高,分别为4.35%和12.57%.
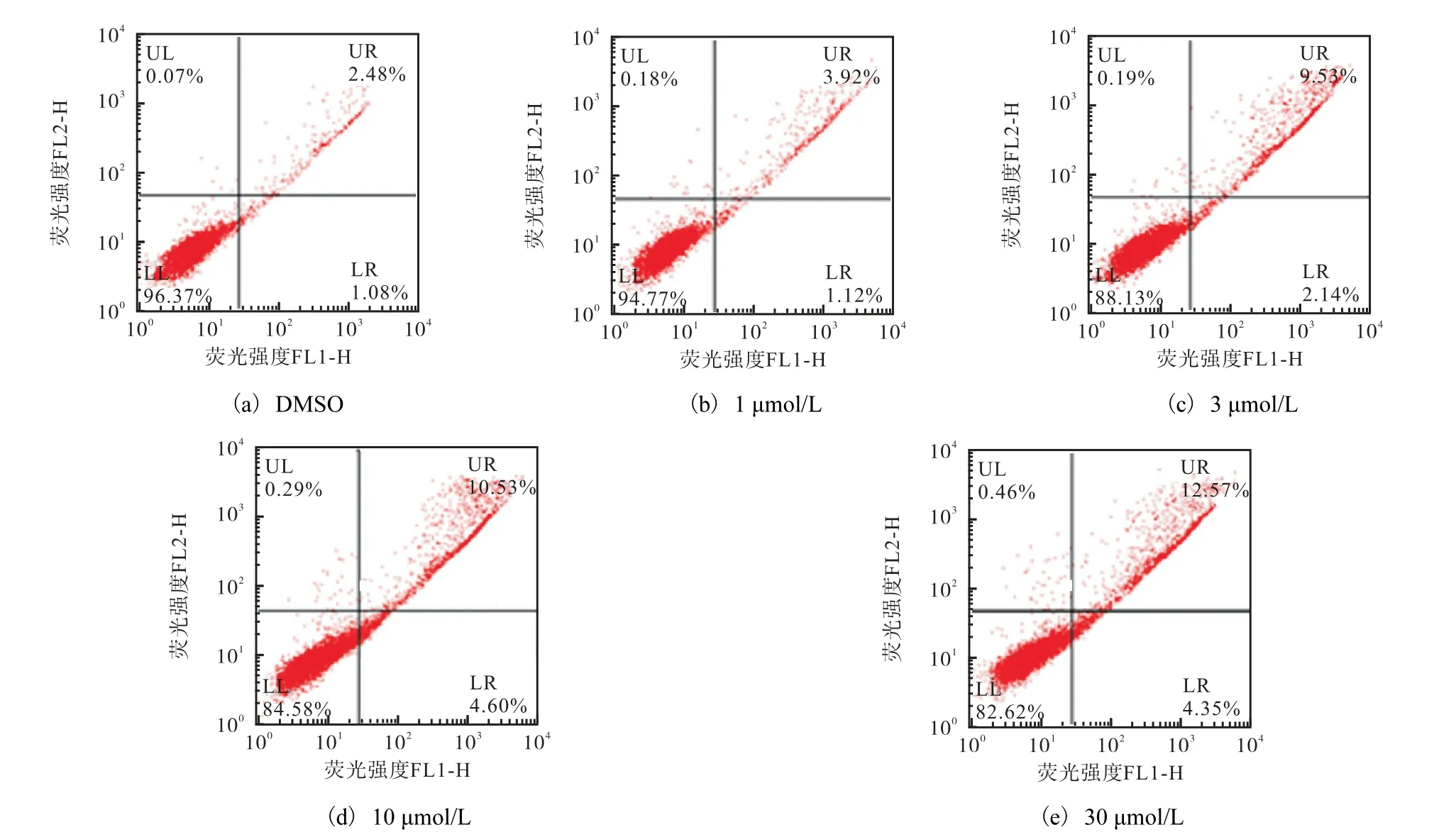
图4 伊曲康唑对K562细胞凋亡的影响Fig.4 Effect of Itraconazole on apoptosis of K562 cells by staining with Annexin V/PI
伊曲康唑诱导K562 细胞凋亡率的分析如图5所示.
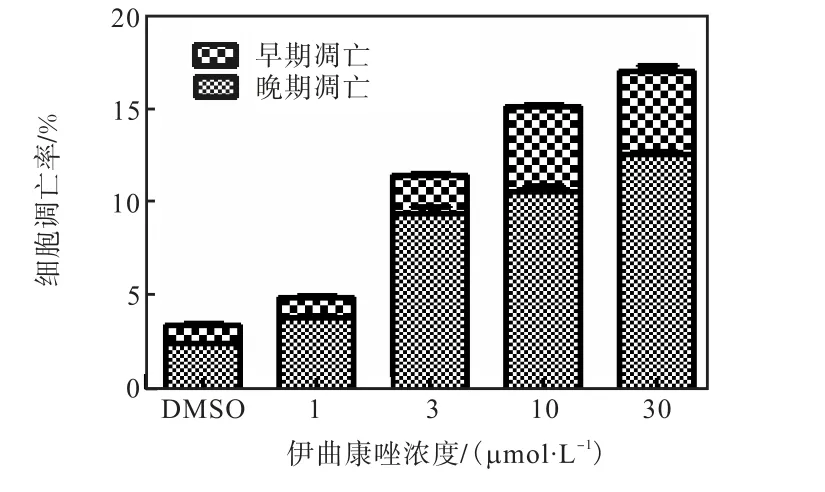
图5 伊曲康唑诱导K562细胞凋亡率的分析Fig.5 Itraconazole-induced apoptotic rate of K562 cells
由图5 可知,相同作用时间下,30µmol/L 伊曲康唑诱导K562 细胞的总凋亡率为17.92%,与DMSO引起的总凋亡比例3.56%相比,增加了5 倍.实验结果说明:伊曲康唑能够诱导K562 细胞的凋亡,并呈现出浓度的依赖性.
2.5 伊曲康唑对K562细胞周期的影响
细胞形态学结果提示伊曲康唑在诱导细胞凋亡的同时,对K562 细胞周期可能也有一定影响.为了验证这一假设,在DMSO 或不同浓度伊曲康唑处理K562 细胞48 h 后,利用流式细胞仪检测了细胞周期变化.如图6 所示,DMSO 处理的对照组G1期细胞比例为33.50%;1µmol/L 伊曲康唑处理的K562 细胞G1期细胞比例为36.63%;当伊曲康唑浓度为3、10、30µmol/L 时,G1期细胞比例为逐步增加,分别为43.44%、47.90%,甚至达到50.28%.
从图7 的细胞周期各时期的细胞比例分析中可以看出:随着伊曲康唑浓度增加,G1期细胞比例也显著增加,且存在剂量依赖关系,说明伊曲康唑可以将K562 细胞的细胞周期阻滞在G1期,从而发挥抑制细胞增殖的作用.
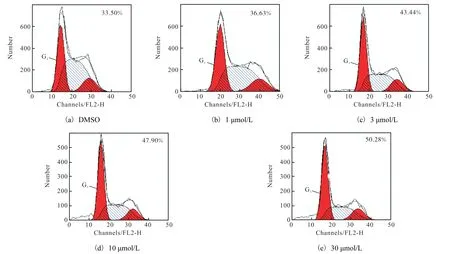
图6 不同浓度伊曲康唑对K562细胞周期的影响Fig.6 Effect of different concentration of Itraconazole on cell cycle of K562 cells
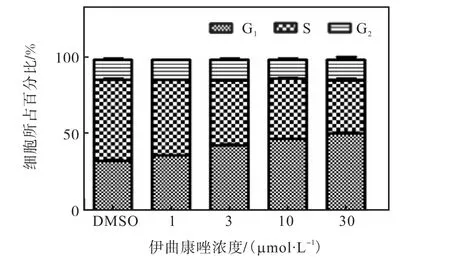
图7 不同浓度伊曲康唑对K562细胞周期影响的分析Fig.7 Distribution of cell cycle of K562 cells treated with Itraconazole of different concentration
2.6 伊曲康唑对HUVEC细胞血管形成的影响
血管生成对肿瘤组织的发展和转移有重要作用,如果没有充足的血管,肿瘤细胞将会缺乏必需的营养物质和氧气,只能进入休眠阶段,甚至发生坏死.另外,如果缺乏大量新生血管,肿瘤组织代谢产物堆积,迁移也会受到限制,所以抑制血管生成对于控制肿瘤的发生发展有着很重要的意义[13].
血管内皮细胞HUVEC 具有较好的运动分化能力,可以在基质胶中形成血管的管腔结构.本文接下来利用基质胶血管形成实验研究了不同浓度伊曲康唑对HUVEC 细胞血管形成的影响,进一步评价了伊曲康唑抗肿瘤活性的多样性.0.1、1、10、100µmol/L伊曲康唑处理HUVEC 细胞12 h 后,利用倒置荧光显微镜(放大100 倍)观察细胞的血管生成情况,实验结果如图8 所示.

图8 不同浓度伊曲康唑对HUVEC细胞血管形成的影响Fig.8 Effect of different concentration of Itraconazole on HUVEC cell angiogenesis
DMSO 对照组的HUVEC 细胞在基质胶上排列形成完整管腔结构;0.1、1、10、100µmol/L 的伊曲康唑刺激HUVEC 细胞后,随着作用浓度的增加,基质胶上完整的管状结构逐渐被破坏,1µmol/L 伊曲康唑作用下的HUVEC 细胞已无法形成完整的管状结构,而呈现出线条状的结构;10µmol/L 伊曲康唑作用下,不仅无法观察到完整的管状结构,其结构甚至呈现散点状;100µmol/L 伊曲康唑作用的HUVEC 细胞实验组,伊曲康唑产生析出现象,但依旧可以观察到呈散点状态的HUVEC 细胞.血管形成实验结果表明:在一定浓度范围内,伊曲康唑可以显著抑制HUVEC 细胞的血管形成,并具有浓度的依赖性.
3 讨 论
2017 年6 月30 日,中国侵袭性真菌感染工作组报道了侵袭性真菌病(invasive fungal disease,IFD)是血液系统恶性肿瘤患者重要的死亡原因之一,血液病患者IFD 的总体发病率不断呈现上升趋势,即使接受造血干细胞移植后,IFD 病死率仍高达50%[14].值得注意的是,IFD 的预防治疗与经验治疗策略中,伊曲康唑都被作为推荐使用的抗真菌药物之一.
与此同时,长期综合化学治疗与放射治疗双重疗法,使得肿瘤患者伴发第二肿瘤的发生率明显上升.患者无病生存期的延长、继发实体瘤者日益增多,且在白血病治疗的进程中尤为明显.顾伟英等[15]以24 例白血病患者(伴发实体瘤类型依次为胃癌6例,食管癌4 例,肺癌3 例,直肠癌、脑胶质瘤、乳腺癌、鼻咽癌、皮肤T 细胞淋巴瘤各2 例,肾癌l 例)作为研究对象,对其临床特点与预后展开分析,认为关于白血病与实体瘤叠合的治疗及预防,临床上首先考虑的仍是原发病的缓解或治愈.但是,伴发的第二肿瘤同样不可小觑.
此外,研究[16]报道显示:口服普萘洛尔为治疗婴幼儿血管瘤的一线方案,然而对于一线治疗无效的婴幼儿血管瘤,研究者们迫切需要找到一种新型、安全、高效的药物进行代替.近来临床上报道伊曲康唑在治疗婴幼儿血管瘤上疗效显著,不良反应轻微,但伊曲康唑治疗血管瘤的远期疗效和作用机制尚未明确,有待进一步研究和探索.
本文探讨了单独使用伊曲康唑对人慢性髓原白血病细胞株K562 的增殖抑制作用及对血管生成的抑制作用,发现伊曲康唑不仅能够通过诱导K562 细胞凋亡、发生G1期阻滞从而抑制K562 细胞的增殖,而且能够显著抑制HUVEC 细胞血管生成,且均呈现出剂量依赖关系.对于血液系统恶性肿瘤患者、血液系统恶性肿瘤伴发第二肿瘤患者以及血管瘤患者而言,这无疑是备受鼓舞的发现.
综上,有理由认为:生物利用度高、安全性好且具有广谱抗真菌作用的伊曲康唑极有可能成为临床应用前景广阔的抗血液系统恶性肿瘤及抗血管瘤候选药物,不仅具有抗真菌作用的附加益处,还有望抑制血液系统恶性肿瘤患者所继发的实体瘤发展.
尽管有伊曲康唑联合其他抗肿瘤药物的研究表明伊曲康唑是通过靶向作用于Hedgehog 和mTOR通路在内的多种途径选择性地抑制内皮细胞而发挥抑制作用,但是单独使用伊曲康唑治疗血液系统恶性肿瘤、血管瘤以及抑制血液系统恶性肿瘤患者所继发的实体瘤的相关研究甚少,其具体机制仍需深入研究.因此,深入研究伊曲康唑在血液系统恶性肿瘤、血管瘤及继发实体瘤中的治疗机制显得十分重要.本实验室将在现有的研究基础上,深入蛋白水平和动物水平展开后续研究,为进一步探究伊曲康唑抗肿瘤作用机制提供新思路.
