缺氧诱导因子-1α、生长素基因沉默对CNE-2鼻咽癌细胞放疗及凋亡敏感性的影响
2019-10-23徐茂林陈晓华
徐茂林 陈晓华 孙 波
(淄博市第一医院耳鼻咽喉科,淄博255200)
鼻咽癌是我国广州等南方地区最常见的恶性肿瘤之一,因其主要定位于鼻咽腔顶部和侧壁,放疗成为了其最主要的治疗手段[1]。随着放疗技术及方案的改进,患者的生存率有了明显提高,但随着治疗的进展,部分患者对放射治疗出现抵抗,最终导致治疗失败[2,3]。生物细胞对电离辐射的反应性受多种因素影响,其中,乏氧细胞比例、细胞凋亡调控是关键因素[4]。缺氧诱导因子-1(HIF-1)在肿瘤微环境中发挥着重要作用,参与了肿瘤进展、血管生成等多个环节[5]。生存素(Survivin)是一种高效能的凋亡抑制因子,可通过抑制Caspase 活性而发挥作用[6]。有研究表明,HIF-1α、Survivin的表达与患者预后相关,但机制尚不明确。
1 材料与方法
1.1材料 鼻咽癌细胞株CNE-2购于武汉博士德生物科技公司。质粒大提试剂、DH5et大肠杆菌感受态细胞购于美国Invitrogen公司,逆转录试剂盒、RT-PCR试剂盒购于TaKaRa公司(大连),miRNA干扰质粒由武汉博士德生物科技公司合成构建。兔抗人HIF-1α单克隆抗体、兔抗人Survivin单克隆抗体购于Abcam公司(英国)。35只4~6周龄BALB/C-nu/nu雌性裸鼠,购自武汉大学动物实验中心。
1.2方法
1.2.1细胞培养及质粒转染 细胞CNE-2在37℃,5%CO2条件恒温培养箱中培养,每2 d传代1次。制备CNE-2单细胞悬液,接种,贴壁培养后转染,6 h后更换培养基,继续培养48 h,荧光显微镜下计算转染率;根据转染质粒不同,将CNE-2细胞分为HIF-1α干扰组、Survivin干扰组、联合干扰组、空载组及阴性对照组。
1.2.2小鼠移植瘤模型构建及X射线照射 将35只裸鼠随机均分为5组,在右腋皮下注射CNE-2细胞(0.2 ml,1.5×1010L-1),密切观察裸鼠精神状态、活动状况及成瘤情况等。在成瘤3 d时,各组随机选取5只裸鼠进行放射治疗,5 Gy/次,共15 Gy,每隔3 d进行一次。裸鼠在放射治疗结束后3 d处死,测量肿瘤体积,计算5只裸鼠的平均肿瘤体积。
1.2.3HIF-1α和Survivin mRNA表达水平 ①组织中总RNA提取:标本组织用PBS清洗研磨后,滴加1 ml Trizol,收集裂解物。加入氯仿0.2 ml,离心后吸取上清至EP管,加入异丙醇,混匀后静置10 min。再次离心后弃上清,取管底沉淀,加入乙醇,再次离心,保留沉淀,静置后加入DEPC水至完全溶解。采用紫外分光光度仪测定RNA浓度及纯度,琼脂糖凝胶电泳检测RNA完整。②逆转录反应:参照反转录试剂盒说明书进行。根据RNA浓度计算需加入的RNA体积,加入OligodT 1 μl,DEPC水,总体积13 μl。反应加样体系包括,Buffer 4.0 μl,RNA酶抑制剂 0.5 μl,dNTP 2.0 μl,逆转录酶0.5 μl,Total2以上体系混匀后,离心,所得cDNA置于-20℃下保存。③RT-PCR检测:以cDNA为模板,严格按照荧光定量试剂盒说明书进行操作。反应体系包括:SYBRPremixExTapTMⅡ(2×)10.0 μl、PCR Forward Primer (10 μl) 1.0 μl、PCR Reverse Primer (10 μl) 1.0 μl、DNA模板(<100 ng)1.0 μl、dH2O 7.0 μl。反应条件为,95℃预变性2 min,95℃变性30 s、60℃延伸30 s,40个循环。
1.2.4HIF-1α和Survivin 蛋白表达水平及凋亡细胞检测 取裸鼠瘤体组织提取总蛋白。取25 μg上样,采用SDS-PAGE进行凝胶电泳,转膜2 h,5%脱脂牛奶封闭2 h,滴加一抗,HIF-1α单抗(1∶2 000)、Survivin单克隆抗体(1∶5 000),4℃孵育过夜,滴加二抗。以GAPDH为内参,温室孵育,TBST洗涤,采用化学发光法进行曝光,以Image J图像分析系统测定条带灰度值。移植瘤凋亡细胞采用TUNEL法检测。瘤体常规脱水,包埋,切片。染色过程按照试剂盒说明书进行。摄片后,随机选取5个视野,计数阳性细胞数。阳性标准:胞核内出现棕褐色或棕黄色颗粒。

2 结果
2.1质粒转染效率及基因沉默效率 转染48 h后,质粒转染效率高于90%,荧光细胞数量大于90%。RT-PCR检测结果发现,HIF-1α、Survivin基因的沉默率均高于85%,可用于构建裸鼠肿瘤模型。见图1。
2.2裸鼠皮下移植瘤及放射治疗效果 各组CNE-2细胞均能在裸鼠体内良好成瘤,成瘤率100%(35/35)。第3天,阴性对照组及空载组肿块出现,且直径明显大于其他组;第4天,两基因干扰组出现肿块;第6天,联合干扰组出现肿块。生长曲线显示,随着成瘤时间的延长,空载组、阴性对照组裸鼠的肿瘤生长速度明显更快,肿瘤体积显著更大,其他三组的体积变化率显著较低。见表1、图2。

图1 转染干扰质粒后CNE-2细胞的荧光染色结果(×100)Fig.1 Fluorescence staining of CNE-2 cells after trans-fection of interfering plasmids(×100)
表1 各组裸鼠皮下移植瘤体积(mm3)
Tab.1 Subcutaneous tumor volume of nude mice(mm3)
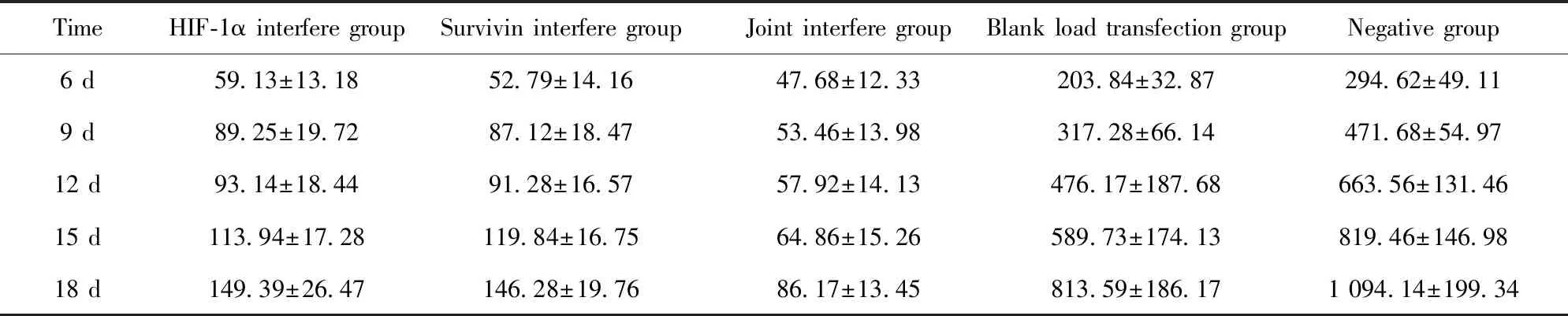
TimeHIF-1α interfere groupSurvivin interfere groupJoint interfere groupBlank load transfection groupNegative group6 d59.13±13.1852.79±14.1647.68±12.33203.84±32.87294.62±49.119 d89.25±19.7287.12±18.4753.46±13.98317.28±66.14471.68±54.9712 d93.14±18.4491.28±16.5757.92±14.13476.17±187.68663.56±131.4615 d113.94±17.28119.84±16.7564.86±15.26589.73±174.13819.46±146.9818 d149.39±26.47146.28±19.7686.17±13.45813.59±186.171 094.14±199.34
表2 HIF-1α和Survivin mRNA相对表达量
Tab.2 Relative expression of HIF-1α and Survivin mRNA

GroupsHIF-1αSurvivinHIF-1α interfere group26.9±3.6-Survivin interfere group-24.5±3.1Joint interfere group18.6±2.113.5±4.5Blank load transfection group93.9±12.491.7±9.3Negative group100.0±10.2100.0±11.4
表3 HIF-1α和Survivin蛋白表达水平
Tab.3 Expression of HIF-1α and Survivin

GroupsHIF-1αSurvivinHIF-1α interfere group69.7±11.6-Survivin interfere group-46.6±5.0Joint interfere group61.9±9.039.7±7.0Blank load transfection group97.7±12.091.3±13.7Negative group100.0±13.0100.0±9.0
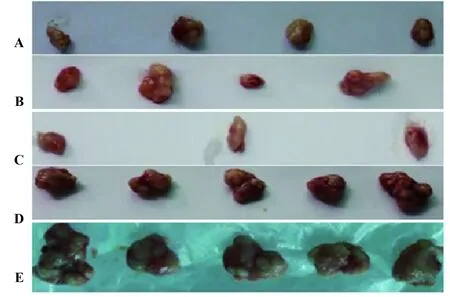
图2 裸鼠皮下移植瘤体积Fig.2 Volume of subcutaneous transplanted tumors in nude miceNote: A.HIF-1α interfere group;B.Survivin interfere group;C.Joint interfere group;D.Blank load transfection group;E.Negative group.
2.3RT-qPCR检测 基因的融解曲线均为单峰,无其他杂峰信号,检测结果可靠,扩增曲线平滑,呈S型。转染后基因沉默效应较好,各组裸鼠组织中HIF-1α和Survivin mRNA相对表达量见表2。HIF-1α干扰组、Survivin干扰组、联合干扰组的HIF-1α、Survivin的基因沉默率均高于85%。见图3、表2。

图3 融解曲线(A)和扩增曲线(B)Fig.3 Melting curve (A) and amplification curve (B)
2.4Western blot检测 各组裸鼠组织中HIF-1α、Survivin蛋白表达量见表3。根据公式,蛋白沉默效率=1-实验组蛋白相对表达量/对照组蛋白相对表达量,阴性对照组与空载组的蛋白表达量无明显差异(P>0.05),HIF-1α干扰组、Survivin干扰组、联合干扰组的表达量均显著小于对照组及空载组(P<0.05)。见图4、表3。

图4 HIF-1α蛋白、Survivin蛋白在组织中的表达水平Fig.4 Expression levels of HIF-1α protein and Survivin protein in tissuesNote: A.Negative group;B.Blank load transfection group;C.HIF-1α interfere group;D.Joint interfere group;E.Survivin interfere group.
2.5沉默基因联合X射线照射对鼻咽癌裸鼠移植瘤凋亡的影响 TUNEL检测结果显示,正常细胞胞核蓝染,形态均一,无黄染颗粒。凋亡细胞胞核固缩,形态异常,出现棕黄色颗粒。HIF-1α干扰组、Survivin干扰组、联合干扰组之间,两两比较,凋亡细胞数量无明显差异(P>0.05)。但三组的凋亡细胞数量均明显多于空载组、阴性对照组(P<0.05)。
3 讨论
鼻咽癌属于放射治疗中度敏感肿瘤,放疗仍然是首选治疗手段[7]。我国幅员辽阔,人们食物谱及生活环境、生活习惯不尽相同,不同地区之间鼻咽癌的发病率和死亡率差距相对较大[8,9]。近年来,随着基因组学、分子生物学的迅猛发展,肿瘤的基因治疗理论逐渐成熟并日趋完善。目前,肿瘤的基因治疗的研究主要集中于基因沉默治疗、自杀基因疗法、肿瘤多药耐药基因治疗、抗端粒酶疗法等方面[10]。
肿瘤细胞代谢率显著高于正常组织,实体肿瘤及微环境均处于缺血缺氧状态。HIF-1α的主要功能之一就是维持肿瘤细胞在乏氧环境中生存,在乳腺癌、胃癌、肺癌等多种实体恶性肿瘤中,均有HIF-1α蛋白的异常表达[11]。Survivin则广泛参与了细胞有丝分裂、凋亡及血管生成的调控过程[12]。在本研究中,随着成瘤时间的延长,空载组、阴性对照组裸鼠的肿瘤生长速度明显更快,肿瘤体积显著更大,其他三组的体积变化率显著较低。这表明沉默HIF-1α、Survivin基因能明显减缓移植瘤生长速度。同时,对照组及空载组的mRNA表达量、蛋白表达量也明显高于其他组,且凋亡细胞数量显著更多。这提示沉默HIF-1α、Survivin基因可提高移植瘤对放射线的敏感性。夏天等[13]在视网膜母细胞瘤的相关研究中发现,沉默HIF-1α基因可有效促进视网膜母细胞瘤细胞凋亡。李洁清等[14]在裸鼠肺癌模型中也发现的同样的现象,抑制HIF-1α基因后,肺癌移植瘤生长速度明显放缓,放射治疗效果也更加明显。这都显示了HIF-1α表达在肿瘤放疗抵抗的重要意义,随着其机制研究的不断透彻,HIF-1α成为今后临床上基因分子治疗提高放疗敏感性的潜在基因靶点。
为了进一步探讨两种基因的表达之间是否存在协同关系,本研究设置了联合干扰组,结果发现,比单一干扰组相比,虽然联合干扰组的抑瘤效率相对更高、凋亡细胞数也更多,但差异无统计学意义。这与部分研究者的结论不完全一致。任艳鑫等[15]将以HIF、Survivin基因为靶标的siRNA转染鼻咽癌细胞后发现,肿瘤细胞增殖能力明显下降,靶基因的mRNA、蛋白的表达水平也明显降低,联合转染后细胞的所有检测结果均显著强于对照组。目前,关于联合干扰HIF-1α及Survivin 基因的文献较少,具体机制也不明确。基因的调控网络十分复杂,二者之间、二者与其他基因之间必定还存在许多或正或负的相互关系。本研究只是单纯敲除两个基因,可能并不能体现两者之间复杂的关联,对二者的关系研究尚不够深入。
综上所述,本研究发现,单独的HIF-1α、Survivin基因干扰能有效增强鼻咽癌移植瘤裸鼠模型对放疗的敏感性,但联合干扰后敏感性未明显增强。