miR-296-5p靶向MICB促进口腔鳞癌生长的分子机制①
2019-10-23王藜篥周祥文姚雨彤杨扉扉
王藜篥 张 涛 金 珊 周祥文 王 青 姚雨彤 杨扉扉
(贵州省骨科医院,贵阳550004)
MHCⅠ类相关蛋白(Major histocompatibility complex,MHC)包括主要组织相容性蛋白A/B (MICA/B),均位于6号染色体,由3个胞外区、1个跨膜区、1个胞质尾区构成[1,2]。MICA/B主要存在于上皮细胞及肿瘤细胞的细胞膜,也有少量研究报道其主要位于细胞质,极少部分位于癌细胞膜[3]。MICA/B可通过与NK 细胞上自然杀伤细胞受体蛋白2D (Natural killer cell receptor protein 2D,NKG2D)结合活化效应细胞,参与抗感染、抗肿瘤、移植排斥、自身免疫及肿瘤的免疫逃避作用[4]。2007年马烽等[5]报道,MICB(Major Histocompati-bility complex classⅠ-related chain B)是NK细胞活化受体NKG2D的配基,可在应激作用下与NKG2D作用,在NK细胞对病毒感染细胞和肿瘤细胞的杀伤中具有重要的作用。MICB在多种癌症中均参与肿瘤的发生发展[6],但其在口腔癌中的作用机制尚未十分清楚。miRNA可通过调节转录和转录后水平控制细胞的生物学行为,其在癌症中的作用已成为该领域的研究热点[7]。miR-296-5p在很多癌症中均发生异常表达,但其在口腔鳞癌的研究甚少[8]。本研究检测口腔鳞癌组织中miR-296-5p、MICB的表达并采用口腔鳞癌细胞Cal27,观察抑制miR-296-5p、过表达MICB、敲减MICB对口腔鳞癌细胞存活率、NK细胞因子TNF-α、IFN-γ含量的影响,揭示miR-296-5p可调控口腔鳞癌细胞的存活及NK细胞的杀伤能力,其机制可能与靶向MICB有关,可为口腔鳞癌的治疗提供新靶点。
1 材料与方法
1.1材料 选取本院2017年2月至2018年6月期间外科手术切除的口腔鳞状细胞癌标本41例及癌旁组织标本30例作为对照。本研究经本院医学伦理委员会批准,所有患者及家属均签署知情同意书;口腔鳞癌细胞Cal27、NK细胞购自ATCC;DMEM培养基、胎牛血清、5-二苯基四氮唑溴盐、胰蛋白酶均购自美国Gibco公司;LipofectamineTM2000、逆转录试剂盒、qRT-PCR购自大连TaKaRa公司;辣根过氧化物氧化酶(HRP)标记的羊抗人IgG购自上海申能博彩公司;双荧光素酶报告基因检测试剂盒购自美国Promega公司;肿瘤坏死因子α(TNF-α)检测试剂盒、人干扰素γ(IFN-γ)检测试剂盒购自碧云天公司;MICB兔抗人多克隆抗体购自Abcam公司;免疫组织化学试剂购自北京中杉公司;
1.2方法
1.2.1免疫组织化学实验 将来源本院的41例口腔鳞癌组织和30例癌旁组织用石蜡包埋,切成0.4 μm 的切片。然后按照SP法进行免疫组织化学染色。染色后将切片浸入3%H2O2中室温避光孵育10 min,PBS洗涤4次,置入枸杞酸钠-EDTA抗原修复液中,用微波炉加热20 min进行抗原修复,自然冷却。再用PBS洗片并吸去水分,滴加Ⅰ抗并置于4℃孵育过夜。取出切片冲洗后吸干水分,滴加Ⅱ抗,湿盒内室温孵育30 min,PBS冲洗,除去多余水分,滴加DAB显色剂,5 min后显微镜下观察染色效果,自来水终止反应。滴加苏木精染核5 min,终止反应。光学显微镜下读片,记录染色的强度,封固。用PBS缓冲液代替Ⅰ抗作为阴性对照。结果判定:400倍显微镜下每张玻片随机选取5个视野观察染色强度和阳性细胞数。阳性细胞率=(阳性细胞数/癌细胞总数)×100%。当阳性细胞率≥ 50%时,判定为阳性。
1.2.2细胞培养和转染 用含有10%胎牛血清的DMEM培养液培养口腔鳞癌细胞Cal27、NK细胞,置于37℃,5%CO2的培养箱中常规培养。将anti-miR-con组(转染anti-miR-con)、anti-miR-296-5p组(转染anti-miR-296-5p)、miR-con组(转染miR-con)、miR-296-5p组(转染miR-296-5p mimics)、pcDNA 3.1组(转染pcDNA 3.1)、pcDNA 3.1-MICB组(转染pcDNA 3.1-MICB)、anti-miR-296-5p+si-con组(anti-miR-296-5p和si-con共转染)、anti-miR-296-5p+si-MICB组(anti-miR-296-5p和si-MICB共转染),均按照LipofectamineTM2000脂质体说明书要求转染至Cal27细胞,转染48 h,用qRT-PCR检测转染效率。转染成功后,用于后续实验。
1.2.3qRT-PCR实验 Trizol法提取组织样本或对数生长期的1.2.2中各组细胞样本总RNA,并用Nano-Drop 2000微量分光光度计进行RNA定量。DNaseⅠ消化RNA中可能污染的DNA。逆转录反应采用逆转录试剂盒方式,操作按照试剂盒说明书进行,合成模板链cDNA。按照反应体系进行,每个样品重复3次,取平均值,反应结束后通过分析Ct值,计算定量结果,以2-ΔΔCt法测定miR-296-5p的相对表达水平。
1.2.4MTT实验 将1.2.2中各组细胞浓度调整至5×104个/ml取100 μl,加入20 μl MTT(5 g/L)溶液,培养4 h,然后弃去上清,每孔加入150 μl DMSO,振荡,使结晶溶解,在490 nm波长下检测细胞吸光度(A)。细胞的存活率=OD490样品/OD490对照。
1.2.5ELISA实验 将1.2.2中各组细胞浓度调整至5 ×104个/ml取100 μl,按照TNF-α检测试剂盒、IFN-γ检测试剂盒说明书要求进行TNF-α、IFN-γ的检测。
1.2.6Western blot实验 取1.2.2中各组细胞1×106个,RIPA裂解后用BCA法进行定量,变性离心后取上清进行蛋白上样。按照Western blot实验常规操作流程进行电泳-转膜-封闭-Ⅰ抗孵育-Ⅱ抗孵育-显影曝光。以目的条带灰度值与β-actin灰度值的比值表示目的蛋白MICB的表达。
1.2.7双荧光素酶报告基因检测实验 取1.2.2中各组细胞1×106个,按照双荧光素酶报告基因检测试剂盒技术手册要求操作。psiCHECK2载体以萤火虫荧光素酶活性为内参,psiCHECK2-MICB-3′UTR WT和psiCHECK2-MICB-3′UTR MUT的表达为对照,转染24 h后,检测荧光强度。海参荧光素酶的发光强度与萤火虫荧光素酶发光强度的比值即反映miR-296-5p与MICB的结合力。

2 结果
2.1口腔鳞状细胞癌中miR-296-5p、MICB的表达 运用免疫组织化学法检测癌旁组织、口腔鳞状细胞癌组织中MICB的蛋白表达,与癌旁组织相比,口腔鳞状细胞癌组织中MICB的蛋白表达显著降低(图1A、B)。qRT-PCR检测癌旁组织、口腔鳞状细胞癌组织中miR-296-5p的表达,与癌旁组织相比,口腔鳞状细胞癌组织中miR-296-5p的表达显著升高(表1),差异均具有统计学意义(P<0.05)。
2.2抑制miR-296-5p与NK细胞共培养对口腔鳞癌细胞存活率的影响 运用MTT法检测细胞的存活率,qRT-PCR法检测细胞中miR-296-5p的表达,与anti-miR-con组相比, anti-miR-296-5p组细胞中miR-296-5p的表达显著降低,细胞存活率显著降低(表2),差异具有统计学意义(P<0.05)。
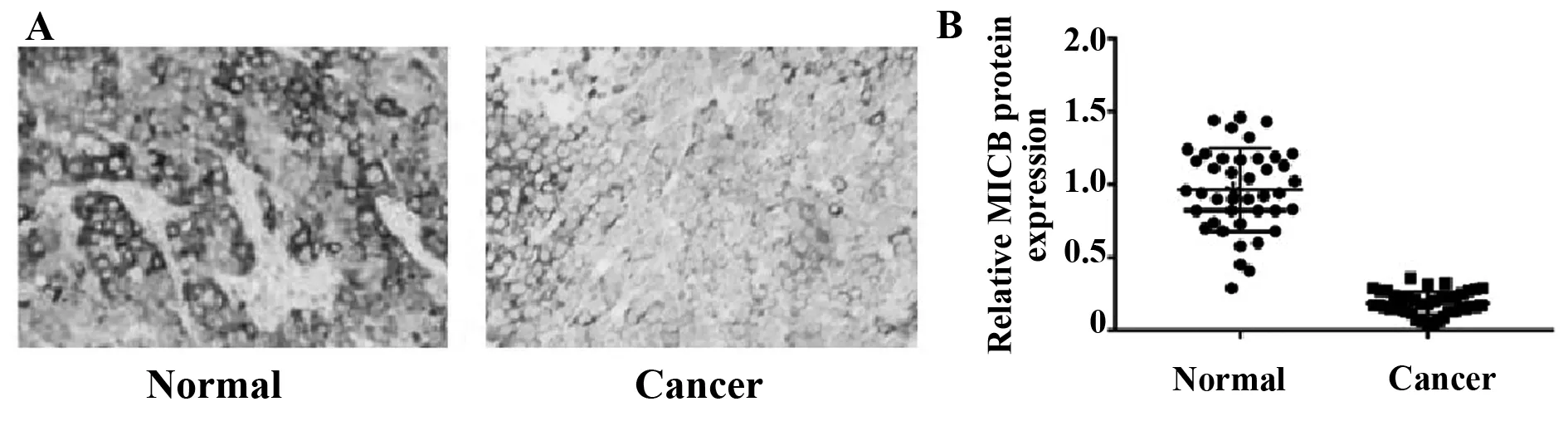
图1 口腔鳞癌组织41例及癌旁组织30例中MICB的蛋白表达(免疫组化染色,×400)Fig.1 Protein expression of MICB in oral squamous cell carcinoma and adjacent tissues (Immunohistoche-mical staining,×400)
2.3抑制miR-296-5p与NK细胞共培养对NK细胞因子的影响 用ELISA实验检测anti-miR-con组、anti-miR-296-5p组细胞中IFN-γ、TNF-α的含量。与anti-miR-con组相比,anti-miR-296-5p组细胞中IFN-γ、TNF-α的含量均显著升高(表3),差异具有统计学意义(P<0.05)。
2.4miR-296-5p靶向MICB 通过Target scan对miR-296-5p与MICA进行预测,发现miR-296-5p靶向MICA结合的可能性很高(图2A)。运用双荧光素酶报告基因检测实验检测细胞的荧光活性,与miR-con组相比,miR-296-5p组WT-MICA细胞的荧光活性显著降低,而MUT-MICA细胞的荧光活性不受影响(表4)。与miR-con组相比,miR-296-5p组细胞中MICA的蛋白表达显著降低,与anti-miR-NC组相比,anti-miR-296-5p组细胞中MICA的蛋白表达显著升高(图2B,表5),差异均具有统计学意义(P<0.05)。可见,miR-296-5p可靶向MICB。
表1 口腔鳞状细胞癌中miR-296-5p、MICB的表达
Tab.1 Expression of miR-296-5p and MICB in oral squa-mous cell carcinoma

GroupsmiR-296-5pNormal1.00±0.18Cancer3.69±0.441)t9.801P0.001
Note:1)P<0.05.
表2 抑制miR-296-5p对口腔鳞癌细胞存活率的影响
Tab.2 Effect of inhibition of miR-296-5p on survival rate of oral squamous cell carcinoma
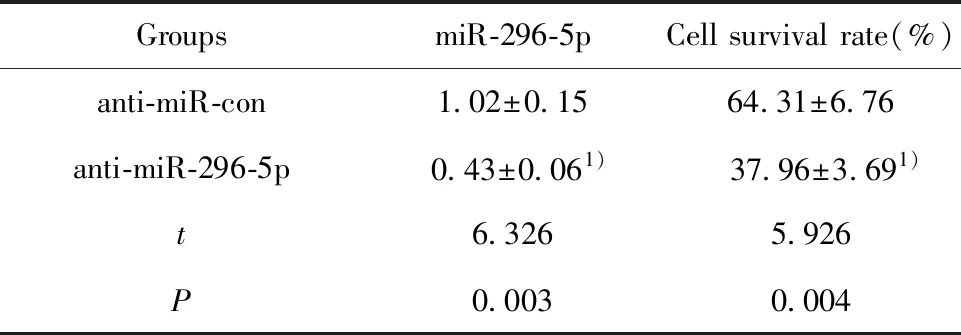
GroupsmiR-296-5pCell survival rate(%)anti-miR-con1.02±0.1564.31±6.76anti-miR-296-5p0.43±0.061)37.96±3.691)t6.3265.926P0.0030.004
Note:1)P<0.05.
表3 抑制miR-296-5p对NK细胞因子的影响
Tab.3 Effect of inhibition of miR-296-5p on NK cytokines

GroupsIFN-γ (pg/ml)TNF-α (pg/ml)anti-miR-con52.06±6.2834.14±3.66anti-miR-296-5p148.43±8.731)112.49±11.841)t15.52110.950P0.0000.000
Note:1)P<0.05.

图2 miR-296-5p靶向MICBFig.2 miR-296-5p targeted MICBNote: A.Complementary sequence;B.miR-296-5p affects the expression of MICB protein in oral cancer cells.
表4 miR-296-5p对口腔癌细胞荧光活性的影响
Tab.4 Effect of miR-296-5p on fluorescence activity of oral cancer cells

GroupsWT-MICAMUT-MICAmiR-con1.00±0.110.96±0.08miR-296-5p0.34±0.051)1.05±0.12t9.4611.081P0.0010.341
Note:1)P<0.05.
表5 MICB蛋白水平的表达
Tab.5 Expression of MICB protein levels

GroupsMICB protein expressionmiR-con1.00±0.09miR-296-5p0.41±0.051)anti-miR-con1.06±0.11anti-miR-296-5p1.86±0.142)F100.622P0.000
Note:Compared with miR-con group,1)P<0.05;compared with anti-miR-con group,2)P<0.05.
2.5过表达MICB与NK细胞共培养对口腔鳞癌细胞存活率和NK细胞因子的影响 Western blot检测pcDNA组、pcDNA-MICB组细胞中MICB的蛋白表达(图3)。与pcDNA组相比,pcDNA-MICB组细胞中MICB的蛋白表达显著升高,细胞存活率显著升高,NK细胞因子IFN-γ、TNF-α 的含量显著升高(表6),差异均具有统计学意义(P<0.05)。
2.6敲减MICB与NK细胞共培养对口腔鳞癌细胞存活率和NK细胞因子的影响 与anti-miR-con组相比,anti-miR-296-5p组细胞中MICB蛋白表达量显著升高(图4),细胞存活率显著降低,NK细胞因子IFN-γ、TNF-α 的含量显著升高(表7);与anti-miR-296-5p+si-con组相比,anti-miR-296-5p+si-MICB组细胞中MICB蛋白表达量显著降低(图4),细胞存活率显著升高,NK细胞因子IFN-γ、TNF-α 的含量显著降低(表7),差异均具有统计学意义(P<0.05)。

图3 Western blot检测MICB蛋白水平的表达Fig.3 Western blot analysis of MICB protein expression

图4 Western blot检测MICB蛋白水平的表达Fig.4 Western blot analysis of MICB protein expression
表6 过表达MICB与NK细胞共培养后对口腔鳞癌细胞存活率和NK细胞因子的影响
Tab.6 Effect of overexpression of MICB and NK cells on survival rate and NK cytokines of oral squamous cell carcinoma
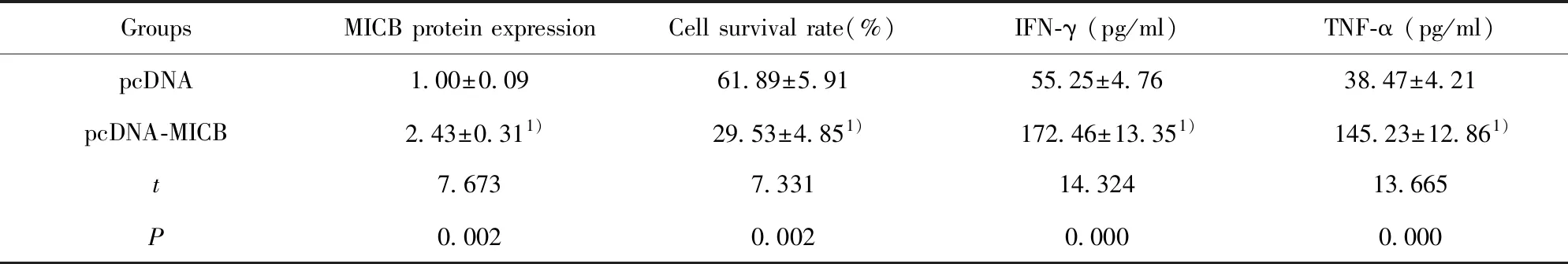
GroupsMICB protein expressionCell survival rate(%)IFN-γ (pg/ml)TNF-α (pg/ml)pcDNA1.00±0.0961.89±5.9155.25±4.7638.47±4.21pcDNA-MICB2.43±0.311)29.53±4.851) 172.46±13.351) 145.23±12.861)t7.6737.33114.32413.665P0.0020.0020.0000.000
Note:1)P<0.05.
表7 敲减MICB与NK细胞共培养对口腔鳞癌细胞存活率和NK细胞因子的影响
Tab.7 Effect of knockdown of MICB and NK cell co-culture on survival rate and NK cytokines of oral squamous cell carcinoma
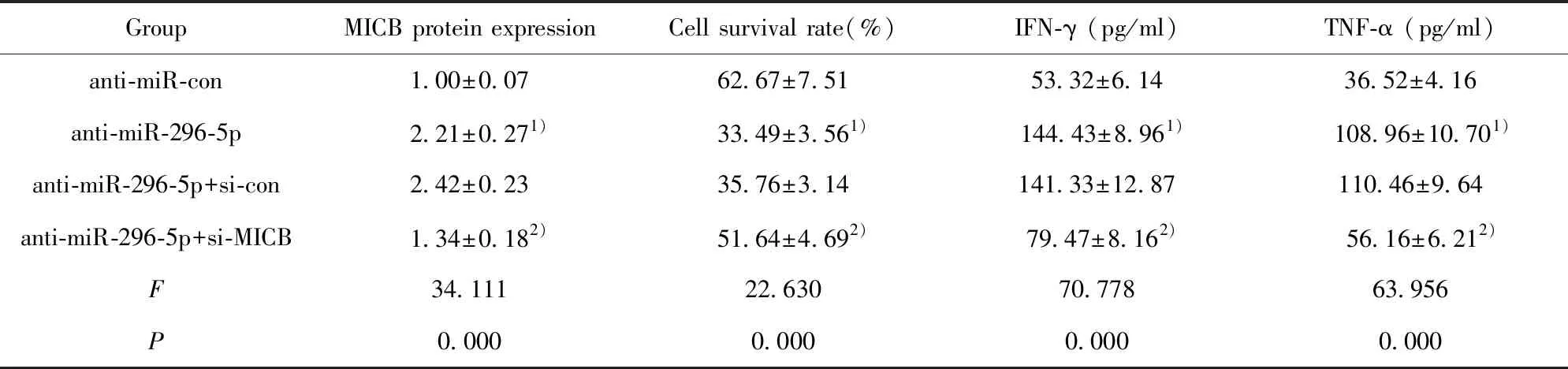
GroupMICB protein expressionCell survival rate(%)IFN-γ (pg/ml)TNF-α (pg/ml)anti-miR-con1.00±0.0762.67±7.5153.32±6.1436.52±4.16anti-miR-296-5p2.21±0.271)33.49±3.561)144.43±8.961)108.96±10.701)anti-miR-296-5p+si-con2.42±0.2335.76±3.14141.33±12.87110.46±9.64anti-miR-296-5p+si-MICB1.34±0.182)51.64±4.692)79.47±8.162)56.16±6.212)F34.11122.63070.77863.956P0.0000.0000.0000.000
Note:Compared with the anti-miR-con group,1)P<0.05;compared with the anti-miR-296-5p+si-con group,2)P<0.05.
3 讨论
恶性肿瘤是目前世界上人类死亡的首要原因,且癌症的发病率仍在逐年上升[9]。当前针对癌症的主要方法,如手术治疗、化疗、放疗均不能完全根除或杀灭肿瘤细胞。微小RNA是一类广泛存在于真核生物中高度保守的内源性短链非编码小分子RNA,其本身无开放阅读框,不编码蛋白[10]。近几年微小RNA在肿瘤中的研究日益增多,发现了大量在人类肿瘤中具有治疗潜能的miRNA[11]。miR-495、miR-26b、miR-139-5p均在口腔鳞癌中具有重要作用[12-14]。Zhu等[15]发现,miR-296的异常表达在人类各种恶性肿瘤的细胞过程中均具有重要作用,包括细胞增殖、细胞凋亡、侵袭和上皮-间质转化。Severino等[16]对转移性和非转移性口腔鳞状细胞癌患者的血浆和组织进行miRNA测序发现,在转移性肿瘤中检测到miR-181和miR-296,并在发生转移的患者血浆中检测到miR-296,这提示了miRNA具有诊断口腔鳞状细胞癌转移的潜力。本研究运用qRT-PCR法检测了口腔鳞癌组织中miR-296-5p的表达,发现miR-296-5p在口腔鳞癌中高表达,这与前人的研究结果相吻合;深入研究发现,抑制miR-296-5p可下调口腔癌细胞的存活率,促进NK细胞因子的分泌;另外,用双荧光素酶报告基因检测验证了miR-296-5p靶向负调控MICB。
免疫监测是免疫反应的重要组成部分,不仅对于病原体,对于癌症更是如此。细胞毒性淋巴细胞(包括NK细胞和CD8+T细胞)可以作为癌细胞发展状态的标志物[17]。Ⅱ 型C凝集素样受体在自然杀伤细胞、CD8+T细胞和γδT细胞上均有表达,其可作为细胞表面的一个重要的激活性受体[18]。MICB为NKG2D的配体之一,是参与免疫相关基因的成员,主要在上皮细胞、内皮细胞和肿瘤细胞的细胞膜上表达,与肿瘤逃避、免疫排斥、自身免疫等疾病相关[19]。研究显示 MICA 和 MICB 基因编码区间序列同源性大于 90%,MICA 和 MICB 蛋白间具有相同或相似的保守区域[20]。MICA能够竞争性与NK细胞的活化性受体 NKG2D 结合进而阻碍NK细胞的免疫监视,发挥肿瘤逃逸作用[21]。早在2007,中国研究者Liu等[22]在口腔鳞状细胞癌的研究中阐明,口腔鳞状细胞癌(Oral squamous cell carcinoma,OSCC)细胞系中内源性MICB mRNA表达显著高于人正常口腔角质上皮细胞NHOK中的表达,在OSCC组织中MICB mRNA表达高于癌旁正常组织,提示MICB在口腔鳞状细胞癌中可能高表达。杨辉俊等[23]在口腔鳞癌患者外周血中检测NKT细胞、NKG2D及其配体MICA/B的表达,发现口腔鳞癌患者外周血中NKT细胞数量和NKG2D及其配体MICA/B表达均下调,以利于口腔鳞癌细胞发生免疫监视。本研究运用免疫组织化学法检测了口腔癌组织中MICB的蛋白表达,发现MICB在口腔癌中表达显著降低,这与杨辉俊的研究结果相一致;进一步深入研究发现,过表达MICB可抑制口腔鳞癌细胞存活,促进NK细胞因子分泌,发挥抑癌作用,且敲减MICB可逆转抑制miR-296-5p对口腔鳞癌细胞存活率的抑制及对NK细胞因子含量的促进作用。
综上所述,miR-296-5p可调控口腔鳞癌细胞的存活和NK细胞的杀伤作用,其机制可能与靶向MICB有关,为口腔鳞癌的预防和治疗提供新靶点。