pSS大鼠肺功能变化与Notch通路及调节性T细胞的关系①
2019-10-23王坤万磊刘健
王 坤 万 磊 刘 健
(安徽中医药大学研究生院,合肥230031)
原发性干燥综合征(primary Sjogren′s synd-rome,pSS)是成人常见的自身免疫性疾病,其特征在于腺体分泌异常,可以以不同的方式影响肺部。肺间质病变与pSS关系密切[1,2],间质性肺病通常是pSS的肺部表现[3,4]。pSS的肺部受累导致肺间质病变和肺实质的破坏,最终导致肺功能降低[5]。辅助T细胞(Th)参与pSS肺功能损伤过程。Th1细胞主要分泌IL-2等,参与细胞炎症反应;Th2细胞主要分泌IL-4、IL-5等,参与体液免疫应答。Th17细胞分泌效应因子IL-17,诱导炎症反应,IL-17可通过促进释放前炎性细胞因子来放大炎症反应。Notch信号通路在肺间质病变中发挥作用[6]。Notch信号通路是一种高度保守的通路,对正常胚胎发育、细胞增殖、特化和分化至关重要,并与肺间质纤维化疾病有关[7]。Notch通路通过跨膜配体激活受体参与T细胞活化[8]。 Notch通路抑制剂可通过调节Th1和Th2细胞介导炎症反应而减少肺部炎症[9]。 Notch信号通路异常激活可致使成纤维细胞异常增殖,并分化为肌成纤维细胞和细胞外基质[10],最终出现肺部病变导致肺功能降低。从Notch信号通路调节Treg角度观察pSS肺功能变化,为进一步探讨其可能的机制本研究设计如下方案。
1 材料与方法
1.1材料 清洁级SD大鼠16只,体重(150±20)g,5~6月龄,购自安徽省实验动物中心。IL-2、IL-5、IL-17、免疫球蛋白κJ区域(RBP-J)试剂购自上海源叶生物公司。流式细胞术试剂购自美国eBioscience公司。PCR试剂购自美国Invitrogen公司。免疫印迹相关试剂购自美国Abcam公司。颌下腺蛋白购自上海生扶生物。弗氏完全佐剂购自美国Sigma公司。
1.2方法
1.2.1pSS大鼠模型构建[11,12]大鼠随机分为正常组和模型组。模型组大鼠两后足足跖部皮下注射颌下腺蛋白与弗氏完全佐剂混合后的乳化物,0.2 ml/鼠。建立pSS模型。
1.2.2肺功能检测 采用动物肺功能仪测定肺功能,包括一秒用力呼气容积(Forced expiratory volume in 1 second,FEV1)、50%肺活量的最大呼气流量(50% Forced expiratory flow,FEF50)、FEF75、用力最大呼气流量(Peak expiratory flow,PEF)。
1.2.3IL-2、IL-5、IL-7、RBP-J表达 取大鼠新鲜血液,离心取上清液,检测大鼠血清IL-2、IL-5、IL-17、RBP-J表达。根据ELISA操作步骤检测IL-2、IL-5、IL-17、RBP-J OD值,绘制标准曲线,测算IL-2、IL-5、IL-17、RBP-J浓度。
1.2.4外周血Treg检测 取大鼠新鲜血液100 μl,按106个细胞/管分别加入抗鼠CD4-FITC(0.25 μg)+抗鼠CD25-PE (0.25 μg)+抗鼠Notch1-APC(1.0 μg),抗鼠CD4-FITC(0.25 μg)+抗鼠CD25-PE (0.25 μg)+抗Notch3-APC(1.0 μg),阴性对照管加入相应同型对照抗体。依次进行固定、通透细胞,避光20~30 min;加红细胞裂解液1 ml,避光15~25 min;离心弃上清,重悬于500 μl PBS液中,流式细胞术检测。
1.2.5Notch通路相关基因和蛋白表达 基因检测:根据GenBank 设计引物并合成。引物序列如下:Notch1上游5′-TCGTCTCCGACTTCGTCTATCA-3′,下游5′-TGCAGAGCAGACTTGCCTA-3′;Notch2上游5′-ATGGGCTCTAAGGTATTTCTGG-3′,下游5′-CAGAGCTCGCTTGTCGTG-3′;Notch3上游5′-CTCTGGTTTCCAGAGGGTTT-3′,下游5′-CCAGTTCGGTCAGTTCGTG-3′;Notch4上游5′-GGACTGGGAAAT-CCCGAACC-3′,下游5′-GGCATCTTTATCCGCTCCA-3′;Jagged1上游5′-GCATCGGCTCAGGGTCTG-3′,下游5′-AGTCGCCTGGGAGTTTGC-3′;Jagged2上游5′-GGGCTCTTGCCACGAAGT-3′,下游5′-AGGCACG-GTATCCCTTCG-3′;Delta1上游5′-CCTGGCGACCAC GCAACA-3′,下游5′-CAGCACCCTCCATTCCTG-3′;GAPDH上游5′-TCCACCACCCTGTTGCTGTAG-3′,下游5′-CCACAGTCCATGCCATCACT-3′。参照实验步骤进行大鼠肺组织RNA的提取、逆转录及PCR反应。蛋白检测:参考说明书进行肺组织蛋白提取、电泳、转膜、封闭、一抗孵育、二抗孵育、蛋白检测。数据分析处理:用扫描仪对胶片进行扫描、摄像;采用Quantity one 灰度分析软件进行分析。计算各组条带的灰度值,以目的蛋白与各组内参β-actin灰度值的比值做为蛋白的相对表达量。

2 结果
2.1肺功能变化 与正常组比较,模型组大鼠FEV1等各项肺功能参数均有明显降低(P<0.05)。见图1。

图1 两组肺功能参数比较 Fig.1 Comparison of lung function parameters of twogroupsNote: Compared with normal group,*.P<0.05.
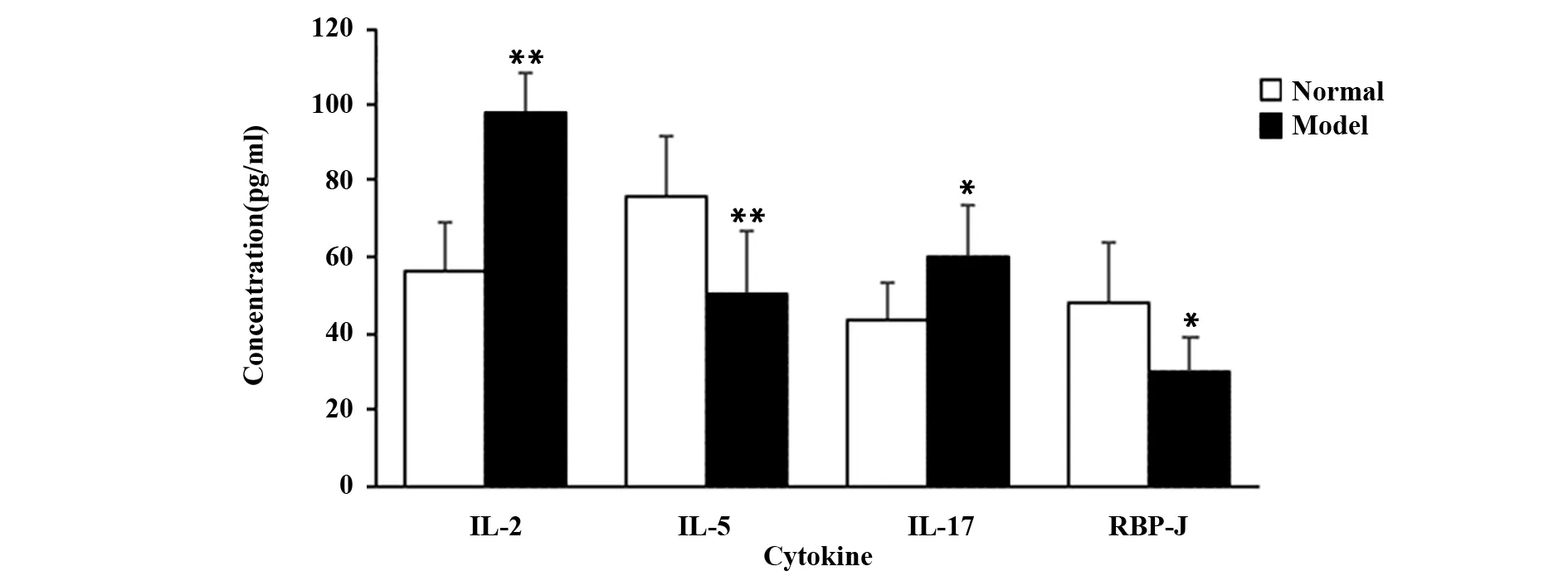
图2 两组血清细胞因子IL-2、IL-5、IL-17和RBP-J水平比较Fig.2 Comparison of serum cytokines IL-2,IL-5,IL-17 and RBP-J level in two groupsNote: Compared with normal group,*.P<0.05,**.P<0.01.
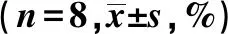
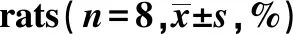
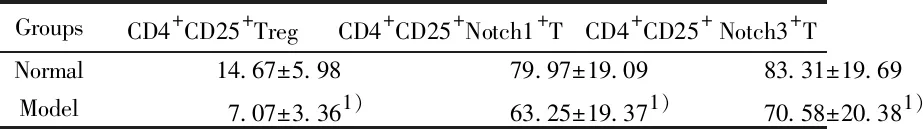
GroupsCD4+CD25+TregCD4+CD25+Notch1+TCD4+CD25+ Notch3+TNormal14.67±5.9879.97±19.0983.31±19.69Model 7.07±3.361)63.25±19.371)70.58±20.381)
Note:Compared with normal group,1)P<0.01.
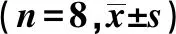
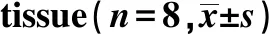

GroupsNotch1Notch2Notch3Notch4Delta1Jagged1Jagged2Normal0.87±0.250.90±0.390.51±0.200.85±0.250.54±0.90.49±0.190.48±0.19Model 0.94±0.360.93±0.410.97±0.252)0.87±0.210.90±0.132)0.93±0.182)0.74±0.201)
Note:Compared with normal group,1)P<0.05,2)P<0.01.

图3 肺组织 Notch 通路相关蛋白表达量Fig.3 Expression of Notch pathway related proteins in lung tissueNote: 1.Normal group;2.Model group.
2.2血清细胞因子 IL-2、IL-5、IL-17和RBP-J水平的变化 与正常组比较,模型组细胞因子IL-2、IL-17显著升高,细胞因子IL-5及RBP-J降低(P<0.05或P<0.01)。见图2。
2.3外周血CD4+CD25+Treg、CD4+CD25+Notch1+T和CD4+CD25+Notch3+T细胞变化 与正常组比较,模型组大鼠外周血CD4+CD25+Treg、CD4+CD25+Notch1+T和CD4+CD25+Notch3+T细胞表达均降低(P<0.01)。见表1。
2.4肺组织Notch相关基因表达变化 与正常组相比,模型组Notch通路相关蛋白Notch3、Delta1、Jagged1、Jagged2表达升高(P<0.05或P<0.01)。见表2、图3。
3 讨论
T淋巴细胞在免疫疾病发病机制中具有重要作用,它涉及激活活化的CD4+T细胞以引发特异性效应细胞因子的分泌[13,14]。初始CD4+T细胞可以根据极化细胞因子信号分化成Th1、Th2和Treg。Th细胞参与炎性疾病的发生。CD4+T细胞分泌的炎症细胞因子浸润到气道,黏液分泌过多,嗜酸性粒细胞聚集,导致免疫炎症反应和肺部炎症聚集。大量集聚的炎症反应进一步致使肺功能参数FEV1、FEF、PEF降低。
Th1/Th2细胞因子稳定性是pSS肺损伤的重要指标。Th细胞在气道炎症中起作用。Th1细胞主要产生IL-2等。Th2细胞因子诱导嗜酸性粒细胞因子IL-5分泌而控制免疫反应,释放炎症介质。引起炎症反应升高而损伤肺组织。Th17细胞释放IL-17可诱导嗜酸性粒细胞浸润和巨噬细胞募集,IL-17参与中性粒细胞积聚和中性粒细胞激活,细胞因子IL-17增加表明细胞浸润和炎症增加。本研究发现pSS大鼠细胞因子IL-2、IL-17显著升高,细胞因子IL-5及RBP-J降低。Notch信号传导途径包括进化保守的细胞间通信系统,其在胚胎发育和成体期间控制细胞增殖、分化。 Notch信号通路在T细胞系发育的多个步骤中起着至关重要的作用,对于Th细胞分化十分关键。Notch通路也在调节Treg细胞分化中发挥作用[15]。Notch信号参与T细胞介导的免疫反应。研究表明,Notch信号传导可促进Th2反应,Notch配体调节可以促进或抑制Th1反应[16],Notch信号途径调节T细胞向Th1方向分化[17]。研究发现在肺组织中特别是在CD4+T细胞中,Notch1 表达降低[18],可上调肺组织中Th1/Th2比率。pSS炎症可由Th2细胞因子IL-5介导。通过Notch 信号途径可调节Th2细胞分泌IL-5,抑制炎症反应而保护肺组织。
Notch通路可通过调控Treg表达而参与调节Treg功能。Notch 通路主要可调节Treg细胞的分化而介导免疫抑制作用。Notch1与其配体Jagged1结合后可诱导Treg分化,从而调节Treg细胞的数量。将CD4+T细胞转染至Notch1受体胞内后,体内细胞因子平衡出现变化,如IL-1等促炎症细胞因子表达升高。而采用抑制剂抑制Notch信号后,可显著促进Treg分泌抑炎细胞因子IL-10,抑制促炎细胞因子IL-1β表达。Notch信号通路可以通过降低Treg细胞数量来介导免疫应答,加剧免疫炎症反应。本研究发现与正常组比较,模型组外周血CD4+CD25+Treg表达降低,外周血CD4+CD25+Notch1+T细胞和CD4+CD25+Notch3+T细胞表达降低,而细胞因子IL-2、IL-17显著升高。说明 Treg免疫耐受能力降低可能直接导致免疫炎症产生。CD4+CD25+Treg细胞不但对pSS大鼠体内的炎症反应有抑制作用,同时可抑制由炎症引起的肺组织细胞损伤。
综上所述,Notch信号通路可以通过降低Treg细胞数量,上调炎性细胞因子IL-2、IL-17表达,下调IL-5及RBP-J表达,促使T细胞向Th1方向分化,导致pSS炎症反应升高,最终导致pSS肺功能降低。