西达本胺对肾癌786-O细胞增殖、凋亡与侵袭的影响及其机制①
2019-10-23颜国华王世广王丽君
颜国华 高 鹏 王世广 王丽君
(郑州工业应用技术学院,新郑451100)
肾癌是来源于肾小管上皮细胞的腺癌,其中70%以上为肾透明细胞癌[1]。全世界每年新增肾癌患者约40.3万例,每年死于肾癌者达17.5万例[2]。由于肾癌缺乏可靠的诊断标志物和早期临床症状,约30%的患者在确诊时就已经发生转移,这部分患者的中位生存期仅为1年[3]。肾癌对放化疗不敏感,手术切除仍然是肾癌治疗的主要手段,但术后存在较高的复发和转移风险[4]。近年来,针对肾癌的分子靶向治疗取得了快速发展。索拉非尼、舒尼替尼、帕唑帕尼和阿昔替尼等肾癌靶向药物已应用于临床,然而临床治疗效果并不理想[5]。因此,研发新的靶向药物仍然是目前肾癌治疗领域的研究热点之一。西达苯胺(Chidamide,CDM)是我国自主研发的首个选择性组蛋白去乙酰化酶抑制剂(Histone deacetylase inhibitor,HDACi),通过表观遗传调控机制,在抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡、逆转耐药肿瘤细胞多药耐药性、增强自然杀伤细胞和抗原特异性细胞毒T细胞介导的肿瘤杀伤作用等方面发挥抗肿瘤作用[6-9]。但目前关于CDM对肾癌细胞的抑制作用在国内外尚未见报道。本研究以人肾透明细胞癌786-O细胞和人正常肾小管上皮HKC细胞为实验对象,旨在探究CDM对786-O细胞凋亡、增殖和侵袭的影响及其机制。本研究将为肾癌的靶向治疗提供新思路。
1 材料与方法
1.1材料 人肾透明细胞癌786-O细胞和人肾小管上皮HKC细胞购自中国医学科学院基础医学研究所基础医学细胞中心;CDM(批号420001-201201,100 mg/支,纯度≥99.5%)购自中国药品生物制品检定所;胎牛血清和RPMI1640培养基购自美国Hyclone公司;CCK-8试剂盒购自武汉博士德生物公司;DMSO、PI、AnnexinV-FITC凋亡检测试剂盒和细胞周期检测试剂盒购自南京凯基生物科技发展有限公司;Matrigel基质胶和Transwell小室购自美国Corning公司;Edu-555细胞增殖检测试剂盒、结晶紫染色液、RIPA裂解液和ECL化学发光试剂盒购自上海碧云天生物技术有限公司;兔抗人细胞周期蛋白B1(Cyclin B1)、Cyclin依赖激酶1(Cyclin-dependent kinase 1,CDK1)、Bcl-2、Bax、基质金属蛋白酶2(Matrix metalloproteinase 2,MMP2)、MMP9、β-actin单克隆抗体和辣根过氧化物酶标记山羊抗兔IgG购自美国Abcam公司。
1.2方法
1.2.1细胞培养 786-O细胞和HKC细胞用含10%胎牛血清的RPMI1640培养液,在37℃、5% CO2条件下培养;当细胞覆盖率达到80%时,用0.25 %的胰蛋白酶消化,按1∶3的比例传代。
1.2.2药物配置 将CDM溶于二甲基亚砜(Dime-thyl sulfoxide,DMSO)配制成100 mmol/L的储备液,分装后于-20℃保存;使用时用细胞培养液稀释至所需浓度,其中DMSO终浓度为0.05%;对照组使用含0.05% DMSO的细胞培养液。
1.2.3CCK-8法检测细胞活力 取对数生长期786-O细胞和HKC细胞,以每孔5 000个的数量接种于96孔板;培养24 h后,实验孔分别加入100 μl含不同浓度CDM(0.5、1、2、5、10、20 μmol/L)的细胞培养液,同时设调零孔和对照孔,每组设5个复孔;培养48 h后,每孔加入10 μl CCK-8溶液,37℃孵育1 h,用酶标仪于450 nm波长处检测吸光度A值;计算细胞活力,细胞活力=(实验组A值-调零组A值)/(对照组A值-调零组A值)×100%;使用SPSS16.0软件的Probit回归模型计算CDM对786-O细胞的半数抑制浓度(Half maximal inhibitory concentration,IC50)。实验重复3次。
1.2.4EdU掺入法检测细胞增殖 取对数生长期786-O细胞,以每孔5×105个的数量接种于6孔板,常规培养24 h后去上清,加入不同剂量CDM (0、5、10 μmol/L)处理48 h;加入1 ml用细胞培养液按1∶500 稀释的EdU溶液,37℃孵育2 h;PBS洗涤2次,加入1 ml固定液,室温固定15 min;PBS洗涤2次,加入1 ml通透液,室温孵育15 min;PBS洗涤2次,加入0.5 ml Click反应液,室温避光孵育 30 min;PBS洗涤2次,使用流式细胞仪检测EdU阳性细胞比例。实验重复3次。
1.2.5流式细胞术检测细胞周期 细胞处理同1.2.4,收集各组细胞,PBS洗涤2次;加入1 ml 70%冰乙醇于4℃固定24 h;PBS洗涤2次,加入碘化丙啶(Propidium iodide,PI)染色液,4℃避光染色30 min;使用流式细胞仪分析细胞周期。实验重复3次。
1.2.6流式细胞术检测细胞凋亡 细胞处理同1.2.4,收集各组细胞,用PBS洗涤2次;重悬细胞于400 μl Annexin V-FITC结合液中,加入5 μl AnnexinV-FITC,4℃避光孵育15 min;加入10 μl PI染色液,4℃避光孵育15 min;使用流式细胞仪分析检测细胞凋亡。实验重复3次。
1.2.7Transwell法检测细胞侵袭 将Matrigel基质胶与RPMI1640培养基按1∶6 稀释,取50 μl均匀铺到Transwell小室的底部,然后将Transwell小室放入24孔板中,于37℃孵育过夜使其成凝胶状;向小室下方的24孔板中加入600 μl细胞培养液,向小室内加入经不同剂量CDM(0、0.5、1 μmol/L)处理48 h后的786-O细胞(细胞数量为4 000个/孔),37℃孵育12 h;取出小室,用棉签擦去小室内的Matrigel基质胶和细胞,PBS洗涤2次,甲醛固定30 min;PBS洗涤2次,结晶紫染色20 min;PBS 洗涤2次,显微镜下观察小室下表面附着的侵袭细胞,随机挑选5个视野拍照计数;计算侵袭率,侵袭率(%)=(实验组侵袭细胞数/对照组侵袭细胞数)×100%。实验重复3次。
1.2.8Western blot法检测蛋白水平 收集各组细胞,用RIPA裂解各组细胞提取总蛋白,用紫外分光光度法测定蛋白质浓度,取25 μg蛋白样品进行SDS-PAGE电泳并转移至PVDF膜,用5%脱脂奶粉封闭1 h,加入一抗(1∶1 000稀释),4℃孵育过夜;TBST洗膜3次,加入二抗(1∶2 000稀释),室温下孵育1 h;TBST洗膜3次,加入ECL进行发光反应,暗室X胶片显影,拍照,使用Image J1.45s软件进行灰度分析。以目标蛋白与内参β-actin的灰度比作为目标蛋白的相对表达水平。实验重复3次。

2 结果
2.1CDM对细胞活力的影响 如图1所示,与对照组相比,不同剂量CDM(0.5、1、2、5、10、20 μmol/L)处理48 h后,786-O细胞活力明显下降(P<0.05),且随着CDM剂量的增加呈下降趋势,IC50为11.83 μmol/L;而HKC细胞活力在20 μmol/L浓度作用下才明显降低(P<0.05)。这表明CDM对人正常肾小管上皮HKC细胞的毒性作用较小,但对人肾透明细胞癌786-O细胞具有较强的毒性作用,并呈剂量依赖性。
2.2CDM对786-O细胞增殖的影响 如图2所示,与对照组相比,5 μmol/L和10 μmol/L CDM组细胞的EdU阳性率显著降低(P<0.05);同时,10 μmol/L CDM组细胞的EdU阳性率显著高于5 μmol/L CDM组(P<0.05)。这表明CDM可剂量依赖性地抑制786-O细胞增殖。
2.3CDM对786-O细胞周期的影响 如图3所示,与对照组相比,5 μmol/L和10 μmol/L CDM组G2/M期细胞比例显著升高(P<0.05),G0/G1期和S期细胞比例明显降低(P<0.05);与5 μmol/L CDM组相比,10 μmol/L CDM组G2/M期细胞比例显著升高(P<0.05),G0/G1期和S期细胞比例明显降低(P<0.05)。这表明CDM可诱导786-O细胞发生G2/M期阻滞,且呈剂量依赖性。

图1 786-O和HKC细胞活力的变化Fig.1 Changes of cell viability in 786-O and HKC cellsNote: *.P<0.05 versus control group;#.P<0.05 versus 2 μmol/L CDM group;△.P<0.05 versus 5 μmol/L CDM group;▲.P<0.05 versus 10 μmol/L CDM group.
2.4CDM对786-O细胞凋亡的影响 如图4所示,与对照组相比,5 μmol/L和10 μmol/L CDM组细胞凋亡率显著升高(P<0.05);10 μmol/L CDM组细胞凋亡率显著高于5 μmol/L CDM组(P<0.05)。这表明CDM可剂量依赖性地诱导786-O细胞凋亡。
2.5CDM对Cyclin B1、CDK1、Bcl-2和Bax蛋白表达水平的影响 如图5所示,与对照组相比, 5 μmol/L和10 μmol/L CDM组细胞中Cyclin B1、CDK1和Bcl-2蛋白表达水平显著降低(P<0.05),而Bax蛋白表达水平明显升高(P<0.05);且5 μmol/L和10 μmol/L CDM组间Cyclin B1、CDK1、Bcl-2和Bax蛋白表达水平的差异有统计学意义(P<0.05)。

图2 CDM抑制786-O细胞增殖Fig.2 CDM inhibits proliferation of 786-O cellsNote: A.EdU assay;B.Statistical analysis.*.P<0.05 versus control group;#.P<0.05 versus 5 μmol/L CDM group.

图3 CDM阻滞786-O细胞于G2/M期Fig.3 CDM arrests cell cycle of 786-O cells at G2/M phaseNote: A.Cell cycle analysis;B.Statistical analysis.*.P<0.05 versus control group;**.P<0.01 versus control group;#.P<0.05 versus 5 μmol/L CDM group.

图4 CDM诱导786-O细胞凋亡Fig.4 CDM induces apoptosis of 786-O cellsNote: A.Apoptosis detection;B.Statistical analysis.*.P<0.05 versus control group;#.P<0.05 versus 5 μmol/L CDM group.
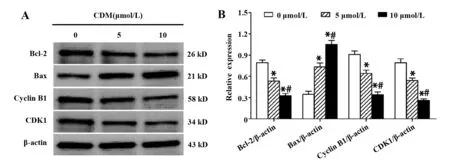
图5 CDM对786-O细胞Cyclin B1、CDK1、Bcl-2和Bax蛋白表达水平的影响Fig.5 Effect of CDM on protein expression of Cyclin B1,CDK1,Bcl-2 and Bax in 786-O cellsNote: A.Western blot assay;B.Statistical analys.*.P<0.05 versus control group;#.P<0.05 versus 5 μmol/L CDM group.
2.6CDM对786-O细胞侵袭的影响 在采用Transwell法检测细胞侵袭时,为避免因药物剂量过大对细胞活力产生的抑制作用,本研究选择对细胞活力未产生明显抑制作用的0.5和1 μmol/L两个浓度。如图6所示,与对照组相比,0.5 μmol/L和1 μmol/L CDM组细胞侵袭率显著降低(P<0.05);同时,1 μmol/L CDM组细胞侵袭率显著高于0.5 μmol/L CDM组(P<0.05)。这表明CDM可剂量依赖性地抑制786-O细胞侵袭。
2.7CDM对MMP2和MMP9蛋白表达水平的影响 如图7所示,与对照组相比,0.5 μmol/L和1 μmol/L CDM组细胞中MMP2和MMP9蛋白表达水平显著降低(P<0.05);同时,1 μmol/L CDM组细胞中MMP2和MMP9蛋白表达水平显著低于0.5 μmol/L CDM组(P<0.05)。

图6 CDM抑制786-O细胞侵袭Fig.6 CDM inhibits invasion of 786-O cellsNote: A.Transwell assay;B.Statistical analysis.*.P<0.05 versus control group;#.P<0.05 versus 0.5 μmol/L CDM group.

图7 CDM对786-O细胞MMP2和MMP9蛋白表达水平的影响Fig.7 Effect of CDM on protein expression of MMP2 and MMP9 in 786-O cellsNote: A.Western blot assay;B.Statistical analys.*.P<0.05 versus control group;#.P<0.05 versus 0.5 μmol/L CDM group.
3 讨论
目前,在中国临床上已经普及应用的肾癌靶向治疗药物有索拉非尼、舒尼替尼、阿昔替尼和培唑帕尼。这4种药物均以血管内皮生长因子受体为靶点,通过抗肿瘤血管生成发挥抗肿瘤作用。尽管肾癌靶向治疗药物有效提高了晚期肾癌患者的客观缓解率及无进展生存期,但仍具有一定毒副作用,并且患者最终几乎都会出现耐药[10]。HDACi可通过特异性调节组蛋白乙酰化水平以逆转肿瘤发生与进展过程中的表观遗传学改变,凭借其显著的治疗效果和较小的毒副作用,成为目前受国内外学者广泛关注的、最有前景的一类抗肿瘤药物[11]。
由我国自主研发的CDM是全球首个获准上市的亚型选择性HDACi,目前已批准用于治疗外周T细胞淋巴瘤。最近的研究表明,CDM对多种肿瘤细胞具有抑制作用,如多发性骨髓瘤、白血病、腺样囊性癌、肺癌和胰腺癌等,因而成为有潜力的抗肿瘤药物[12-16]。本研究发现,CDM对人肾透明细胞癌786-O细胞具有显著的毒性作用,IC50为11.83 μmol/L,并呈剂量依赖性地抑制786-O细胞增殖和诱导其凋亡。
肿瘤细胞以有丝分裂的方式进行增殖,从一次有丝分裂完成到下一次有丝分裂结束所经历的全过程称为细胞周期,分为G0/G1期、S期和G2/M期。每个时期具有各自特征性的Cyclin,而Cyclin可激活特定的CDK,磷酸化相应的底物,使细胞周期顺序推进[17]。在G2期,Cyclin B1与CDK1形成的复合物称为成熟促进因子(Maturation promoting factor,MPF),它可以使细胞从G2期进入M期[18]。近年来有研究发现,CDM可阻滞多种肿瘤细胞于G2/M期,如白血病、腺样囊性癌、肺癌和胰腺癌[13-16]。本研究证实,高剂量CDM诱导786-O细胞发生G2/M期阻滞,这可能与其剂量依赖地下调Cyclin B1和CDK1蛋白表达水平有关。
Bcl-2蛋白家族在调控细胞凋亡过程中发挥着重要作用[19,20]。Bcl-2蛋白家族以功能可以分为两大类:一类是抗凋亡蛋白,主要有Bcl-2、Bcl-w、Bcl-xl和骨髓细胞白血病因子1等;另一类是促凋亡蛋白,主要包括Bax、Bad、Bak和Bid等。Bax可通过插入线粒体外膜并聚合成孔道,或与线粒体外膜的电压依赖性离子通道结合致使线粒体通透性转换孔持续开放,触发线粒体外膜透化,使线粒体膜间腔中的多种促凋亡蛋白释放至胞浆,导致细胞凋亡[21]。定位在线粒体外膜上的Bcl-2可与Bax形成异源二聚体,从而抑制细胞凋亡[19]。本研究发现高剂量CDM可剂量依赖性地诱导786-O细胞凋亡,这可能与其下调Bcl-2蛋白表达以及上调Bax蛋白表达有关。
细胞外基质和基底膜是限制肿瘤细胞侵袭和转移的重要屏障,但肿瘤细胞可通过分泌多种MMPs降解细胞外基质和基底膜从而侵入周边组织,并穿入血管和淋巴管向远处转移。MMPs属于锌依赖性内肽酶家族,其中MMP2和MMP9主要降解Ⅳ型胶原蛋白,而Ⅳ型胶原蛋白正是构成细胞外基质和基底膜的主要成分。Sitaram等[22]研究证实,MMP抑制剂TAPI-2可阻断转化生长因子β(Transforming growth factor-β,TGF-β)诱导的肾癌786-O细胞和A498细胞侵袭。本研究发现,低毒剂量CDM可抑制786-O细胞侵袭,这可能与其剂量依赖性地下调MMP2和MMP9蛋白表达有关。
综上所述,CDM可在体外剂量依赖性抑制人肾癌786-O细胞增殖和侵袭,并引起G2/M期阻滞和诱导细胞凋亡,这可能与其下调Cyclin B1、CDK1、Bcl-2、MMP2和MMP9蛋白表达,以及上调Bax蛋白表达有关。这将为CDM用于治疗肾癌提供新的理论依据。