黄芪匀浆膳通过NLRP3炎症小体通路影响创伤应激大鼠肠黏膜免疫功能①
2019-10-23王如华李勇华肖明力
王如华 李勇华 龙 明 邹 飞 肖明力
(重庆三峡医药高等专科学校普外科,重庆404000)
机体创伤后处于应激状态,免疫反应和代谢发生改变。肠道是应激反应的一个中心器官,人们对肠道黏膜免疫越来越重视[1]。肠内营养对保护肠屏障功能发挥重要作用,普通肠内营养可较好地治疗单纯的营养不良,但无法改善应激状态下肠黏膜免疫功能下降的情况。有研究者提出,通过在普通营养液中添加一些特殊的营养素能改善肠道黏膜功能,提高免疫反应[2]。中医药在黏膜免疫系统中的应用和开发是近年来的研究热点。黄芪是我国传统的中药材之一,具有增强免疫、保肝、利尿、抗衰老、抗应激、降压和抗菌等作用[3-5]。黄芪匀浆膳是将黄芪水煎液加入匀浆膳中,所含营养成分与正常食物相似,因其已被粉碎,渗透浓度低,所以利于消化吸收且对肠道无刺激,为机体提供足够能量和所需营养素之外,还能提高机体的免疫能力。前期,本课题组已研究发现,黄芪匀浆膳可提高创伤应激大鼠肠黏膜免疫功能[6],但黄芪匀浆膳改善创伤应激大鼠肠黏膜免疫功能的作用机制还不清楚。NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎症小体途径是机体发挥免疫功能的重要途径之一。NLRP3炎症小体受到刺激后,可调控效应蛋白caspase-1活化,分解成caspase-1片段,促进IL-1β和IL-18的成熟与释放,加剧炎症反应,参与炎症和免疫性疾病的发生发展[7-9]。本研究通过构建创伤应激大鼠模型,观察黄芪匀浆膳对创伤应激大鼠肠黏膜淋巴细胞亚群、炎性细胞因子、NLRP3炎症小体通路相关因子IL-1β和IL-18,以及NLRP3、蛋白凋亡相关斑点样蛋白(Apoptosis associated speck-like protein,ASC)、cleaved-caspase-1 mRNA和蛋白表达的影响,初步探讨黄芪匀浆膳提高机体肠黏膜免疫功能的可能机制,为黄芪匀浆膳在营养保健等领域的应用提供一定的理论依据。
1 材料与方法
1.1材料
1.1.1实验动物 健康成年雄性SD大鼠72只,清洁级,体重180~250 g,由中南大学医学动物部提供。本研究经动物伦理委员会批准。
1.1.2主要试剂和仪器 NLRP3激活剂尿酸单钠盐(Monosodium urate,MSU)购自Abcam公司,使用时用PBS溶解。分泌型免疫球蛋白SIgA、IL-2、IL-4、IL-6、转化生长因子-β(TGF-β)、肿瘤坏死因子-γ(IFN-γ)、IL-1β和IL-18试剂盒均购自南京建成生物工程研究所。大鼠抗小鼠CD3+、CD4+、CD8+和CD19+单克隆抗体购自美国Biolegend公司。β-actin单克隆抗体购自北京中杉金桥生物公司。NLRP3和cleaved-caspase-1抗体购自英国Abcam公司。ASC抗体购自美国CST公司。BCA蛋白测定试剂盒和Western blot相关试剂均购自上海碧云天生物技术有限公司。流式细胞仪美国贝克曼公司。WB电泳仪、电泳槽和凝胶成像系统为美国Bio-Rad公司。Mx3000p RT-PCR分析系统为美国安捷伦公司。
1.2方法
1.2.1实验分组及创伤大鼠模型建立 SD大鼠适应性饲养一周后,随机数字表法分为5组:空白组、模型组、黄芪匀浆膳组、NLRP3激活剂组、NLRP3激活剂+黄芪匀浆膳组,每组12只。禁食不禁水12 h,除空白组外,其他各组大鼠均用1%的氯胺酮麻醉后俯卧,备皮消毒,切开双侧下背部皮肤,行双侧股骨离断术,缝合皮肤后将大鼠仰卧无菌剖腹,在胃前壁置入内径为 1.6 mm 带有侧孔的硅胶管,双荷包固定缝合,经皮下隧道穿出,固定输液装置固定于肩胛间皮肤处。空白对照组:代谢笼内正常进食;模型组:创伤后3~5 h开始正常进食;黄芪匀浆膳组:创伤后3~5 h 开始服用黄芪水煎液加匀浆膳,匀浆膳由牛奶、鸡蛋、瘦肉、大豆、馒头等食物组成,经胶体磨加工,由韩国生产的中药煎药机蒸煮包装(100 ml匀浆膳含热量为418.4 kJ,蛋白质5.0 g、碳水化合物13.0 g、脂肪 3.0 g),黄芪水煎液分别相当于原生药20 g/kg的剂量,匀浆膳用量为837 kJ(200 kcal)/(kg· d),4次/d;NLRP3激活剂组:尾静脉注射尿酸单钠盐的PBS溶液;NLRP3激活剂+黄芪匀浆膳组:尾静脉注射尿酸单钠盐的PBS溶液后,服用黄芪水煎液加匀浆膳,用法和用量同黄芪匀浆膳组。
1.2.2流式细胞仪检测CD3+、CD4+、CD8+和CD19+创伤应激大鼠营养支持14 d后,禁食12 h,脱颈椎处死。参考文献[10]分离小肠黏膜固有层淋巴细胞。取5×105个分离获得的淋巴细胞,分别与大鼠抗小鼠CD3+、CD4+、CD8+和CD19+单克隆抗体孵育(4℃,50 min),4%大鼠血清封闭非特异抗原,离心洗脱2遍后,与APC二抗孵育10 min,离心漂洗后流式细胞仪检测。
1.2.3ELISA法检测小肠黏膜淋巴细胞因子表达和SIgA含量测定 参照文献方法[11],用镊子与剪刀小心取出靠近十二指肠段空肠约3 cm,称重,刮取肠黏膜组织。将肠黏膜组织制成匀浆,离心(3 500 g,25 min),收集上清液-20℃保存。采用ELISA法按照试剂盒说明检测上清液中SIgA、IL-2、IL-4、IL-6、TGF-β、IFN-γ、IL-1β、IL-18的浓度。
1.2.4RT-PCR检测肠黏膜组织NLRP3、ASC、cleaved-caspase-1 mRNA表达 用Trizol裂解肠黏膜组织,经氯仿抽提、异丙醇沉淀、75%乙醇洗涤后使用DEPC水溶解,分光光度计测定总RNA含量和纯度。然后利用反转录试剂盒将RNA反转录为cDNA。按照荧光定量试剂盒说明操作,置于定量PCR仪检测。反应条件:95℃ 30 s;95℃ 5 s,60℃ 1 min,72℃ 30 s,总共进行45个循环。以β-actin作为内参,采用2-ΔΔCt法计算mRNA的相对表达水平。内参、NLRP3、ASC和cleaved-caspase-1引物序列如表1所示。
1.2.5Western blot检测肠黏膜组织NLRP3、ASC、cleaved-caspase-1蛋白表达 分别取0.1 g各实验组肠黏膜组织,加入RIPA组织裂解液(含0.01 mmol/L PMSF),在冰上充分裂解30 min。然后离心(4℃、12 000 g,5 min),收集上清,BCA法测定蛋白浓度。取一定量蛋白样品加入上样缓冲液,100℃煮沸 5 min,离心(5 000 g,5 min)。进行SDS-PAGE,待溴酚蓝至胶底,Marker完全分开电泳结束。采用半干转膜仪进行恒压转膜。转膜后,用适当TBST冲洗PVDF膜,5%脱脂奶粉室温封闭2 h。TBST清洗后加入一抗,4℃孵育过夜。TBST清洗后加入二抗,室温下放置2 h。TBST洗涤后加入ECL显影,凝胶成像系统成像,拍照。以β-actin为内参,用Image pro plus 7.0软件分析各蛋白条带灰度值。

2 结果
2.1淋巴细胞亚群比较 与空白对照组相比,模型组CD3+、CD4+、CD4+/CD8+和CD19+显著降低(P<0.05),CD8+无明显变化(P>0.05)。与模型组相比,黄芪匀浆膳组、NLRP3激活剂+黄芪匀浆膳组
CD3+、CD4+、CD4+/CD8+均显著升高(P<0.05),CD8+无明显变化(P>0.05);NLRP3激活剂组CD3+、CD4+、CD4+/CD8+显著降低(P<0.05),CD8+无明显变化(P>0.05)。与NLRP3激活剂组相比,NLRP3激活剂+黄芪匀浆膳组CD3+、CD4+、CD4+/CD8+和CD19+均显著升高(P<0.05),CD8+无明显变化(P>0.05)。结果如表2所示。
2.2小肠黏膜淋巴细胞因子和SIgA含量比较 与空白对照组相比,模型组SIgA、IL-2、IL-4、IFN-γ和TGF-β显著降低(P<0.05),IL-6、IL-1β和IL-18显著升高(P<0.05)。与模型组相比,黄芪匀浆膳组、NLRP3激活剂+黄芪匀浆膳组SIgA、IL-2、IL-4、IFN-γ、TGF-β均显著升高(P<0.05),IL-6、IL-1β和IL-18均显著降低(P<0.05);NLRP3激活剂组SIgA、IL-2、IL-4、IFN-γ和TGF-β显著降低(P<0.05),IL-6、IL-1β和IL-18显著升高(P<0.05)。与NLRP3激活剂组比,NLRP3激活剂+黄芪匀浆膳组SIgA、IL-2、IL-4、IFN-γ、TGF-β均显著升高(P<0.05),IL-6、IL-1β和IL-18均显著降低(P<0.05)。结果如表3所示。
表1 β-actin、NLRP3、ASC和cleaved-caspase-1引物序列
Tab.1 β-actin,NLRP3,ASC and cleaved-caspase-1 primer sequence

GenePrimersβ-actinUpsteams 5′-TGTCACCAACTGGGACGATA-3′Downstreams 5′-GGGGTGTTGAAGGTCTCAAA-3′NLRP3Upsteams 5′-TCTGTTCATTGGCTGCGGA-3′Downstreams 5′-GCCTTTTTCGAACTTGCCGT-3′ASCUpsteams 5′-GCTGCAGATGGACCCCATAG-3′Downstreams 5′-ACATTGTGAGCTCCAAGCCA-3′cleaved-caspase-1Upsteams 5′-CACGAGACCTGTGCGATCAT-3′Downstreams 5′-CTTGAGGGAACCACTCGTC-3′
表2 淋巴细胞亚群比较
Tab.2 Comparison of lymphocyte subsets

Groups CD3+(%)CD4+(%)CD8+(%)CD4+/CD8+CD19+(%)Blank control group57.69±1.0647.93±2.3622.26±2.042.15±0.1211.36±1.06Model group49.35±0.961)35.25±2.711)21.06±1.531.67±0.111)9.11±1.051)Homogenate diet group56.91±0.952)46.39±2.612)22.61±1.912.05±0.082)11.35±0.962)NLRP3 activator group45.02±0.812)30.34±2.512)21.04±1.481.44±0.122)8.03±0.97NLRP3 activator+Astragalushomogenate diet group53.35±0.822)3)40.89±2.512)3)22.02±1.611.86±0.052)3)10.94±1.112)3)
Note:Compared with blank control group,1)P<0.05;compared with model group,2)P<0.05;compared with NLRP3 activator group,3)P<0.05.
表3 小肠黏膜淋巴细胞因子和SIgA含量比较
Tab.3 Intestinal mucosal lymphocyte factor and SIgA content

GroupsSIgA(mg/g)IL-2(ng/g)IL-4(ng/g)IL-6(ng/g)Blank control group1.95±0.2139.25±4.7517.62±1.8510.54±1.39Model group1.26±0.131)24.31±2.651)14.29±1.081)16.17±1.581)Homogenate diet group1.86±0.172)37.62±4.532)16.93±1.742)11.89±1.422)NLRP3 activator group1.01±0.0920.05±2.3711.08±1.0019.01±1.72NLRP3 activator+Astragalus homogenate diet group1.64±0.142)3)32.13±4.212)3)15.29±1.372)3)14.92±1.352)3)Groups TGF-β(ng/g)IFN-γ(ng/g)IL-1β(pg/ml)IL-18(pg/ml)Blank control group90.37±8.29105.26±6.342.62±0.86101.31±10.25Model group36.19±5.911)85.83±4.241)7.51±1.211)190.26±21.311)Homogenate diet group86.49±7.922)101.17±5.192)3.15±0.812)129.14±11.952)NLRP3 activator group31.15±5.8980.87±4.267.06±1.19201.76±21.03NLRP3 activator+Astragalus homogenate diet group70.74±7.082)3)92.58±4.872)3)5.69±0.912)3)162.24±14.592)3)
Note:Compared with blank control group,1)P<0.05;compared with model group,2)P<0.05;compared with NLRP3 activator group,3)P<0.05.

图1 肠黏膜组织NLRP3、ASC和cleaved-caspase-1 mRNA表达比较Fig.1 Comparison of expression of NLRP3,ASC and cleaved-caspase-1 in intestinal mucosaNote: A,B,C,D,E and F were respectively expressed as blank control group,Model group,homogenate diet group,NLRP3 activator group,NLRP3 activator+Astragalus homogenate diet group.Compared with blank control group,*.P<0.05;compared with model group,#.P<0.05;compared with NLRP3 activator group,▲.P<0.05.
2.3肠黏膜组织NLRP3、ASC和cleaved-caspase-1 mRNA表达 与空白对照组相比,模型组NLRP3、ASC、cleaved-caspase-1 mRNA均显著升高(P<0.05)。与模型组相比,黄芪匀浆膳组、NLRP3激活剂+黄芪匀浆膳组NLRP3、ASC、cleaved-caspase-1 mRNA均显著降低(P<0.05);NLRP3激活剂组NLRP3、ASC、cleaved-caspase-1 mRNA显著升高(P<0.05)。与NLRP3激活剂组相比,NLRP3激活剂+黄芪匀浆膳组NLRP3、ASC、cleaved-caspase-1 mRNA均显著降低(P<0.05)。结果如图1所示。
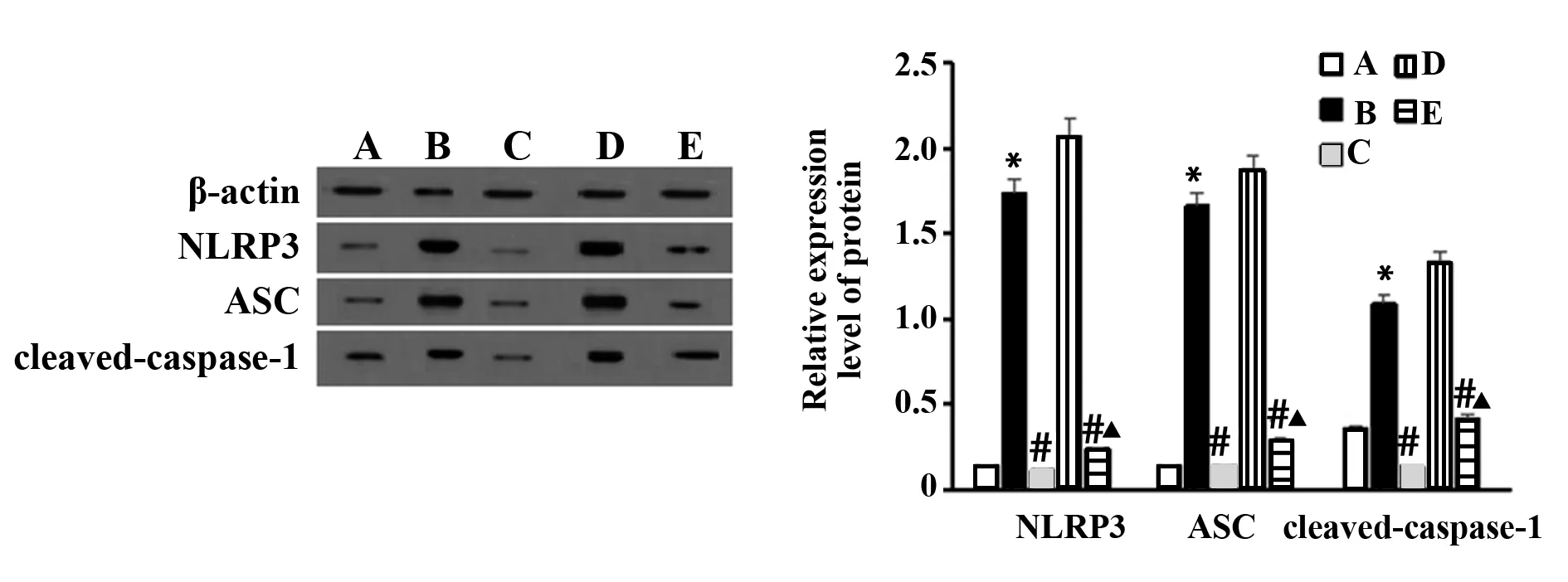
图2 NLRP3、ASC和cleaved-caspase-1蛋白表达Fig.2 Expression of NLRP3,ASC and cleaved-caspase-1Note: A,B,C,D,E and F were respectively expressed as blank control group,Model group,homogenate diet group,NLRP3 activator group,NLRP3 activator+Astragalus blenderized diet group.Compared with blank control group,*.P<0.05;compared with model group,#.P<0.05;compared with NLRP3 activator group,▲.P<0.05.
2.4肠黏膜组织NLRP3、ASC和cleaved-caspase-1蛋白表达 Western blot结果显示,与空白对照组相比,模型组NLRP3、ASC、cleaved-caspase-1 蛋白表达均显著升高(P<0.05)。与模型组相比,黄芪匀浆膳组、NLRP3激活剂+黄芪匀浆膳组NLRP3、ASC、cleaved-caspase-1 蛋白均显著降低(P<0.05);NLRP3激活剂组NLRP3、ASC、cleaved-caspase-1 蛋白表达显著升高(P<0.05)。与NLRP3激活剂组比,NLRP3激活剂+黄芪匀浆膳组NLRP3、ASC、cleaved-caspase-1 蛋白表达均显著降低(P<0.05)。结果如图2所示。
3 讨论
手术和创伤后机体常处于应激状态,肠道是应激反应的中心器官之一,肠黏膜免疫在现代免疫预防中处于中心地位。近年来,研究者们对中医药在黏膜免疫系统中的应用和开发越来越关注。黄芪是我国常用的传统中药材。研究发现,黄芪可改善免疫功能低下大鼠的肝损伤,提高大鼠免疫力[12]。肠内营养添加黄芪可改善烧伤早期免疫功能低下[13]。本课题组前期研究也发现,黄芪匀浆膳可改善创伤应激大鼠肠黏膜免疫功能,但其发挥作用的机制还未知。本研究基于NLRP3炎症小体通路初步探讨了黄芪匀浆膳提高创伤应激大鼠肠黏膜免疫功能的作用途径。
黏膜免疫功能主要通过调节细胞水平、细胞因子水平和以SIgA为主的肠道水平黏膜3种免疫机制发挥免疫作用。CD3+是成熟T淋巴细胞的标志,能反映细胞免疫功能水平[14]。CD4+T细胞通过识别抗原表位并被活化,产生细胞因子,增殖和分化成效应细胞促进、抑制和调节对蛋白抗原的免疫反应,以及通过接触靶细胞释放信号,使靶细胞和细胞因子发挥免疫调节作用。CD8+细胞是细胞毒T细胞,通过与靶细胞的接触,对靶细胞产生杀伤作用。机体在创伤、焦虑、应激后细胞免疫功能降低,CD3+和CD4+减少,CD4+/CD8+比率下降[16]。CD19+是B细胞表面Ⅰ型跨膜蛋白,属免疫球蛋白超家族成员,CD19+B细胞减少时血清免疫球蛋白水平降低,体液免疫反应低下[17]。本研究结果显示,模型组CD3+、CD4+、CD4+/CD8+和CD19+较空白对照组显著降低,黄芪匀浆膳组较模型组CD3+、CD4+、CD19+水平以及CD4+/CD8+值显著提高,说明黄芪匀浆膳可有效提高创伤应激大鼠淋巴细胞数量,增强机体免疫功能。
分泌型免疫球蛋白SIgA是肠黏膜免疫的主要效应因子,能有效抑制病原体等有害物质的入侵,发挥调节吞噬和溶解作用[18]。SIgA介导的免疫应答依赖于T细胞的辅助,T细胞分泌的Th1细胞因子(IL-2、IFN-γ、TGF-β)与Th2细胞因子(IL-4、IL-6)可相互调节,维持黏膜SIgA Th1/Th2系统平衡[19,20]。本研究结果显示,模型组大鼠SIgA、IL-2、IL-4、IFN-γ和TGF-β较空白对照组显著降低,IL-6显著升高,说明大鼠创伤后机体促炎和抗炎细胞因子不平衡,免疫功能低下。与模型组相比,黄芪匀浆膳组SIgA、IL-2、IL-4、IFN-γ、TGF-β均显著升高,IL-6显著降低,说明创伤后给予大鼠黄芪匀浆膳可促进促炎和抗炎细胞因子平衡,提高机体肠黏膜免疫功能。
NLRP3炎症小体是由NLRP3、ASC和caspase-1组成的大分子蛋白复合物,在人体T细胞、B细胞、单核巨噬细胞等免疫细胞中广泛表达,在炎症和免疫反应中发挥核心作用[21]。NLRP3炎症小体在受到刺激后,可活化效应蛋白caspase-1,进而促进IL-1β和IL-18的成熟与释放,加剧炎症反应,参与免疫性疾病的发生发展[22,23]。本研究结果显示,模型组NLRP3、ASC、cleaved-caspase-1 mRNA和蛋白表达较空白对照组显著增加,黄芪匀浆膳组NLRP3、ASC、cleaved-caspase-1 mRNA和蛋白表达较模型组显著降低;加入NLRP3抑制剂后,黄芪匀浆膳抑制NLRP3、ASC、cleaved-caspase-1 mRNA和蛋白表达的作用降低,提示黄芪匀浆膳可能通过抑制NLRP3炎症小体通路改善创伤应激大鼠的肠黏膜免疫功能。各实验组IL-1β和IL-18表达变化情况与NLRP3、ASC、cleaved-caspase-1 mRNA和蛋白变化情况一致,进一步说明黄芪匀浆膳可能通过NLRP3炎症小体通路减轻创伤大鼠肠黏膜免疫损伤,改善免疫功能。
综上所述,黄芪匀浆膳可调节创伤大鼠肠黏膜淋巴细胞和炎性细胞因子,降低NLRP3炎症小体通路NLRP3、ASC、cleaved-caspase-1 mRNA和蛋白表达,提示其可能通过抑制NLRP3炎症小体通路激活提高创伤应激大鼠的肠黏膜免疫功能,且其作用要强于肠内营养多聚合剂,具有开发成中医药特色的肠内营养制剂的巨大潜力。