miR-3168靶向PDCD5调控A549细胞凋亡①
2019-10-23燕国丽胡作为成薇婷
燕国丽 胡作为 成薇婷
(武汉市第一医院肿瘤科,武汉430000)
肺癌仍然是全球癌症死亡的首要原因[1],其是导致男性癌症死亡的主要原因,也是女性癌症死亡的第二大原因[2]。有研究显示,相比于正常人群,miR-3168 在肺癌患者中表达上调[3]。但是miR-3168表达上调的原因和其导致的结果的分子机制目前尚无研究。已经在多种人类肿瘤中发现程序性细胞死亡因子5(Programmed cell death 5,PDCD5)的表达降低,例如乳腺癌、肝细胞癌、肺癌、胃癌、慢性髓性白血病、星形细胞胶质瘤、软骨肉瘤、喉鳞状细胞癌和卵巢癌[4]。最近的研究显示肿瘤抑制因子PDCD5在p53介导的细胞凋亡中起积极作用[5],当细胞DNA被破坏时,PDCD5与Tip60形成复合物,其从胞质溶胶转移至细胞核,通过Lys-120处的p53乙酰化促进DNA损伤反应[6]。此外,PDCD5与BAX相互作用以介导细胞色素C释放[4]。另一方面,PDCD5的抑制或敲低都会减弱癌细胞的凋亡[7]。尽管PDCD5明显作为p53介导的细胞凋亡的正调节因子,但PDCD5在细胞凋亡过程中的调节方式尚不清楚。基于此,本研究旨在探讨miR-3168通过调节PDCD5对非小细胞肺癌A549细胞凋亡的影响。
1 材料与方法
1.1材料 pmiR-RB-Report质粒购自广州市锐博生物科技有限公司(货号:GUR100013-P-2)。PDCD5、P21、BAK、P53、BCL-2、TUBULIN抗体购自Abcam公司(货号:ab83958、ab109520、ab32371、ab32503、ab32124、ab210797)。H3抗体购自CST公司(货号:4499)。A549细胞购自上海信裕生物科技有限公司(货号:AD0202)。RPMI1640培养基购自GE health公司(货号:SH30091),胎牛血清购自Thermo Fisher Scientific公司(货号:10099-133)。蛋白酶抑制剂Cocktail (不含EDTA,mini片剂) 购自Bimake公司(货号:B14011)。Etoposide(ET)购自SELLECK公司(货号:S1225)。PBS购自生工生物工程(上海)股份有限公司(货号:E607008)。青链霉素混合液(×100)购自北京索莱宝科技有限公司(货号:P1400)。ClonExpress Ⅱ One Step Cloning试剂盒购自南京诺唯赞生物科技有限公司(货号:C112-01/02)。2×SDS 蛋白电泳上样缓冲液购自北京鼎国昌盛生物技术有限责任公司(货号:WB-0081)。蛋白裂解液购自碧云天生物技术有限公司(货号:P0013)。Xfect RNA Transfection Reagent购自TaKaRa公司(货号:631318)。Luciferase荧光素酶报告检测试剂盒购自艾美捷公司(货号:K801-200)。miR-3168序列来自miRBase,miR-3168 mimics和miR-3168 inhibitor购自生工基因公司(货号:HmiRQP1498,HmiRQP9001)。miRNA快速提取试剂盒购自HaiGene公司(货号:B1802)。miRNA反转录和qPCR试剂盒购自复能基因公司(货号:QP015)。
1.2方法
1.2.1细胞培养和药物处理 非小细胞肺癌细胞A549维持在含有100 U/ml青霉素、100 μg/ml链霉素和10%热灭活的FBS的RPMI1640培养基中,并在潮湿气氛(37℃,5%CO2)中培养。 20 ng/ml的ETO处理A549细胞12 h后收获细胞。
1.2.2细胞转染 通过Xfect RNA Transfection Reagent转染A549细胞。将WT/MT-3′UTR-PDCD5 的质粒或miR-3168 mimics或miR-3168 inhibitor与转染试剂混合,静止大约20 min后,缓缓滴入A549细胞。
1.2.3免疫印迹 用冷的磷酸盐缓冲盐水(PBS)洗涤A549细胞并收集。用裂解缓冲液[50 mmol/L Tris-Cl(pH7.5),150 mmol/L NaCl,1%NP40,10 mmol/L NaF,10 mmol/L焦磷酸钠和蛋白酶抑制剂]制备细胞提取物并冰上孵育30 min。用8%SDS-PAGE凝胶分离目的蛋白质并转移到硝酸纤维素膜上。通过在含有1× PBS和Tween-20(PBST)的5%w/v脱脂牛奶封闭缓冲液中孵育2 h来封闭膜。将封闭的膜在4℃下与指定的抗体一起温育过夜。用1×PBST洗涤后,将膜与适当的辣根过氧化物酶缀合的抗体一起温育1 h。用ECL试剂显影。
1.2.4RNA抽取与荧光定量PCR 根据试剂盒的说明书,用miRNA快速提取试剂盒和miRNA反转录和qPCR试剂盒进行miRNA分离,DNA以及qPCR反应。用每个基因的正向和反向引物进行实时定量逆转录聚合酶链反应(qRT-PCR)。将来自逆转录反应的1 μl cDNA加入到含有10 μl 2×SYBR®PremixEx TaqTM和0.2 μmol/L正向和反向引物的20 μl qRT-PCR混合物中。 PCR在ABI 7500实时PCR系统中进行。将样品在95℃下孵育10 min,然后再95℃变性10 s,60℃退火延伸30 s,变性退火延伸总计30个循环,之后60℃孵育1 min,将所有样品标准化为人U6并表达为倍数诱导。所有反应一式三份进行。使用比较方法计算相对表达水平和SD。
1.2.5Annexin V染色法 在Annexin V染色之前,将A549细胞置于37℃,5%CO2和1%O2的缺氧室中16~18 h;将A549细胞在低氧或含氧量正常的条件下培养2 h,然后在指定的氧条件下用1 μmol/L阿糖胞苷处理16~18 h。之后使用Annexin V染色,使用显微镜观察细胞凋亡情况。
2 结果
2.1miR-3168靶向PDCD5的3′UTR 根据TargetScan生物软件在线分析,发现miR-3168与PDCD5的3′UTR有一处高度匹配,处于108~114的位置,见图1。
将miR-3168与PDCD5的3′UTR匹配区域做CUCCG的突变,将其与野生型PDCD5的3′UTR克隆进pmiR-RB-Report质粒中,见图2。
共转染miR-3168 mimics和WT-PDCD5-3′UTR或MT-PDCD5-3′UTR,利用luciferase report assay检测双荧光素酶活性。相比于对照组(共转染negative control),WT-PDCD5-3′UTR组的双荧光素酶活性显著降低(P<0.05),而MT-PDCD5-3′UTR无显著差异(P>0.05),见图3。基于此,miR-3168靶向PDCD5的3′UTR。
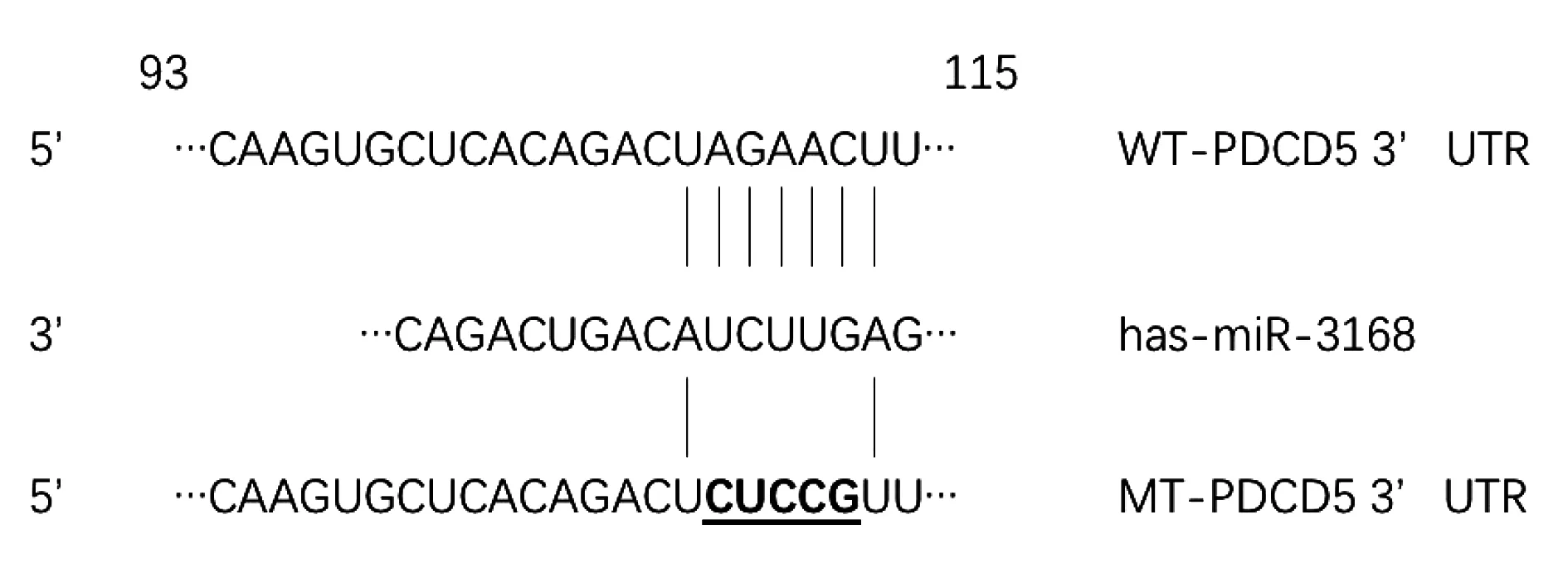
图1 miR-3168与PDCD5的3′UTR高度匹配Fig.1 miR-3168 is highly matched to PDCD5′s 3′UTR
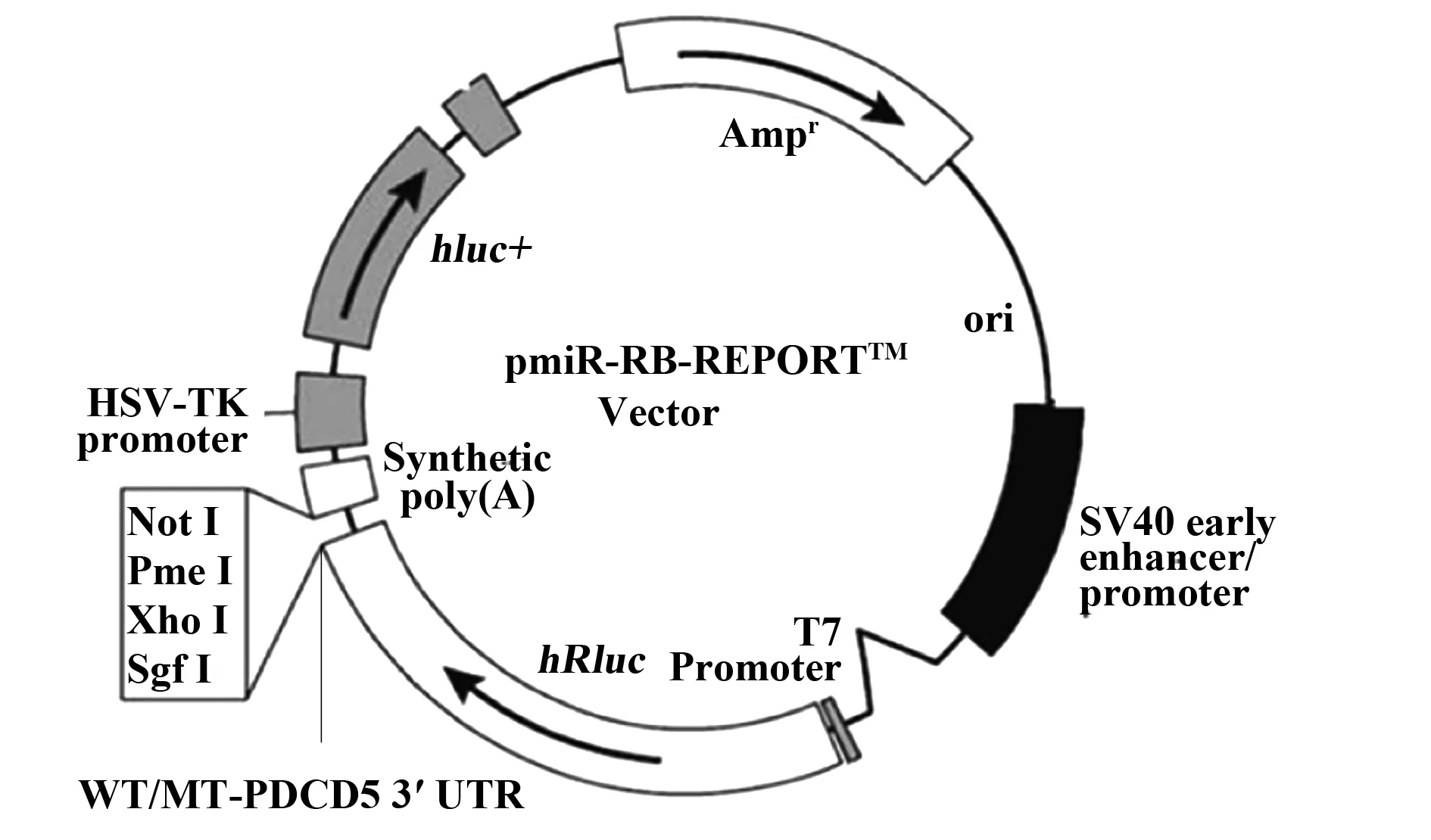
图2 克隆MT/WT-PDCD5-3′UTRFig.2 Clone MT/WT-PDCD5-3′UTR

图3 共转染miR-3168与未共转染miR-3168的荧光素酶活性比较Fig.3 Comparison of luciferase activity between co-tran-sfected miR-3168 and unco-transfected miR-3168Note: *.P<0.05.
2.2过表达miR-3168时,PDCD5的表达量下降,细胞凋亡水平下降 由于PDCD5介导的细胞凋亡是为了抵抗DNA损伤[5],因此用依托泊苷(Etoposi-de,ETO)处理细胞来模拟DNA损伤,且用Annexin-V染色来检测A549细胞凋亡水平,见图4。实验发现用ETO处理细胞后,过表达miR-3168时,相比于对照组,A549细胞凋亡水平显著降低(P<0.05);而未用ETO处理细胞时,无论是否过表达miR-3168,细胞凋亡水平无明显变化(P<0.05)。
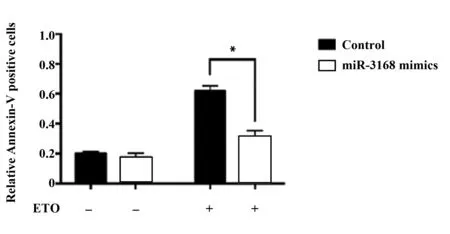
图4 ETO处理后转染miR-3168 mimics与未转染miR-3168 mimics的A549细胞凋亡水平比较Fig.4 Comparison of apoptosis levels of transfected miR-3168 mimics with A549 cells transfected with miR 3168-mimics after ETO treatmentNote: *.P<0.05.

图5 过表达miR-3168转染miR-3168 mimics与未转染miR-3168 mimics的miR-3168表达量比较Fig.5 Expression of miR-3168 after transfection of miR-3168 mimicsNote: *.P<0.05.
转染miR-3168 mimics后,用RT-qPCR检测miR-3168的表达量,miR-3168表达量显著升高(P<0.05),见图5。ETO处理细胞12 h后,相比于未转染miR-3168 mimics的Control,PDCD5的表达量显著下降(P<0.05),细胞凋亡相关蛋白P21和BAK的蛋白表达量显著下降(P<0.05),而BCL-2的蛋白表达量显著上升(P<0.05),见图6。
因为PDCD5通过P53入核介导细胞的凋亡来抵抗DNA损伤。因此,过表达miR-3168后用ETO处理A549细胞12 h, 抽取细胞的细胞质蛋白和细胞核蛋白,发现ETO未处理时,P53存在于细胞质中,而ETO处理后,P53进入了细胞核。而过表达miR-3168后,P53仍然能入核,但是入核的蛋白量明显比对照组低(P<0.05),见图7。
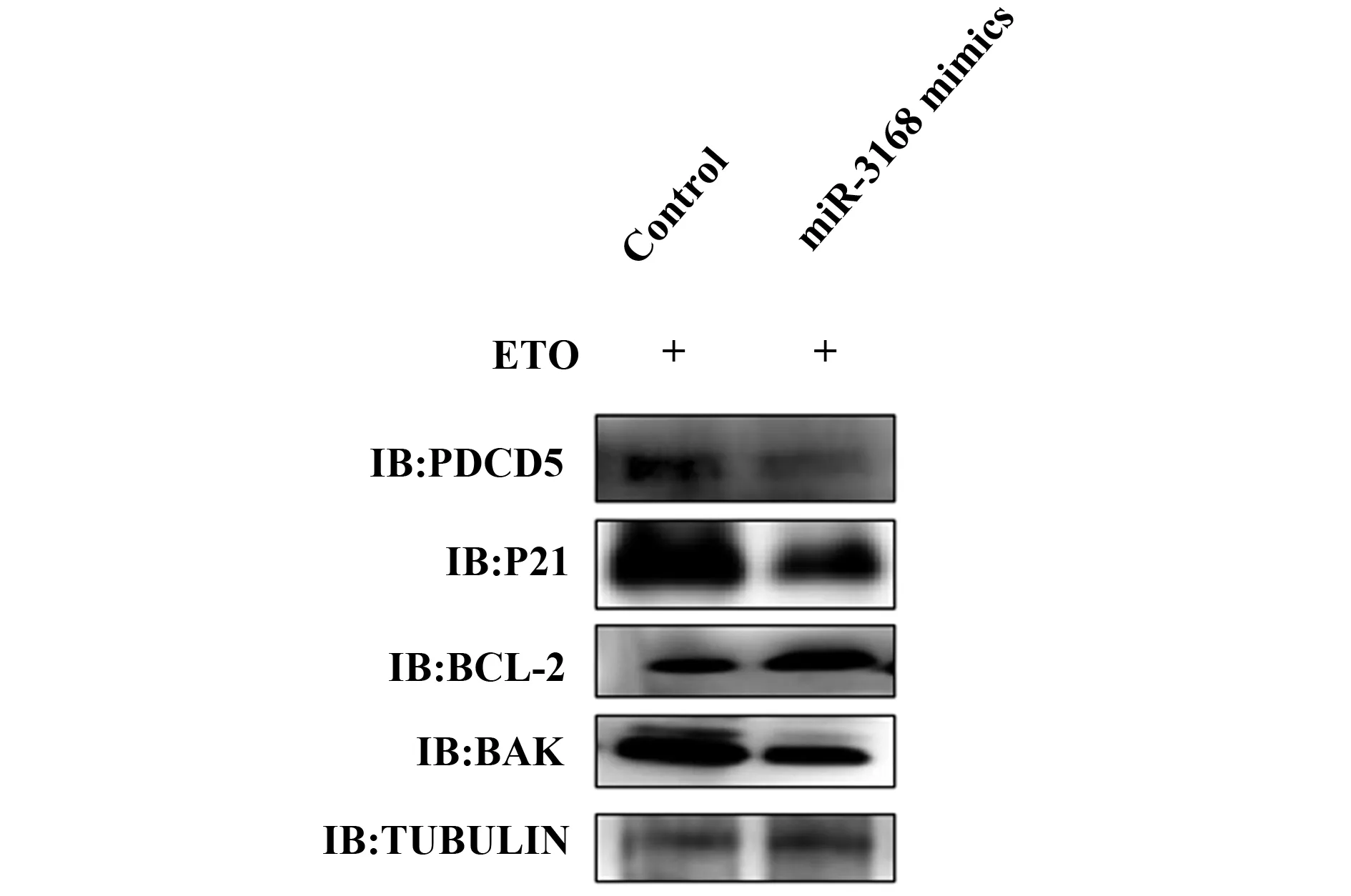
图6 PDCD5与相关凋亡标志蛋白的表达水平Fig.6 Expression levels of PDCD5 and related apopto-sis marker

图7 过表达miR-3168时P53的入核情况Fig.7 Nuclear localization of P53 during overexpression of miR-3168
2.3敲低miR-3168时,PDCD5的表达量上升,细胞凋亡水平上升 由于PDCD5介导的细胞凋亡是为了抵抗DNA损伤[5],因此用ETO处理细胞来模拟DNA损伤,且用Annexin-V染色来检测A549细胞凋亡水平,见图8。发现用ETO处理细胞后,敲低miR-3168时,相比于对照组,A549细胞凋亡水平显著升高P<0.05);而未用ETO处理细胞时,无论是否敲低miR-3168,细胞凋亡水平无明显变化(P<0.05)。
转染miR-3168 inhibitor后,用RT-qPCR检测miR-3168的表达量,miR-3168表达量显著降低(P<0.05),见图9。ETO处理细胞12 h后,相比于未转染miR-3168 inhibitor的对照组,PDCD5的表达量显著上升(P<0.05),细胞凋亡相关蛋白P21和BAK的蛋白表达量显著上升(P<0.05),而BCL-2的蛋白表达量显著下降(P<0.05),见图10。

图8 ETO处理后转染miR-3168 inhibitor与未转染miR-3168 inhibitor的miR-3168表达量比较Fig.8 Comparison of miR-3168 expression in transfected miR-3168 inhibitor and untransfected miR-3168 inhibitor after ETO treatmentNote: *.P<0.05.
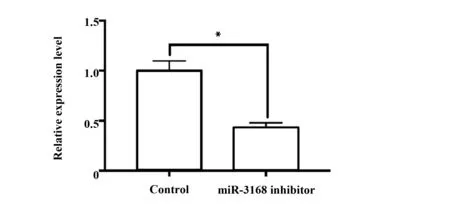
图9 敲低miR-3168后,miR-3168的表达量Fig.9 Expression of miR-3168 after knockdown of miR-3168Note: *.P<0.05.

图10 PDCD5与相关凋亡标志蛋白的表达水平Fig.10 Expression levels of PDCD5 and related apoptosis marker proteins
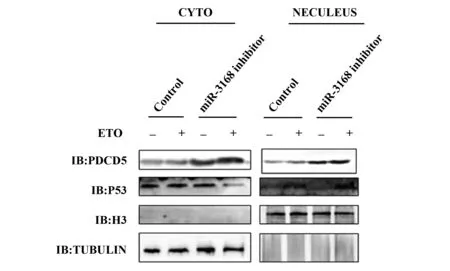
图11 敲低miR-3168时P53的入核情况Fig.11 Nuclearization of P53 at miR-3168 during knockdown
因为PDCD5通过P53入核来介导细胞的凋亡来抵抗DNA损伤。因此,敲低miR-3168后用ETO处理A549细胞12 h,抽取细胞的细胞质蛋白和细胞核蛋白,发现敲低miR-3168后,P53入核的蛋白量明显比对照组高(P<0.05),见图11。
3 讨论
肺癌是中国癌症死亡的主要原因[8],是最危险的恶性肿瘤之一,其诊断后的5年生存率为15.6%,低于乳腺癌、结肠癌或前列腺癌的生存率[9]。它可以分为两种:非小细胞肺癌和小细胞肺癌,分别约占肺癌病例的80%和20%[10]。但是,肺癌的发病机制非常复杂[11],其中细胞凋亡相关基因表达异常是肺癌发生和发展的一个重要原因[12]。
相比于正常人群,miR-3168在肺癌患者中呈现一种高表达的状态[3]。但是miR-3168的功能和相关分子机制目前尚无研究。在本研究中,通过TargetScan分析,发现miR-3168仅在一个区域与PDCD5具有较高匹配度。之后通过双荧光素酶报告系统发现,野生型的PDCD5-3′UTR的报告基因活性在过表达miR-3168后明显降低(P<0.05),但是突变型的PDCD5-3′UTR报告基因活性在过表达miR-3168后无明显变化(P<0.05)。因此,miR-3168靶向结合PDCD5的3端非编码区。并且过表达miR-3168时,PDCD5的表达量明显下降(P<0.05)。而转染miR-3168 inhibitor进A549细胞时,PDCD5的表达量显著上升(P<0.05)。
PDCD5被认为是促凋亡的分子[13]。Xu等[6]发现PDCD5可与Tip60相互作用并且抑制Tip60被蛋白酶体降解。在本研究中,过表达miR-3168造成PDCD5的表达量下降后,细胞凋亡相关蛋白P21和BAK的蛋白表达量显著下降(P<0.05),而BCL-2的蛋白表达量显著上升(P<0.05);而转染miR-3168 inhibitor进A549细胞时,PDCD5的蛋白表达量显著上升(P<0.05),细胞凋亡相关蛋白P21和BAK的蛋白表达量显著上升(P<0.05)。已发表的数据表明Tip60与p53相互作用并增加p53的稳定性和乙酰化水平[6]。值得注意的是,K120位点上的乙酰化是p53依赖性细胞凋亡的关键[14],此位点乙酰化后的p53通过调节凋亡基因的表达来调控细胞凋亡。有研究表明泛素E3连接酶DNAJB1使PDCD5不稳定以抑制p53介导的细胞凋亡[15]。在本研究中,过表达miR-3168造成PDCD5的表达量下降后,P53入核受到抑制(P<0.05);而转染miR-3168 inhibitor进A549细胞时,促进P53入核(P<0.05)。基于此,我们推测PDCD5是p53的一个入核促进因子,当PDCD5缺失时,p53在K120位点上的乙酰化水平受到影响,p53的入核过程在抵抗DNA损伤时受到明显的抑制。
综上所述,miR-3168通过抑制PDCD5表达量来抑制非小细胞肺癌细胞A549的凋亡。