基于核酸适配体功能化荧光氧化石墨烯的免标记“Turn-off”型Hg2+传感器研究
2019-10-22雷湘玲周宁涛
杨 梅,张 何,雷湘玲,傅 昕,王 青,周宁涛
(湖南工程学院 化学化工学院,湖南省环境催化与废弃物再生化重点实验室,湖南 湘潭 411104)
重金属污染指由重金属或其化合物造成的环境污染,主要由矿产开采、污水排放和使用重金属超标制品等人为因素导致。汞(Hg)是环境中毒性最强的重金属元素之一,具有生物富集性和生物非降解性,可导致汞中毒并引发尿血、尿毒症等疾病[1-3]。二价汞离子是汞在水体中的主要存在形式[4-5],目前传统的汞离子检测方法主要有荧光光谱法[6]、电感耦合等离子质谱法(ICP-MS)[7]、高效液相色谱-电感耦合等离子体质谱法(HPLC-ICP-MS)[8]、冷蒸气原子荧光光谱法[9]、荧光猝灭法[10]等,这些方法具有较好的特异性、准确性及灵敏度,但存在依赖精密仪器,操作过程复杂,成本较高等缺点,难以实现现场快速检测。因此建立一种灵敏度高、成本低、操作简单的汞离子传感技术具有重要的现实意义。
石墨烯(Graphene)在2004 年由英国科学家Geim 等首次成功制备,是一种由 sp2杂化的单层碳原子紧密堆积组成的二维蜂窝状碳纳米材料。石墨烯及其衍生物具有优良的光学、力学、热学及化学性能,在荧光特性方面,石墨烯及其衍生物以环境友好、光致发光能力强、机械强度高、水溶性好、表面修饰容易等优点,成为一种应用广泛的新型荧光物质,在生物传感器、环境检测、疾病检测、细胞成像等领域发挥着越来越重要的作用[11-13]。研究发现,胸腺嘧啶与汞离子之间能够通过N—Hg键形成T-Hg2+-T结构,并且该结构中的N—Hg键比Watson-Crick氢键更稳定[14],因此构建富T核酸适配体探针可以实现汞离子的高选择性识别。目前基于该结构已发展了许多汞离子检测新技术,如荧光光度法[15]、电化学方法[16]、表面等离子体共振[17]、表面增强拉曼散射[18]和比色传感器[19-20]等。
本研究以纳米金(AuNPs)复合的氧化石墨烯为荧光材料,以选择性结合Hg2+离子的巯基化单链富T核酸适配体(Aptamer)为分子识别探针,并基于该探针与Hg2+结合后能将氧化石墨烯的荧光猝灭的特性,构建了一种简单、低成本、免标记、快速的“turn-off”型石墨烯基Hg2+检测技术,可用于自来水、湖水、河水等环境水体中汞离子的现场检测。因为该复合材料比石墨烯、金纳米颗粒单独存在时表面积更大,使得aptamer在AuNPs上的修饰更加容易,同时该材料还具有较大的比表面积,可显著提高电子转移速率[21]。
1 实验部分
1.1 仪器与试剂
UV-1800 型紫外-可见分光光度计(日本岛津公司);Milli-Q Reference 超纯水仪(德国默克密理博公司);pH-2602 酸度计(上海天达仪器有限公司);手提式压力蒸汽灭菌器(浙江新丰医疗器械有限公司);真空干燥箱(北京市永光明医疗仪器有限公司);电子天平(梅特勒-托利多仪器有限公司);高速离心机(艾本德生命科学公司);荧光分光光度计(美国PE公司);超声波细胞破碎仪(宁波新芝生物科技股份有限公司)。
石墨粉、硝酸钠、高锰酸钾、双氧水、柠檬酸三钠、氯金酸、氯化钾、氯化镁、二硫苏糖醇、二氯化汞及其它金属离子盐均购自上海生工生物工程股份有限公司。所用试剂均为分析纯,使用时未经进一步纯化,实验用水为去离子水。aptamer 探针由上海生工生物工程股份有限公司合成,序列为5'-SH-(CH)6-TTCTTTCT TCGCGTTGTTTGTT- 3'。
1.2 实验过程
1.2.1 Hummers法制备氧化石墨烯(GO)[22-24]搭建实验装置,以搅拌器为主体,放上小水盆,利用支架(铁架台)固定250 mL三口烧瓶,调整搅拌头与烧瓶底部的位置,以接触而不压住为宜,可开启搅拌器检验效果。
低温处理:向水盆中加入适量冰块与水(覆盖烧瓶1/2体积为宜),烧瓶中加入23 mL浓硫酸并安放好温度计,在冰水浴下冷却至5 ℃以下,依次加入1.0 g石墨粉、0.25 g NaNO3(注意尽量不要沾在玻璃容器壁上),在冰水浴5 ℃以下,充分搅拌反应 30 min。
低温反应:将准备好的3.0 g KMnO4缓慢分批加入,持续至少0.5 h,并控温10 ℃以下反应2 h;中温反应:缓慢升温至35~40 ℃(可采用水浴法)并恒温1 h,中温、低温时间只能多不能少,此时溶液呈粘稠墨绿色;高温反应:缓慢小心加入46 mL蒸馏水,使硫酸遇水放出大量的热,将体系温度稳定在98 ℃左右,若温度计升温较快,上升到85 ℃左右时暂停加水,等稳定后继续添加,防止温度过高,解离后的石墨片层在高温下发生聚合反应,出现黑色颗粒聚集。若达不到预期温度,用提前备好的沸水水浴或者电热套等直接加热,恒温15 min(95 ℃左右亦可,溶液高温处理后呈现亮黄色为佳,继续加热10~15 min,整个高温阶段不宜超过30 min);冷却10 min,达到室温(可以用冰水冷却),然后加140 mL蒸馏水稀释,以3 mL 30% H2O2洗至溶液无气泡产生,混合溶液呈亮黄色。
抽滤:用5% HCl 50 mL多次洗涤,再用适量蒸馏水洗涤至黑色,然后进行反复加水离心处理,转速4 000 r/min,待pH值接近中性时停止离心,并收集氧化石墨于烧杯中,取出所得产物,于60 ℃下真空干燥过夜,即得到干燥的氧化石墨烯。
1.2.2 石墨烯-金纳米颗粒复合材料的制备[25]称量30 mg的自制GO,加入30 mL去离子水,使用超声波细胞破碎仪超声处理(80 W)2 h,得到质量浓度为1 mg/mL的GO悬浮液。在上述悬浮液中加入0.03 g的柠檬酸三钠,搅拌并加热至70~80 ℃,反应10 min;30 min内分3~5次间隔加入1%的氯金酸共5 mL,此时溶液呈现深紫色,继续反应5~10 min即可停止反应。12 000 r/min离心15 min,离心洗涤3次后悬浮于去离子水中,得到氧化石墨烯-金纳米颗粒复合材料(GO@AuNPs)。
1.2.3 巯基aptamer功能化量取30 mL石墨烯-金纳米颗粒复合材料悬浮液(1 mg/mL),超声处理3 h(400 W,设定超声2 s间隔3 s)后取1 mL加入100 μL 1 mmol/L的二硫苏糖醇(DTT)和100 μL 10 μmol/L的aptamer,再用去离子水稀释至5 mL,常温孵育24 h;将上述反应溶液离心(12 000 r/min,10 min)并用10 mmol/L PBS进行多次洗涤以去除游离的DNA,最后加入5 mL 10 mmol/L PBS,获得aptamer-GO@AuNPs悬浮液。
1.2.4 Hg2+的检测将0.5 mL待测样品(含不同浓度Hg2+的水溶液)和0.5 mL aptamer-GO@AuNPs悬浮液混合均匀后常温下反应10 min,分别测定其荧光光谱,选择615 nm处的荧光值作为测量值,计算荧光猝灭效率(IF0-IF)/IF0,其中IF为样品荧光测量值,IF0为Hg2+浓度为0时的荧光值。将100 nmol/L的Ag+、Cd2+、Cu2+、Fe3+、Ni2+、Pb2+、Co2+、Ca2+分别加入到上述的aptamer-GO@AuNPs悬浮液中,考察该检测系统的特异性。
2 结果与讨论
2.1 检测原理
通过Hummers法制备出氧化石墨烯(GO),随后以柠檬酸三钠为还原剂,在无稳定剂、温和的液相反应条件下,于氧化石墨烯表面原位还原氯金酸形成金纳米颗粒,制备出氧化石墨烯负载金纳米颗粒复合材料。氧化石墨烯负载的金纳米颗粒可以和aptamer上修饰的巯基形成强共价键(Au—S)并稳定结合形成aptamer-GO@AuNPs。汞离子存在时,由于7个T-Hg2+-T结构的配位作用,aptamer折叠形成刚性的发夹状双链DNA结构,并使Hg2+靠近石墨烯表面(少于1 nmol/L),电子可沿着双链DNA通道从石墨烯转移到汞离子,从而猝灭氧化石墨烯的荧光[26]。纳米金的引入使得aptamer探针的修饰变得容易,同时经过纳米金修饰的氧化石墨烯比表面积更大,有利于检测信号的进一步放大。

图1 基于氧化石墨烯荧光猝灭的免标记Hg2+检测原理示意图Fig.1 Principle of the label-free detection of Hg2+ based on quenching of the fluorescence emission of graphene oxide
2.2 复合材料的表征
图2A为GO薄片的AFM图像,制备的GO薄片尺寸较为均一,长度为600 nm,宽度为400 nm,高度为20 nm(图2B)。图2C是氧化石墨烯负载金纳米颗粒的SEM图像,从图中可看出大量的金纳米颗粒均匀地分布在氧化石墨烯薄片上,粒径在20 nm左右,而且单层附着的金纳米颗粒团聚少,粒径较为均匀,说明两者复合效果好。图2D为氧化石墨烯与不同含量(0.1%、0.5%、1.0%、1.5%、2.0%)的氯金酸溶液反应后制备的GO@AuNPs的紫外可见吸收光谱图,从图可看出复合材料在540 nm 左右有较强的吸收峰,这与纳米金溶液的紫外吸收特征峰基本相符。随着氯金酸含量的升高,制备的GO@AuNPs复合材料在540 nm左右的吸收峰也相应升高,说明在石墨烯表面生长了更多的纳米金颗粒。

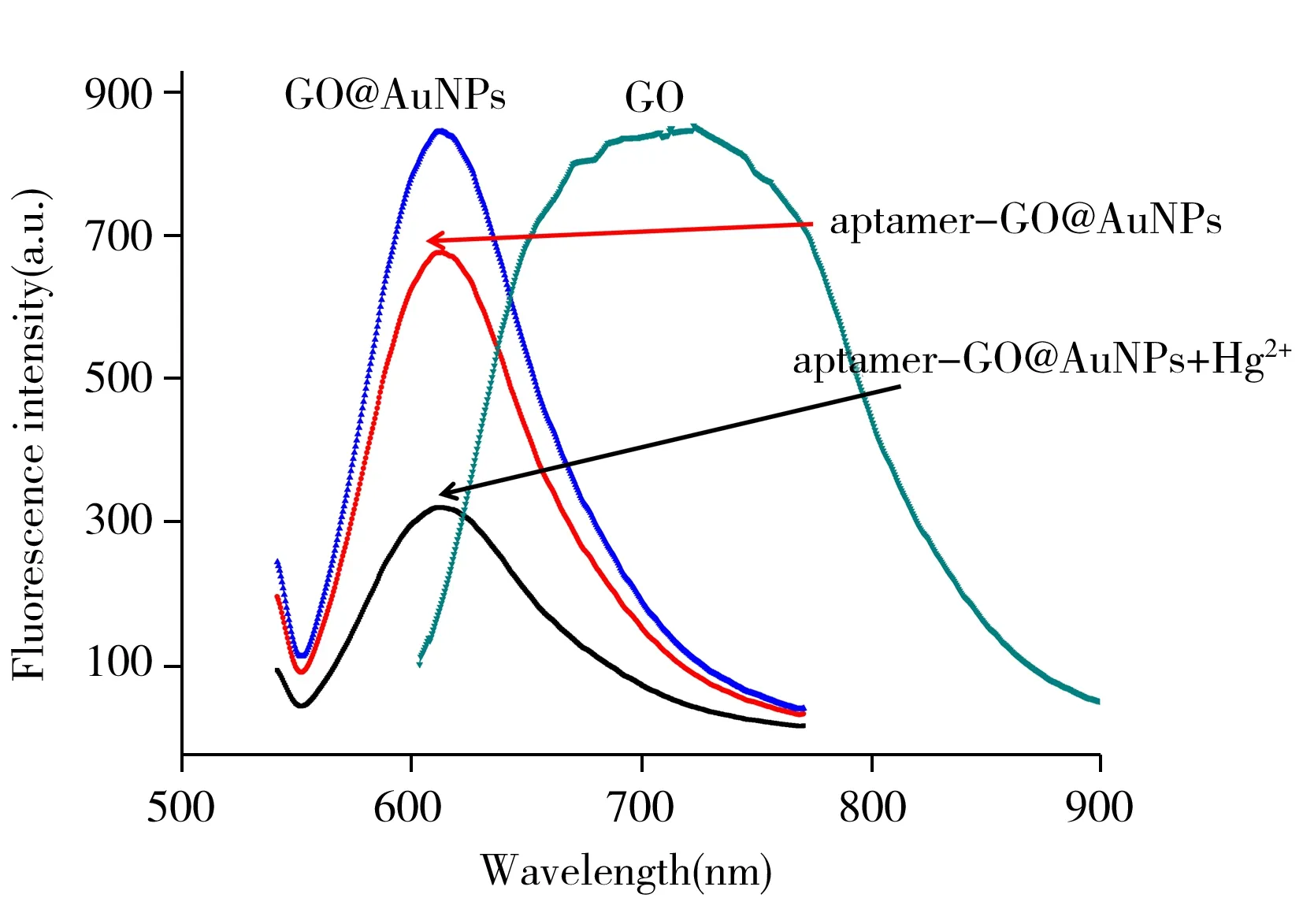
图3 GO及其复合材料的荧光光谱Fig.3 Fluorescence spectra of GO and its composites
考察了GO、GO@AuNPs、aptamer-GO@AuNPs、aptamer-GO@AuNPs+Hg2+的荧光光谱变化情况(图3)。从图3可以看出,GO具有明显的近红外荧光,半峰宽较大(接近200 nm);而在制备GO@AuNPs的过程中,柠檬酸三钠的加入使得GO存在一定程度的还原,导致GO部分发光中心被去除(700~850 nm),一些发光中心被保留(600~700 nm),并出现了强的新发光中心(610 nm),表现为GO@AuNPs的荧光峰半高宽变小(接近90 nm)。GO@AuNPs在修饰上aptamer探针后(aptamer-GO@AuNPs),其荧光光谱的峰位、半峰宽无明显变化,但荧光强度略有降低,可能是在修饰过程中GO@AuNPs有少量损失,或者aptamer探针修饰在复合材料的表面,对发光中心的光致发光性能产生了一定的影响。加入Hg2+后,aptamer-GO@AuNPs复合材料的荧光强度迅速下降,说明Hg2+导致的发夹状双链DNA结构能有效将电子从石墨烯传递到汞离子,从而猝灭了氧化石墨烯的荧光。
2.3 实验条件的优化
由于在GO@AuNPs复合材料的制备中,当金纳米颗粒在石墨烯表面的覆盖率过高时,将导致石墨烯的荧光被直接猝灭,因此考察了不同含量(0、0.1%、0.5%、1.0%、1.5%、2.0%)氯金酸形成的GO@AuNPs复合材料(1 mg/mL)在600 nm处的荧光发射强度。发现随着金纳米颗粒的负载,氧化石墨烯的荧光逐渐减弱,在氯金酸含量为0.1%~1.0%时,其荧光强度降低较慢,随后荧光值快速下降(图4A),因此在后续实验中采用1.0%氯金酸制备GO@AuNPs复合材料。
考察了aptamer-GO@AuNPs与Hg2+的孵育时间对荧光猝灭效率的影响,如图4B所示,当孵育时间为10 min时,其荧光猝灭效率达90%,因此后续实验采用10 min作为aptamer-GO@AuNPs复合材料与Hg2+的反应时间。

2.4 Hg2+的定量检测
在aptamer-GO@AuNPs复合材料的悬浮液中分别加入不同浓度(0、0.1、0.5、1、10、20、50、100、500 nmol/L)的Hg2+,考察了Hg2+浓度对反应体系荧光强度的影响。由图5A可知,随着Hg2+浓度的增大,反应体系的荧光强度不断减弱,当Hg2+浓度超过100 nmol/L时,荧光值基本保持稳定(图5B)。Hg2+浓度(c,nmol/L)在0.5~80 nmol/L之间与荧光猝灭效率(IF0-IF)/IF0(y)呈现良好的线性关系,回归方程为y=0.214+0.007c,线性相关系数r2为0.996。以空白的3倍标准偏差除以标准曲线的斜率得到本方法的检出限为0.3 nmol/ L,远低于中国《生活饮用水卫生标准》规定的饮用水中无机Hg2+的最高允许水平(<5 nmol/L)。结果表明,该方法对Hg2+的定量分析具有较高的灵敏度和良好的线性度。
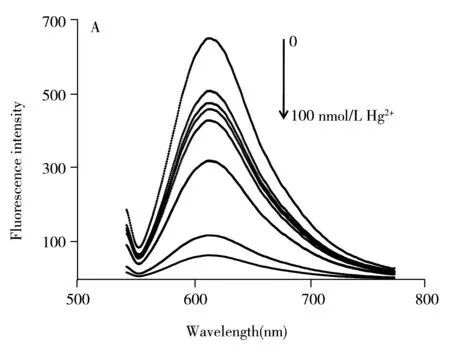
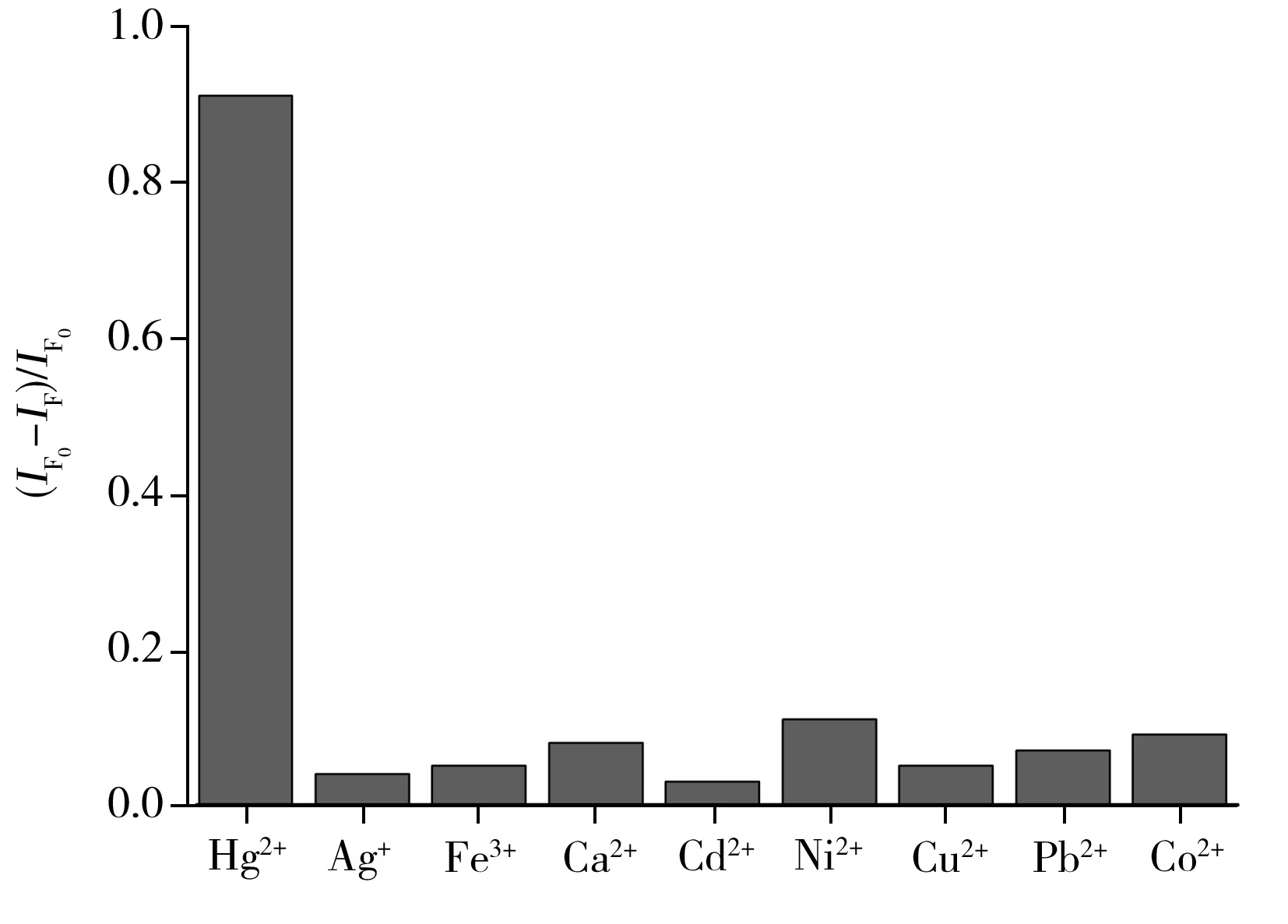
图6 Hg2+传感器的选择性分析Fig.6 Selectivity of the proposed sensor towards detection of Hg2+
2.5 Hg2+检测的选择性
考察了8种常见的金属离子(Ag+、Cd2+、Cu2+、Fe3+、Ni2+、Pb2+、Co2+、Ca2+)对体系识别Hg2+的影响。结果显示,在其它金属离子存在时,检测体系的荧光强度无明显变化(图6),说明只有富T碱基的aptamer与Hg2+特异性结合后才能折叠形成刚性的发夹状双链DNA结构,并使Hg2+靠近石墨烯表面猝灭其荧光;其他金属离子不能构建GO的电子传递通道。综上所述,由于aptamer对Hg2+的较高特异性,使得该传感器具有优良的选择性。
2.6 实际样品分析
为考察本方法用于环境水体样品中Hg2+检测的可行性,分别采集自来水、湘江水以及湖水样本,进行3个水平(1.0、10.0、50.0 nmol/L)的加标回收实验,样品使用前过滤去除悬浮颗粒及杂质。如表1所示,3种不同来源水体样品的加标回收率为96.0%~105%,相对标准偏差(RSD)为1.4%~3.2%。结果表明,本方法具有良好的准确度和灵敏度,能够满足环境水体中 Hg2+污染检测的要求。

表1 环境水体样品的加标回收实验结果(n=5)Table 1 Results of spiked recoveries of environmental water samples(n=5)
3 结 论
基于Hg2+能够猝灭aptamer功能化氧化石墨烯-金纳米颗粒复合材料荧光的特性,发展了一种免标记、快速的Hg2+传感技术。该技术操作简单,耗时仅10 min,具有高的灵敏度和选择性,抗干扰能力强,稳定性好,在环境水体样本的检测中表现出良好适应性,为环境检测和临床医学诊断提供了一种实用、有效且廉价的检测方法。
