结肠癌组织Nrf2 和Keap1 表达及其与增殖指数的关系
2019-10-22方帅帅
方帅帅 王 俊
结肠癌(colorectal carcinoma,CRC)是临床常见疾病。肿瘤细胞常表现为高度的增殖活性[1]。增殖细胞核抗原(PCNA)是细胞增殖的重要标志蛋白,对失控性增殖及增殖活跃的细胞标记效果理想[2]。核因子E2 相关因子2(Nrf2)及其接头蛋白Kelch 样环氧氯丙烷相关蛋白1(Keap1)与上皮细胞的恶变有关,对机体环境中的氧化过程及肿瘤细胞的增殖有一定的调节作用[3]。近年研究认为Nrf2/Keap1 是肿瘤发生和进展的通路之一[4]。本研究检测CRC 组织Nrf2 和Keap1 表达,分析其与PCNA 增殖指数的关系,报道如下。
1 资料与方法
1.1 临床资料 选择2012 年1 月1 日—2013 年6月10 日期间杭州市第三人民医院确诊为结肠癌的患者96 例作为研究对象,其中男52 例,女44 例,年龄32~89 岁,平均(60.80±6.30)岁。选择术后肿瘤组织作为观察组,选择距肿物边缘>3cm 的正常结肠黏膜组织作为对照组。标本于术后立即取材,分别留取新鲜组织(-80℃冰箱冻存)和石蜡包埋组织。本研究经医院伦理委员会审核通过,家属签署知情同意书。
1.2 纳入与排除标准 纳入标准:(1)确诊后行根治性手术并由病理医师确诊,依据WHO《消化系统肿瘤病理学和遗传学》诊断标准及分型[5];(2)具有完整的临床及随访资料。排除标准:(1)双原发或多原发癌、林奇综合症的患者;(2)有消化道手术史;(3)术前有放、化疗史。
1.3 方 法
1.3.1 免疫组化法 应用免疫组化二步法检测两组标本组织Nrf2 和Keap1 表达,检测观察组标本组织PCNA 表达。实验基于石蜡包埋组织后切取的4μm切片。三种试剂均购自武汉博士德生物公司,为浓缩液,以50 为不同梯度按不同稀释比例进行预实验,选择显色最佳的浓度用于正式实验(Nrf2 和Keap1均为1:300,PCNA 为1:100)。正式实验由病理科技师操作,DAB 显色,手工染色及显色,严格按说明书进行,做好质控工作。判读由病理医师进行阅片,应用盲法,Nrf2 和Keap1 的显色部位均是细胞质和/或细胞膜,PCNA 的显色部位是细胞核,以淡黄色——棕黄色为阳性。在显微镜下找热点区,共选择5 个400倍视野,以二维进行评分。着色强度:分别以无、弱、中、强计为0、1、2、3 分。阳性判定:分别以<5%、6%~10%、11%~30%、31%~50%、>50%为0、1、2、3、4 分。二者之和为总分(0~7 分),以≤3 分为阴性,以>3 分为阳性。计算阳性率。
1.3.2 Western Blot 法 应用术后留取的新鲜冻存组织,检测两组标本组织Nrf2 和Keap1 蛋白半定量表达。具体方法:GAPDH 为内参。取样本加裂解液后,离心,取上清液提取蛋白,用BCA 法测定蛋白浓度;放入100℃水浴锅内煮5min,配制10%SDA-PAG凝胶,加适量蛋白和Loading Buffer 混合液,电泳,之后将Nrf2、Keap1 蛋白和GAPDH 的胶段切下转移到PVDF 膜上,封闭60min,加入20mL 抗体(Nrf2 和Keap1 均为1:1200)和20mL 一抗稀释液,4℃过夜,次日洗膜,加入二抗,室温1h 后洗膜,用ECL 发光液进行显影。应用Image J V1.47H 软件进行灰度分析,以蛋白与GAPDH 的比值进行分析。
1.3.3 荧光实时定量PCR 法 应用术后留取的新鲜冻存组织,检测两组新鲜组织Nrf2 和Keap1 mRNA表达。扩增程序:95℃5min、95℃20s、67℃25s、95℃22s、60℃35s 时采集荧光。记录Ct 值,通过2-ΔΔCt法计算目的基因和相对表达水平。ΔΔCt=[Ct 目的基因(未知样品)-CtGAPDH(未知样品)]-[Ct 目的基因(校正样品)-CtGAPDH(校正样品)]。严格按实验步骤完成具体操作,并由专业人士指导,做好质控工作。引物由苏州睿赢药物技术有限公司合成。引物序列:GAPDH:上游5'-GCACAGAGACACGCTACGCTTTA-3',下游5'-TGGCATGAGAAAGGCATAATGCA-3';Nrf2:上游5'-TTCCGGGGACTGACTCCGCTAAG-3',下游5'-GCACACTGAGTTACACTGAGTTC-3';Keap1:上游5'-ATGAACGCCCACTGAGTCGTAG-3',下游5'-GCACGCTGATACACTTTCCCC-3'。
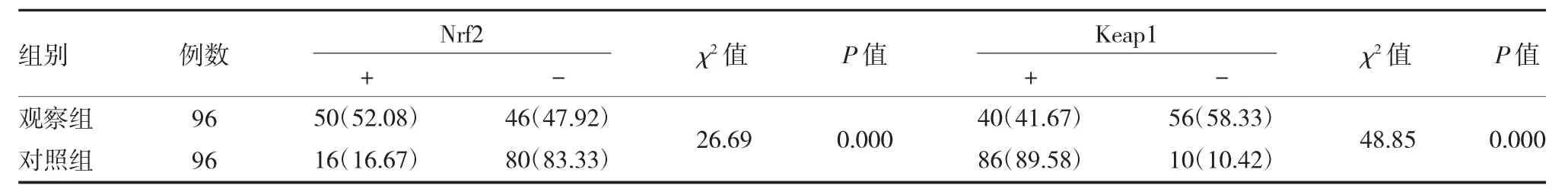
表1 两组标本组织Nrf2 和Keap1 蛋白阳性率比较[例(%)]

表2 观察组不同临床病理特征Nrf2 和Keap1 阳性率分组[例(%)]
1.4 统计学方法 应用SPSS 13.0 进行统计分析,采用卡方检验、t 检验、Pearson 相关性检验和KM 生存分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组标本组织Nrf2 和Keap1 阳性率比较 观察组标本组织Nrf2 高表达,Keap1 低表达,两组标本组织Nrf2 和Keap1 阳性率比较,差异有统计学意义(P 均<0.01)。见表1、插页图1-4。

图1 正常结肠黏膜组织Nrf2 阴性表达(免疫组化二步法×200)

图2 正常结肠黏膜组织Keap1 阳性表达(免疫组化二步法×200)

图3 结肠癌组织Nrf2 阳性表达(免疫组化二步法×200)

图4 结肠癌组织Keap1 阴性表达(免疫组化二步法×200)
2.2 观察组不同特征分组标本组织Nrf2 和Keap1阳性率比较 观察组标本组织Nrf2 和Keap1 阳性率在不同肿物最大径、淋巴结转移、远处转移、浸润深度和TNM 分期亚组的表达差异有统计学意义(P<0.05 或P<0.01),Nrf2 和Keap 在不同性别、年龄和分化程度的表达差异无统计学意义(P>0.05)。见表2。
2.3 观察组Nrf2 和Keap1 表达与生存时间的相关性 观察组随访时间6~60 个月,平均34.30 个月,经生存分析显示,观察组Nrf2 和Keap1 表达与生存时间相关,即Nrf2 高表达,Keap1 低表达患者的生存时间短。见插页图5-6。

图5 结肠癌组织Nrf2 表达的生存分析

图6 结肠癌组织Keap1 表达的生存分析
2.4 观察组Nrf2 和Keap1 表达与PCNA 增殖指数的相关性 相关分析显示,Nrf2 表达和PCNA 增殖指数具有正相关性(r=0.52,P=0.011);Keap1 表达和PCNA 增殖指数具有负相关性(r=-0.51,P=0.035)。
2.5 Wesern Blot 检测两组Nrf2 和Keap1 半定量表达 观察组标本组织Nrf2 蛋白平均半定量表达(1.01±0.13),对照组标本组织Nrf2 蛋白平均半定量表达(0.49±0.11),经统计学分析,差异有统计学意义(t=12.31,P<0.01)。观察组标本组织Keap1 蛋白平均半定量表达(0.59±0.15),对照组标本组织Keap1 蛋白平均半定量表达(1.08±0.10),经统计学分析,差异有统计学意义(t=10.59,P<0.01)。见插页图7。
图7 Wesern Blot 检测结肠腺癌和正常结肠黏膜Nrf2 和Keap1 半定量表达
2.6 荧光PCR 法检测两组Nrf2 和Keap1 mRNA 比较 观察组标本组织Nrf2 mRNA 平均半定量表达(1.01±0.21),对照组标本组织Nrf2 mRNA 平均半定量表达(0.82±0.19),经统计学分析,差异有统计学意义(P<0.05)。观察组标本组织Keap1 mRNA 平均半定量表达(0.83±0.15),对照组标本组织Keap1 mRNA 平均半定量表达(1.20±0.25),经统计学分析,差异有统计学意义(P<0.05)。见插页图8-9。
图8 结肠癌和正常结肠黏膜组织Nrf2 mRNA 表达

图9 结肠癌和正常结肠黏膜组织Keap1 mRNA 表达
3 讨论
结肠癌(CRC)与腺上皮的恶性改变有关,遗传学是病变核心。在致癌因素的作用下引起腺上皮的异型增生,细胞的分布及形态结构出现明显改变[5]。病变发展过程中伴随着高度的增殖状态,其中标记增殖最经典的指标是PCNA,其表达于细胞核,能真实客观反应结肠癌细胞的增殖程度[6]。研究认为,PCNA 可以作为临床判断肿瘤预后的重要指标,同时也是细胞去分化的重要标志蛋白[7]。CRC 病理形态中以浸润肌层为重要特征,因此其侵袭能力强,转移潜能高。Nrf2 在正常机体中低表达,对防止异源性因子对DNA 的破坏有重要作用。肿瘤性因素的作用下,Nrf2 高表达,使抑制致癌物活化,加速细胞癌变。Keap1 是多区域阻遏抑制性蛋白,Nrf2 蛋白对Keap1有重要的调控作用,其可能是Nrf2 和Keap1 通路的开关因子。研究显示,Nrf2 和Keap1 定位于细胞浆中,在泛素酶的介导下,使Nrf2 降解加速[8]。肿瘤细胞处于氧化状态时,Nrf2 和Keap1 能引起Nrf2 结构发生解离,细胞内Nrf2 蛋白水平升高并转移到细胞核内,并与抗氧化反应的分子相结合,激活靶基因。Nrf2 和Keap1 能形成强力的聚合体,可以作为Cullin结构中依赖的E3 泛素连接酶复合物的基板,对调节细胞增殖和细胞迁移有一定作用。Keap1 的DGR 区有重复的结构域,能与Nrf2 的DLG 结构区域相结合,对泛素酶进行有效转移,加速蛋白酶体的降解。此时Nrf2 由于不被降解,引起Keap1 的过度饱和,形成新的Nrf2 聚集区,并有效的调动机体的细胞保护因子。Nrf2 和Keap1 可能是内源性抗氧化和自由基形成的因子,Nrf2 和Keap1 的表达可以调节细胞的炎症反应及肿瘤性改变[9-10]。在肺癌和乳腺癌中发现Nrf2 和Keap1 的异常表达,其侵袭和转移能力明显增强,认识到其不仅与生物学进展相关,其还可能是重要的诊断因子和治疗的靶点[11]。
本研究结果显示,结肠癌组织Nrf2 和Keap1 异常表达,提示Nrf2 高表达和Keap1 低表达是促进肿瘤形成的重要的蛋白因素,Nrf2 和Keap1 蛋白表达和mRNA 表达具有明确的一致性。结肠癌组织Nrf2和Keap1 阳性率在不同肿物最大径、浸润深度中的表达差异有统计学意义,提示二者异常表达可以促进肿瘤的生长、局部侵袭和直接蔓延。Nrf2 和Keap1的异常表达与淋巴结转移和远处转移有关,提示二者可能是促进肿瘤细胞迁移的重要因素。Nrf2 和Keap1 表达与TNM 分期有关,提示Nrf2 和Keap1 对判断临床分期可能有辅助意义,由于TNM 分期与肿瘤的生物学进展及判断肿瘤的预后有关,因此Nrf2高表达和Keap1 低表达可能提示预后不良,生存分析的结果证实Nrf2 高表达、Keap1 低表达的患者预后差,与Nrf2、Keap1 与TNM 分期的关联性结论一致。结果显示,CRC 中Nrf2 和PCNA 具有正相关性,Keap1 和PCNA 具有负相关性,提示Nrf2 和Keap1均与PCNA 的表达具有协同作用,二者异常表达时可以促进肿瘤细胞的增殖,使细胞的增殖速度增加,细胞体积增大,细胞生长活跃[12-13]。Nrf2 和Keap1不仅在组织分化和器官的形成中可能有一定作用,还在正常组织的成熟中有一定价值,Nrf2 和Keap1异常表达可以调控多种促癌基因的表达,激活相关癌基因,如肿瘤坏死因子、Mum-1 等[14]。Nrf2 和Keap1还能作为E2F/Rb 的靶向因子,引起肿瘤细胞的异质性改变。Nrf2/Keap1 作为信号通路可以介导多种信号途径,活化核因子等相关细胞分子病理通路,对肿瘤的迁移和血液供应进行有效调控[15]。Nrf2 和Keap1可能对TWIST 等上皮间质转化的因子具有一定的调控作用,这可能是肿瘤进展中的促进因素。近年关注Nrf2/Keap1 在肿瘤治疗靶点及治疗干预作用,后续的临床意义可能更明显[16-17]。
总之,Nrf2 高表达、Keap1 低表达在CRC 的形成和进展有重要作用。Nrf2/Keap1 可能通过对细胞增殖的调节起协同作用,术后检测肿瘤组织Nrf2 和Keap1 表达对判断预后具有一定价值。
