4种炎症因子在牙周炎与冠心病相关性中的作用
2019-10-21马思环邓辉王彩琼
马思环,邓辉,王彩琼
(1.浙江中医药大学附属温州市中医院 口腔科,浙江 温州 325000;2.温州医科大学附属口腔医院 牙周科,浙江 温州 325027;3.温州市人民医院 口腔科,浙江 温州 325000)
慢性牙周炎是牙周组织的慢性感染性疾病。冠心病(coronary heart disease,CHD)是一种以动脉粥样硬化(atherosclerosis,AS)为基本病变的心血管疾病。近年来,AS被认为与全身炎症水平升高有关,为慢性炎症性疾病。流行病学研究发现慢性牙周炎与CHD的发生发展呈正相关,慢性牙周炎可能是CHD的危险因素。BECK等[1]、杨镰微等[2]经过大样本的追踪调查,发现牙周炎患者的CHD危险度显著升高。另有研究表明牙周治疗有助于心血管疾病患者血管内皮功能的改善[3]。
牙周感染可通过牙周致病菌及其代谢产物刺激血管内皮细胞导致内皮功能障碍,从而发生动脉粥样硬化。主要的炎症因子,如白介素(interleukin,IL)-1β、IL-6、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)也可能参与其中,发挥协同作用。本研究通过分析健康者、中重度牙周炎患者、单纯CHD患者及CHD伴中重度牙周炎患者的血清IL-1β、IL-6、TNF-α、MCP-1四种炎症因子水平,探讨以上炎症因子在牙周炎和CHD相关性中的作用。
1 对象和方法
1.1 对象选取2015年7月至2016年5月就诊于温州市中医院口腔科及温州市人民医院心内科的129例研究对象。其中健康者39例(HC组),中重度牙周炎患者35例(PD组),单纯CHD患者31例(CHD组),CHD伴中重度牙周炎患者24例(PD+CHD组)。纳入标准:①年龄40~65岁;②试验前1个月内未服用抗菌药物;③试验前6个月内无牙周治疗史;④妇女未妊娠;⑤无饮酒、吸烟等嗜好。其中CHD的诊断标准:左冠状动脉前降支、回旋支或右冠脉及其分支中、或左主干存在>50%直径的固定性狭窄或阻塞性病变。根据ARMITAGE等[4]报道,牙周健康或龈炎的诊断标准:全口牙平均临床附着丧失(clinical attachment loss,CAL)≤0.5 mm,同时邻面CAL≥3 mm的位点=0,且失牙数≤2。中重度慢性牙周炎的诊断标准如下:全口牙平均CAL≥1.6 mm,同时邻面CAL≥3 mm的位点分布于3个不同区段或至少有6颗牙,且失牙数≤14。本研究获浙江中医药大学附属温州市中医院伦理委员会批准,所有研究对象均知情同意。
1.2 主要试剂与仪器IL-1β、IL-6、TNF-α、MCP-1多因子ELISA检测试剂盒(杭州联科生物技术有限公司)、液相芯片分析系统(美国Luminex公司)、酶标仪(美国Thermo公司)、振荡器(江苏其林贝尔仪器制造有限公司)、涡旋混合器(江苏其林贝尔仪器制造有限公司)、离心机(江苏其林贝尔仪器制造有限公司)。
1.3 方法
1.3.1 临床检查:记录每位研究对象全口牙(除第三磨牙外)的牙周状况检测结果。检查内容包括探诊出血(bleeding on probing,BOP)、牙周袋探诊深度(pocket probing depth,PPD)、CAL。测量每颗牙的颊、舌侧远中、正中和近中6个位点,取平均值作为该牙测量结果,全口牙平均值作为该研究对象的测量结果。记录所有研究对象的血压、BMI等信息。
1.3.2 血清样本的收集及制备:所有纳入的受检者抽取空腹静脉血5 mL,静置1 h后,用4 ℃低温离心机(3 000 r/min)离心10 min,得到血清样本,登记编号,-70 ℃冻存。
1.3.3 血清相关炎症因子水平的测定:血清标本在室温下融解,采用Procarta Plex多因子ELISA试剂盒检测血清中IL-1β、IL-6、TNF-α、MCP-1的含量。用Procarta Plex Analyst 1.0 Software软件计算,以标准品浓度为横坐标,MFI值为纵坐标,进行五参数Logarithmic axis回归拟合生成标准曲线。
1.4 统计学处理方法采用SPSS13.0软件包进行统计学分析。各组间IL-1β、IL-6、TNF-α、MCP-1水平的比较采用单因素方差分析,多重比较采用SNK法,计数资料采用χ2检验,校正混杂因素采用协方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况各组间性别、年龄、教育程度、职业情况差异无统计学意义(P>0.05),在各组基本平均分布。见表1。其中CHD组、PD+CHD组患者的血压、BMI显著高于HC组和PD组(P<0.05),而HC组和PD组之间以及CHD组和PD+CHD组之间的血压、BMI差异则无统计学意义(P>0.05)。见表2。
2.2 牙周临床指数CAL除HC组与CHD组间差异无统计学意义外,在其余组间差异均有统计学意义(P<0.05);PD组的CAL值最高,HC组和CHD组最低。所有组间PPD差异均有统计学意义(P<0.05);PD+CHD组、PD组、CHD组、HC组依次下降。除HC组与CHD组间、PD组与PD+CHD组间BOP差异无统计学意义外,其余组间BOP差异均有统计学意义(P<0.05);PD组、PD+CHD组高于HC组和CHD组。见表2。
2.3 不同牙周状态者CHD发病比较本课题组针对同一研究对象的前期系列研究工作已证实:经多元logistic回归分析,在排除了血压、BMI的混杂作用后,中重度慢性牙周炎增加患CHD的风险(OR=2.555,95%CI=1.096~5.958)[5]。
2.4 4组间4种炎症因子的比较在不排除BMI、血压等影响的情况下,各组血清IL-1β、IL-6、TNF-α、MCP-1之间的差异有统计学意义(P<0.01)。组间两两比较结果表明:IL-1β水平在各组间差异均有统计学意义,PD+CHD组最高,CHD组其次,PD组次之,均较HC组高(P<0.05);就IL-6而言,除了PD组与CHD组的差异无统计学意义(P>0.05)以外,其余组间差异均有统计学意义(P<0.05),PD+CHD组最高,HC组最低;TNF-α与IL-6类似,除了PD组与CHD组间的差异无统计学意义(P>0.05)以外,其余各组间TNF-α差异均有统计学意义(P<0.05),PD+CHD组最高,HC组最低;MCP-1的表达在HC组与PD组之间差异无统计学意义(P>0.05),在PD组与CHD组之间差异亦无统计学意义(P>0.05),其余组间差异均有统计学意义(P<0.05),PD+CHD组最高,见图1。
经协方差分析校正混杂因素BMI和血压的影响后,结果显示,各组血清IL-1β、IL-6、TNF-α、MCP-1水平的差异仍具有统计学意义(P<0.01)。经SNK法多重比较表明,各组间4种炎症因子水平的差异与未校正前一致。

表1 4组研究对象一般情况
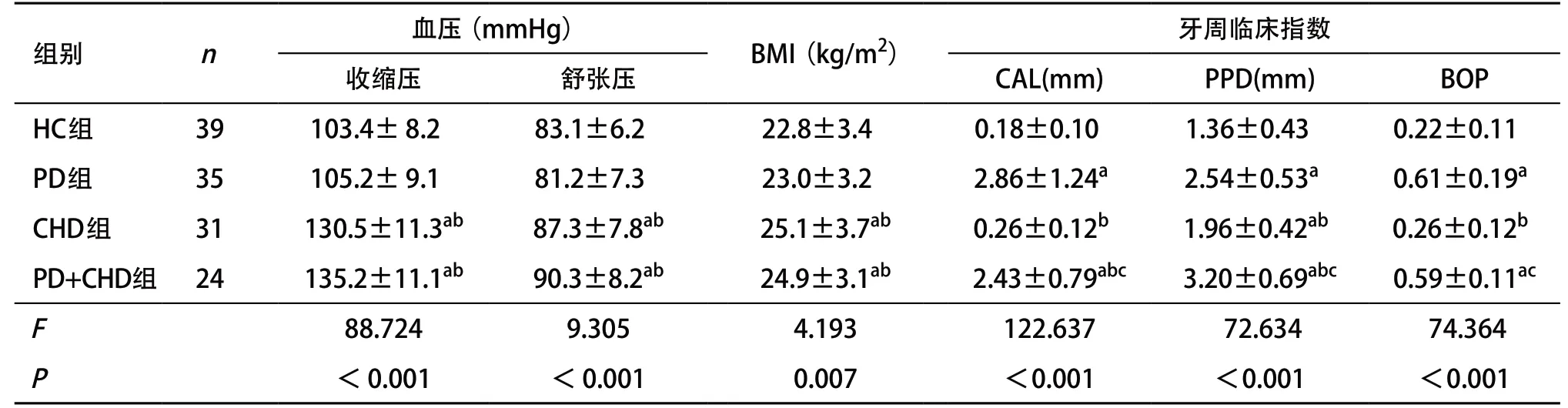
表2 4组研究对象血压、BMI、牙周临床指数的比较
3 讨论
慢性牙周炎和CHD皆是慢性感染性疾病。本课题组前期系列研究发现,中重度慢性牙周炎与CHD的发病显著相关(OR=2.555,95%CI=1.096~5.958)。牙周炎是如何促进CHD的发生发展以及它们的相关机制,一直为人们所关注。
CHD作为多因素疾病,易感基因、环境因素等都影响其发生发展。AS形成的过程始于对血管内皮细胞的损伤。当受到机械、生化或免疫原因等刺激时,血管内皮细胞功能障碍,血管内皮通透性增加,引发炎症初始阶段。进而血管内皮细胞表达的黏附分子促进单核细胞黏附于内皮,吞噬循环血液中的氧化低密度脂质蛋白,进一步释放炎症因子[6]。因而,炎症是引起上述病理过程的重要始动和协同因素之一。此外,有研究已经证实了多种病原体在AS病变中发挥作用,包括肺炎衣原体、幽门螺旋杆菌、巨细胞病毒和牙周致病菌等[7]。动物模型研究中发现这些病原体可以启动和加速AS。抗生素的使用可以降低发生第一次急性心肌梗塞的风险[8]。在前瞻性的研究中发现,常见的慢性感染包括呼吸道、尿路和牙周感染等都能显著增加发生颈动脉AS的风险,即使受检者在没有传统危险因素的情况下亦如此[9]。
牙周炎作为感染性疾病,其始动因子是牙菌斑,龈下菌斑细菌及其毒性产物可通过血循环扩散引起菌血症,从而可活化血管内皮细胞,导致血管局部的炎症反应,促进AS的发生发展。KOZAROV等[10]、NAKANO等[11]、YAMAZAKI等[12]都从患者的AS斑块中检测到数种牙周致病菌的存在。有动物研究[13-14]发现牙周致病菌可通过介导脂质的氧化和沉积来促进AS斑块的形成。
牙周细菌产生的毒素、抗原成分、代谢产物等,还可刺激上皮细胞产生大量炎症因子,如IL-1β、IL-6、TNF-α、MCP-1等。已有研究表明牙周炎患者血清或龈沟液中IL-1β、IL-6、TNF-α、MCP-1水平比牙周健康者高[15-18],这与本研究结果相似。这些炎症因子之间存在协同作用,如IL-1β可促进IL-6、IL-8、TNF-α、MCP-1、CRP等表达,加速AS形成[19]。血清中炎症因子的增加可能通过以下途径影响AS的发生发展:①通过对血管内皮细胞的直接损伤,使血管通透性增加,以致胆固醇易穿透血管内膜,在内膜下沉淀形成粥样斑块。②促进单核巨噬细胞摄入LDL,从而促进形成脂质条纹。③促进平滑肌细胞、白细胞向血管内皮下浸润、聚集,而使内膜增厚,促进AS形成。④通过各种途径抑制纤溶,促进血栓形成。另有研究[20-22]表明,牙周基础治疗可使血清中炎症因子IL-1β、IL-6、TNF-α、CRP等的水平降低,而且血清TC、TG、DL-C水平也有降低,提示牙周治疗可影响CHD的发生发展。
此外,牙周致病菌促进AS的形成和进展还可能与以下机制有关:①牙周炎时抗牙龈卟啉单胞菌(P.g)的免疫反应与血管内皮细胞表达的HSP-60形成交叉反应。研究表明,随着牙周致病菌总负担(主要是P.g、伴放线放线杆菌、梭形杆菌)的增加,人血清中HSP-60的抗体水平也随之上调[23]。②P.g的慢性感染还可通过增加黏附分子如细胞间黏附分子-1、血管细胞黏附分子-1等促进单核细胞聚集在血管内皮,从而导致AS。③血链球菌、P.g等还可促进血小板在血管内凝集,形成血栓并栓塞血管,导致心肌梗死、脑梗死等急症。

图1 4组研究对象血清IL-1β、IL-6、TNF-α、MCP-1水平的比较
本研究结果发现,中重度牙周炎的IL-1β、IL-6、TNF-α水平显著高于健康者(P<0.05)。中重度牙周炎与CHD共患者的IL-1β、IL-6、TNF-α水平亦显著高于仅有牙周炎者或CHD患者(P<0.05)。这提示,牙周感染可提高系统炎症因子的水平,而这些炎症因子水平的变化又促进CHD的发生发展。
综上所述,中重度牙周炎可能通过上调血清IL-1β、IL-6、TNF-α的水平,与CHD的发生发展有关。同时,这些炎症因子一定程度上可以预测AS、心肌梗死、脑卒中和血栓形成的概率。
