长链非编码RNA MIAT通过miR-124促进鼻咽癌细胞增殖、迁移和侵袭
2019-10-21郝亚琳金晓杰赵辉何平张佳凤董琼娜施薇薇赵苗苗
郝亚琳,金晓杰,赵辉,何平,张佳凤,董琼娜,施薇薇,赵苗苗
(上海交通大学医学院附属仁济医院南院 耳鼻咽喉头颈外科,上海 201112)
鼻咽癌起源于鼻咽部黏膜上皮,是头颈部肿瘤中最常见的类型之一[1],在我国南方和一些东南亚国家很常见,发病率为20~30/10万[2]。目前,在疾病发现早期,放射治疗已被证明是最有效的治疗方法[3]。然而,75%~90%鼻咽癌的诊断处于晚期[4],肿瘤细胞已发生局部或区域扩散[5],影响鼻咽癌的有效治疗,并存在复发和肿瘤转移的高风险[6],降低完全根治肿瘤的概率。因此筛选更为敏感和特异性的生物标志物对鼻咽癌的治疗至关重要。
人类基因组工程的结果表明,仅有不到3%的人类基因组序列编码蛋白质,超过75%基因组序列转录为非编码RNA,包括微小RNA(microRNA,miRNA)[7]和长链非编码RNA(long non-coding RNA,lncRNA)[8-9]。lncRNA作为一种潜在的生物学活性调节因子,广泛参与细胞活动,如细胞增殖、凋亡、迁移和侵袭。lncRNA几乎可以调控肿瘤细胞的各个方面,包括细胞生长、细胞周期、细胞凋亡、细胞衰老、细胞迁移和侵袭、耐药性等[9]。因此,lncRNA成为抑制肿瘤及其致癌基因的调控靶点[10-12]。
在鼻咽癌中,lncRNA的表达和作用尚不清楚。KONG等[13]报道,鼻咽癌中lncRNA LINC00460水平增加,促进肿瘤发生。GUO等[14]报道lncRNA LINC0086在鼻咽癌中表达降低,发挥抑癌作用。SONG等[10]报道lncRNA EWSAT1在鼻咽癌中高表达,促进鼻咽癌细胞生长。MIAT也被称为Gomafu或Rncr2,位于22q12.1,长度为30 051 bp,在肝癌、肺癌、乳腺癌、前列腺癌、胃癌、卵巢癌、慢性淋巴细胞性白血病、胶质瘤等肿瘤中表达异常[15-18]。研究表明,lncRNA MIAT通过竞争内源性RNA机制调控miRNA的表达水平,从而抑制癌细胞增殖、侵袭和转移[18-20]。然而,MIAT在鼻咽癌调控中的作用仍未明确。本研究对鼻咽癌细胞中MIAT表达水平进行分析,并分析其对miR-124水平的影响,进一步探讨其对鼻咽癌细胞增殖、迁移和侵袭方面的影响,为识别新的鼻咽癌诊断策略与治疗靶点奠定基础。
1 材料和方法
1.1 材料RPMI-1640培养基和胎牛血清均购自美国Gibco公司;BCA法蛋白浓度检测试剂盒和MTT试剂盒购自上海碧云天生物技术公司;抗β-catenin抗体、抗cyclin D1抗体、抗c-Myc抗体、抗β-actin抗体和辣根过氧化物标记的二抗购自英国Abcam公司;Lipo-fectamine2000转染试剂购自美国Thermo Fisher Scientific公司;mimic NC、miR-124 mimic、in-hibitor NC及miR-124 inhibitor购自广州锐博生物科技有限公司。
1.2 方法
1.2.1 细胞培养与细胞转染:鼻咽癌细胞系(HONE-1,SUNE-1,C666-1)和鼻咽上皮细胞系NP-69取自中山大学。无血清角质细胞培养基培养NP-69 细胞;添加有10%胎牛血清的RPMI-1640培养基培养HONE-1、SUNE-1、C666-1细胞,均培养于37 ℃、5%CO2培养箱。以cDNA为模板,采用Pfu DNA聚合酶扩增MIAT序列并连接到pcDNA3.1载体的Hind III和EcoR I位点之间,构建MIAT过表达载体pcDNA-MIAT。pcDNA-MIAT或其对照pcDNA、si-MIAT或其对照si-NC、miR-124 inhibitor或其对照inhibitor NC通过Lipofectamine 2 000试剂盒转染至鼻咽癌细胞。
1.2.2 RT-qPCR:培养鼻咽癌细胞至对数期,采用TRIzol法提取总RNA,检测RNA的纯度及浓度。以总RNA为模板,利用反转录试剂盒扩增得到cDNA。采用SYBR Green PCR试剂盒,分别以GAPDH与U6 snRNA分子为内参进行RT-qPCR检测MIAT与miR-124表达水平。引物序列:MIAT F:5’-CAAAGAGCCCTCTGCACT A-3’,R:5’-ACCTTGGTTACCCCTGTGATG-3’;miR-124 F:5’-CGCGCGCGUAAGGCACGCGGUGAA-3’:R:5’-ATCCAGTGC AGGGTCCGAGG-3’;GAPDH F:5’-CAGCCTCAAGATCATCAG CA-3’;R:5’-ATGATGTTCTGGAGAGCCCC-3’;U6 F:5’-CT CGCTTCGGCAGCACA-3’,R:5’-AACGCTTCACGAATTTGCG T-3’。根据2-ΔΔCt方法计算MIAT与miR-124的相对表达水平,每组设置3个平行。RNA提取、反转录与定量PCR条件与反应体系均按照对应说明书进行操作。
1.2.3 双荧光素酶系统检测:在线软件预测MIAT与miR-124的结合位点。将含此片段的MIAT序列连接至双荧光素酶载体pGL3,得到pGL3-MIAT-wt载体。同时,通过定点突变将结合位点突变(Mut,GCACTTT→CGTGAAA)构建突变质粒pGL3-MIAT-mut。为研究MIAT与miR-124的相互作用,将鼻咽癌细胞HONE-1接种于96孔板中24 h,当细胞达到50%~70%汇合时,分别将MIAT-wt或MIAT-mut质粒与mimic NC、miR-124 mimic、inhibitor NC及miR-124 inhibitor同时转染HONE-1细胞。用双荧光素酶报告基因检测系统测定48 h荧光素酶活性。
1.2.4 Western blot:收集转染后培养48 h的细胞培养液,离心后加入蛋白裂解液反应30 min,提取细胞总蛋白。BCA法测定蛋白浓度,采用SDSPAGE分离等量的蛋白质,湿法将蛋白转移到PVDF膜上。经5%脱脂牛奶/TBST封闭,一抗过夜孵育后,TBST清洗后加入二抗,室温下孵育90 min。加入ECL显色剂后置于凝胶成像仪检测目标蛋白水平。
1.2.5 MTT法测定鼻咽癌细胞增殖:培养鼻咽癌细胞HONE-1至对数生长期并制成细胞悬液,以1×103个/孔接种至96孔板内,重复5孔。待培养24 h后分别转染si-NC、si-MIAT、si-MIAT+inhibitor NC、si-MIAT+miR-124 inhibitor。继续培养至24、48、72 h,离心弃去上清液,每孔加入0.1 mg的MTT继续培养4 h后,加入150 μL二甲基亚砜溶解,490 nm处检测OD值,取平均值绘制细胞增殖曲线。
1.2.6 Transwell细胞迁移与侵袭试验:将分别转染si-NC、si-MIAT、si-MIAT+inhibitor NC、si-MIAT+miR-124 inhibitor的鼻咽癌细胞HONE-1培养至对数生长期并制成细胞悬液,用无血清培养基漂洗3遍,细胞计数。侵袭试验中,在Transwell小室上室加入200 μL稀释的Matrigel胶,过夜干燥。分别在Transwell小室上室接种200 μL(1×105个/mL)细胞悬液,在小室的下室加入300 μL含10%胎牛血清的RPMI-1640培养基作为趋化因子。37 ℃、5% CO2培养箱培养24 h,取出小室,PBS浸泡洗涤2次。95%乙醇浸泡固定Transwell上室穿膜细胞,PBS洗涤2次,以新鲜配制的结晶紫染液浸染3~5 min,然后用棉签擦除上室中未通过滤膜的细胞,显微镜下观察拍照、计数。
1.3 统计学处理方法采用SPSS17.0统计学软件进行分析。计量资料以±s 表示,2组比较采用t检验,多组比较采用单因素方差分析。P <0.05为差异有统计学意义。
2 结果
2.1 鼻咽癌细胞中MIAT表达上调鼻咽癌细胞中MIAT表达水平明显高于NP-69细胞。其中HONE-1细胞中MIAT表达水平最高,是NP-69细胞的4.47倍(P<0.05)。见图1。这些结果表明MIAT水平可能与鼻咽癌发展相关。由于鼻咽癌细胞HONE-1中MIAT表达水平最高,因此,我们选择HONE-1细胞进行进一步研究。
2.2 HONE-1细胞中MIAT调控miR-124水平越来越多的证据表明,lncRNA可能充当内源竞争RNA与miRNA相互作用。因此,我们利用在线软件DIANA检索与MIAT具有互补碱基配对的miRNA。在与形成互补碱基配对的miRNA列表中,我们重点关注miR-124,其与鼻咽癌细胞增殖、迁移和上皮间质转化密切相关。为探究MIAT与miR-124功能之间的相关性,本研究采用荧光素酶作为报告基因检测MIAT是否是miR-124的功能靶点。结果显示,miR-124 mimic可降低含有MIAT片段报告质粒的荧光素酶活性(P<0.05),但对结合位点发生突变报告质粒的荧光素酶活性没有影响。随后通过miR-124 inhibitor抑制miR-124的表达,结果显示,抑制miR-124的表达,其荧光素酶活性显著提升(P>0.05),而突变体的荧光素酶活性没有变化。见图2A。这些结果表明miR-124可以在特定识别位点直接与MIAT结合。采用荧光定量PCR分析MIAT与miR-124表达水平之间的相关性。过表达MIAT时,miR-124表达水平明显下降,而干扰MIAT的表达则升高(P<0.05),这表明MIAT与miR-124之间可相互结合,见图2B。综上所示,鼻咽癌细胞中MIAT可抑制miR-124的表达。
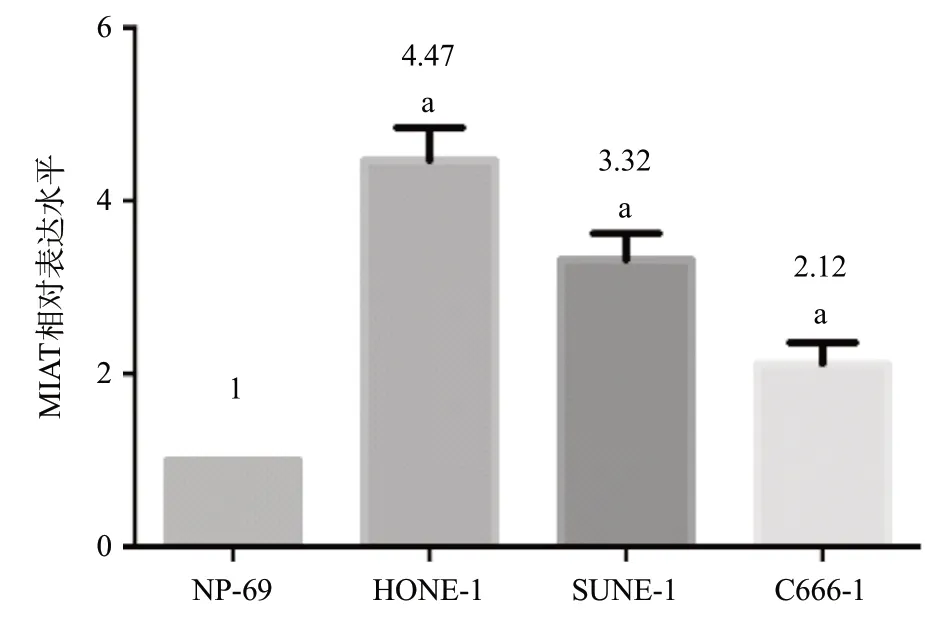
图1 荧光定量PCR检测鼻咽癌细胞中MIAT表达水平
2.3 MIAT通过miR-124调节HONE-1细胞增殖与对照si-NC组OD值(0.467±0.025)相比,转染si-MIAT 24 h后实验组细胞的OD值(0.253±0.025)明显降低(P <0.05)。为进一步研究抑制MIAT表达后miR-124对鼻咽癌细胞增殖的影响,采用miRNA抑制剂干扰miR-124 的表达。结果显示,与对照组(si-MIAT+inhibitor NC)相比,转染miR-124 inhibitor的鼻咽癌细胞增殖能力显著提高,差异有统计学意义(P<0.05)。见图3。以上结果表明,利用siRNA对鼻咽癌细胞的MIAT进行干扰后,MIAT通过下调miR-124的表达丰度促进鼻咽癌细胞增殖。
2.4 MIAT通过miR-124调节HONE-1细胞迁移和侵袭结晶紫染色结果显示,si-MIAT组中穿过Transwell上室的细胞较对照组(si-NC)明显减少(见图4)。为进行定量分析,随机统计5个视野中每个视野下的细胞数量。结果显示实验组(si-MIAT)每个视野的平均细胞数量明显低于对照组(P<0.05)。进一步分析miR-124 inhibitor对鼻咽癌细胞迁移与侵袭能力的影响显示,与对照组(si-MIAT+inhibitor NC)相比,转染组(si-MIAT+miR-124 inhibitor)细胞迁移与侵袭能力显著提高(P<0.05)。以上结果表明,MIAT通过干扰鼻咽癌细胞中miR-124的表达丰度影响鼻咽癌细胞迁移与侵袭能力。
2.5 MIAT通过miR-124调节Wnt/β-catenin信号通路Western blot分析结果显示,抑制MIAT表达时,β-catenin、cyclin D1、c-Myc表达水平下调(P <0.05)。与对照组(si-MIAT+inhibitor NC)相比,转染组(si-MIAT+miR-124 inhibitor)中β-catenin、cyclin D1、c-Myc表达水平显著提升(P<0.05)。见图5。这表明抑制miR-124的表达能提高β-catenin、cyclin D1、c-Myc表达水平,可见MIAT下调miR-124的表达丰度进而提高Wnt/β-catenin信号通路表达。

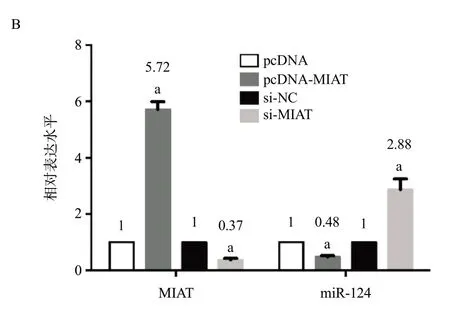
图2 MIAT与miR-124的关系
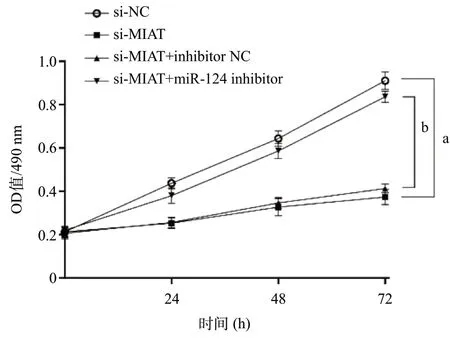
图3 si-MIAT抑制HONE-1细胞增殖
3 讨论
LncRNA已被证实在鼻咽癌的发生和发展中发挥重要作用[9]。近年来研究发现,MIAT参与多种癌症的发生和发展,如慢性淋巴细胞白血病、肺腺癌和前列腺癌[16-19]。有研究报道MIAT的高表达促进胃癌的发展,其可能在人胃癌中发挥致癌作用[21]。此外,研究者通过分析乳腺癌组织的基因表达水平,证实MIAT表达水平提高增加了乳腺癌患病风险,特别是在疾病的早期阶段(阶段I和II),这表明在乳腺肿瘤形成早期阶段MIAT过表达很重要,其可能在恶性肿瘤的发展中起关键作用[22]。然而,MIAT在鼻咽癌中的作用与调节机制尚未见报道。为探讨MIAT在鼻咽癌中的生物学功能,本研究对其表达水平进行了分析。我们的数据显示,与正常鼻咽上皮细胞相比,鼻咽癌细胞中MIAT表达水平上调。
miRNA是一类内源性的、高度保守的非编码单链RNA,广泛存在于植物和多细胞动物的基因组中[7]。近年来,许多研究表明miRNA参与肺癌、乳腺癌、肝癌、鼻咽癌细胞的增殖、迁移与侵袭等过程,调控miRNA的表达丰度能抑制肿瘤发展[23-25]。此外,lncRNA可以作为竞争性内源性RNA,通过序列互补来吸收miRNA,进而影响miRNA的生物学功能。LI等[26]发现MALAT1通过在肺癌细胞中与miR-124结合,激活MAPK信号通路。本研究通过生物信息学分析显示MIAT可能与miR-124相结合,并通过使用荧光素酶报告分析证明MIAT含有miR-124结合位点。现有研究表明,miR-124的表达丰度可能影响肝癌、肺癌等肿瘤的增殖过程[11,27-29]。已有研究发现,miR-124通过抑制Wnt/β-catenin信号通路参与鼻咽癌细胞增殖和迁移[30]。本研究中MTT实验结果显示干扰MIAT表达能抑制鼻咽癌细胞的增殖能力,而转染miR-124 inhibitor后发现鼻咽癌细胞的增殖能力在一定程度得到提高,其可能在鼻咽癌细胞中充当miR-124的分子海绵。miR-124被认为是癌症发展中的抑癌因子,其可以抑制鼻咽癌细胞的增殖和转移。因此,MIAT通过负调控miR-124的表达对人鼻咽癌产生致癌作用。
先前的研究已证实miR-124可抑制Wnt/β-catenin信号通路进而抑制鼻咽癌细胞增殖和侵袭[30]。本研究通过Western blot检测发现MIAT可抵消miR-124对Wnt/β-catenin的抑制作用。这些结果表明,MIAT通过靶向miR-124调控Wnt/β-catenin信号通路。
综上所述,本研究表明MIAT通过调节miR-124而进一步调节Wnt/β-catenin信号通路,促进鼻咽癌细胞的增殖和侵袭。MIAT水平的调控可能为未来鼻咽癌患者提供一种新的治疗方法。
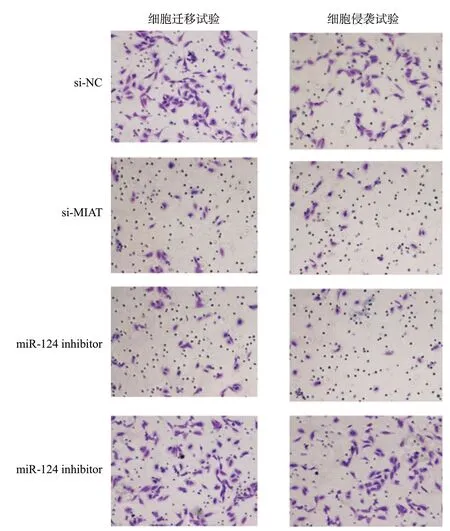

图4 MIAT通过miR-124调节HONE-1细胞迁移和侵袭

图5 MIAT通过miR-124调节Wnt/β-catenin信号通路
