Let-7a过表达对结肠黏液腺癌细胞LS-174T增殖及侵袭性的影响
2019-10-21黄崇杰曹伟兰洪滉刘鹏鹏刘长宝
黄崇杰,曹伟兰,洪滉,刘鹏鹏,刘长宝
(1.温州医科大学附属第二医院 肛肠外科,浙江 温州 325027;2.温州医科大学附属第五医院 甲乳外科,浙江 丽水 323000)
大肠癌是最常见的消化道恶性肿瘤之一,其发病率在全球各肿瘤中位居第三,且有逐年升高的趋势[1]。结直肠黏液腺癌占大肠癌病例的10%~15%,易发生腹膜种植转移,对化疗的反应较差,所以根治切除率低,预后差[2]。目前关于腹膜种植转移的机制尚不十分清楚,TGF-β是一种多功能的多肽类细胞因子,TGF-β1是其中一种亚型,大量研究发现其在胰腺癌、胃癌、大肠癌中的表达量明显升高,且与肿瘤的预后较差直接相关[3-5]。miRNA与肿瘤的发生发展密切相关,一直是近几年来肿瘤研究的热点,let-7家族是第2个被发现的miRNA分子,而let-7a基因的下调已被公认为大肠癌发生发展中的关键事件,且已被证实是一个抑癌基因,其中c-myc、RAS和HMGA2为let-7的下游靶基因。最新研究表明它可以调控TGF-β1信号通路,影响细胞增殖和分化[6],但对黏液腺癌腹膜转移方面的研究尚未见报道。本研究通过慢病毒载体介导携带人let-7a基因导入人结肠黏液腺癌LS-174T细胞,上调1et-7a基因的表达,通过体外实验,观察其对肿瘤的生长抑制作用、侵袭转移及TGF-β1蛋白表达的影响,从而探讨其与结肠黏液腺癌腹膜转移的关系。
1 材料和方法
1.1 细胞株及主要材料人结肠黏液腺癌细胞LS-174T购自中国科学院上海分院,let-7a过表达慢病毒载体系统由上海吉凯基因科技有限公司构建完成,DMEM培养基购自美国Gibco公司,0.25%胰蛋白酶购自美国Gibco公司,胎牛血清购买自杭州四季青公司,兔抗人Anti-TGF-β1多克隆抗体,山羊Anti-Rabbit IgG购自英国Abcam公司,RT-PCR反转录试剂盒购自加拿大MBI fermentas公司,Real-time试剂盒购自日本Toyobo公司,RNA提取液TRIzol购自美国Invitrogen公司,RT-qPCR引物购自上海生工生物工程有限公司。
1.2 方法
1.2.1 细胞转染:①结肠黏液腺癌LS-174T细胞分为5组:空白对照组(A组,不进行病毒转染);转染空病毒组(B组,只含有EGFP,浓度1×107TU/L);C1转染组(C1组,浓度1×106TU/L):转染hsa-Let-7a(含let-7a病毒和EGFP);C2转染组(C2组,浓度1×107TU/L):转染hsa-Let-7a(含let-7a病毒和EGFP);C3转染组(C3组,浓度1×108TU/L):转染hsa-Let-7a(含let-7a病毒和EGFP)。②0.25%胰蛋白酶消化细胞后,配制成密度为2.0×105/mL的细胞悬液种植于24孔板中。待细胞汇合度达到50%~60%时进行病毒转染,按3个不同的MOI值(MOI=1、10、100)计算所需病毒量,用Eni.S稀释得到所需滴度。用培养基稀释Polybrane使终浓度为5 μg/mL。病毒液、Polybrane、完全培养基按一定的比例配制,调整每孔总量为500 μL,加入标记好的各孔。培养12 h后进行换液,48 h后使用荧光显微镜观察细胞生长状况及绿荧光表达情况。
1.2.2 MTT实验:将上述5组细胞接种于96孔板,每组设8个复孔,同时设调零孔。分别于12、24、48、72、96 h各时点取一板,向所对应孔中各加入20 μL配好的MTT溶液。培养箱内孵育4 h后弃去培养液,每孔加入DMSO 200 μL,避光摇床上振荡10 min,使其充分混匀。酶标仪上选择570 nm波长,检测各孔的OD值,以时间为横坐标,OD值为纵坐标,绘制LS-174T细胞生长曲线,并做相关统计学检测。
1.2.3 RT-qPCR检测let-7a及TGF-β1 mRNA表达水平:将各组贴壁细胞消化离心后,裂解,提取RNA并反转录为cDNA,将反转录所得的cDNA,采用SYBR Green嵌合荧光定量PCR法(按照日本Toyobo公司的RT-qPCR试剂盒说明书操作),以β-actin为内参检测细胞的TGF-β1含量,以U6为内参检测细胞let-7a的含量,引物序列见表1。mRNA相对定量的计算方法:首先用RT-qPCR得到的目的基因Ct值分别与其相对应的内参的Ct值相减进行校正,得到目的基因的校正Ct值(ΔCt),再以空白对照组中的平均校正Ct值作为本底参数,则目的基因的量:每个实验重复3次取平均值。

表1 各目的基因及内参引物序列
1.2.4 Western blot检测TGF-β1 蛋白表达水平:将转染后的各组细胞温箱培养48 h后,消化裂解收集细胞并在4 ℃以12 000 r/min离心10 min。收集总蛋白质,并通过BCA蛋白质测定试剂盒测定蛋白质浓度。将处理过的蛋白质样品进行电泳电转至PVDF膜上。用TBST缓冲液洗涤后,用5%脱脂乳将印迹完全封闭2 h,与TGF-β1和β-actin内参抗体孵育。在4 ℃的振荡器上过夜。将膜用TBST洗涤3次,并与HRP标记的山羊抗兔二抗孵育2 h。将膜洗涤3次,并用ECL试剂盒显现反应条带。使用Gel Image System ver分析数据。
1.2.5 细胞侵袭实验:取Transwell小室置于24孔板后水化基质胶,在下室中加入500 μL含15% FBS的DMEM培养基,将LS-174T细胞胰酶消化后,予无血清培养基对其混匀重悬5×105的细胞密度,取100 μL接种在24孔板的上室中。置于37 ℃、5% CO2细胞培养箱,孵育24 h,取出小室,吸掉培养液后用棉签拭去上室内未穿过基底层膜的细胞。将小室置于无水甲醇中固定20 min,再用0.1%结晶紫染色20 min,冲洗,晾干后倒置显微镜对Transwell小室随机取10个不同视野进行拍照保存,计算平均值进行统计分析,绘制统计图。
1.2.6 划痕实验:将LS-174T细胞以每孔5×105个细胞接种在6孔板中。温室培养待细胞长满70%~80%后,予无血清的DMEM培养基饥饿处理12 h。通过用无菌移液管尖端进行垂直划痕并用PBS除去脱落的细胞来模拟伤口。细胞在37 ℃的恒温下培养。36 h后测量。
1.3 统计学处理方法采用SPSS19.0统计软件分析。计量资料以±s表示,多组比较采用单因素方差分析,组间两两比较方差齐者采用LSD-t检验,方差不齐者采用Dunnett’s T3检验。P<0.05为差异有统计学意义。
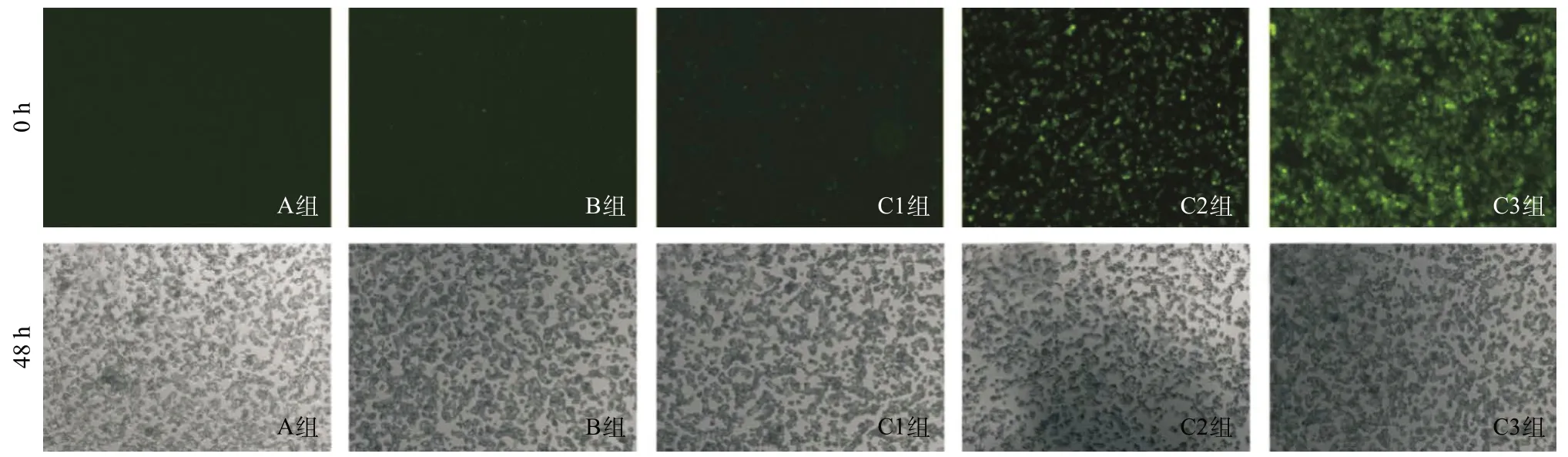
图1 各组细胞转染慢病毒48 h后倒置荧光显微镜观察荧光表达情况(×40)
2 结果
2.1 倒置荧光显微镜观察各组细胞转染效果各组细胞48 h绿色荧光表达情况见图1,C3组荧光表达最强,感染效率可达90%以上,与初始病毒浓度成正相关(P<0.05)。
2.2 MTT法检测各组细胞增殖活力各组OD值均随时间延长而增高,第1天,5组OD值差异无统计学意义(P>0.05),第2、第3、第4天,与A组比,C组的OD值增幅明显降低(P<0.05),B组OD值与A组比差异无统计学意义(P>0.05)。说明let-7a对细胞增殖活力有明显抑制作用,且let-7a含量越高对细胞增殖抑制作用越强,空病毒对细胞增殖无明显影响。见图2。
2.3 RT-qPCR检测各组细胞let-7a及TGF-β1 mRNA表达水平与A组比较,C组细胞let-7a的表达水平均上调;C组之间细胞let-7a的表达水平随着病毒浓度的升高而逐渐升高,差异均有统计学意义(P<0.05);而B组let-7a的表达水平相与A组比差异无统计学意义(P>0.05)。与A组比,C组TGF-β1 mRNA表达水平下调,且与C组间病毒浓度呈负相关,差异均有统计学意义(P<0.01),而B组TGF-β1 mRNA表达水平较A组差异无统计学意义(P>0.05)。见图3。
2.4 Western blot检测TGF-β1蛋白表达水平C组细胞TGF-β1表达水平较A组降低(P<0.05);B组与A组TGF-β1表达水平差异无统计学意义(P>0.05),见图4。
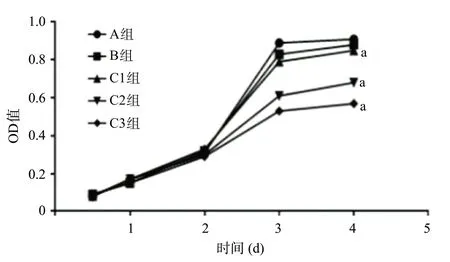
图2 各组细胞生长曲线
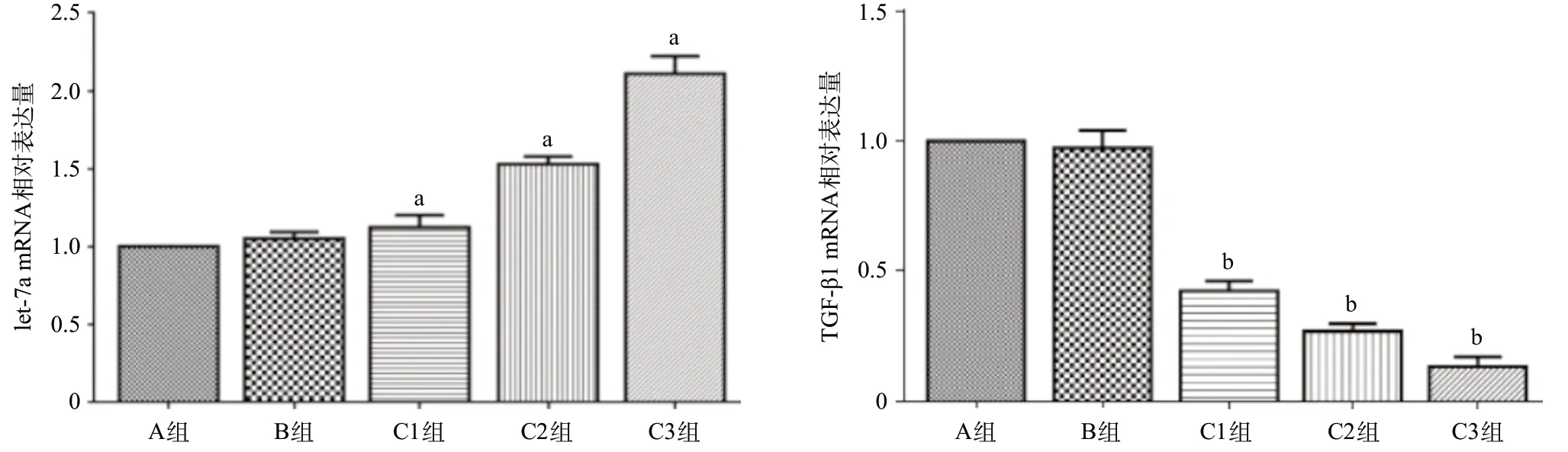
图3 各组细胞中let-7a和TGF-β1 mRNA的表达水平
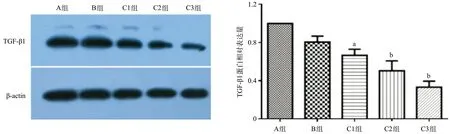
图4 各组细胞TGF-β1蛋白相对表达量
2.5 Transwell侵袭实验检测各组细胞侵袭能力C组细胞穿过滤膜数较A组均降低,差异有统计学意义(P <0.01),且转染含let-7a慢病毒浓度越高穿过滤膜细胞数越少;A组与B组比,细胞穿过滤膜数差异无统计学意义(P>0.05),见图5。
2.6 划痕实验检测各组细胞迁移能力C组细胞划痕愈合率较A组降低,差异有统计学意义(P<0.05);A组与B组比,细胞划痕愈合率差异无统计学意义(P>0.05),见图6。
3 讨论
大肠黏液腺癌是一组起源于结直肠上皮组织,以黏液分泌异常亢进为特征的恶性肿瘤,因其易浸润突破浆膜层和淋巴结转移,容易发生腹膜种植转移,预后较差。目前关于腹膜种植转移的机制尚不十分清楚,目前的研究主要集中在癌细胞自身和腹膜的解剖生理功能及分子生物学机制,包括种子-土壤学说、乳斑学说。TGF是一种多功能的多肽类细胞因子,其中包括TGF-β、活性素、骨形态发生蛋白、生长分化因子等[7],它们的氨基酸序列具有不同程度的同源性,其中TGF-β是一个相对分子质量约为25 kDa的二聚体分子,有5个亚型(l~5),其中TGF-βl发挥最主要的作用,它可通过自分泌或旁分泌调节细胞活动,参与多种病理生理过程,对细胞的生长、分化、黏附、侵袭及细胞外基质的形成具有重要作用[8]。研究表明TGF-β可通过诱导腹膜纤维化,为种植转移提供良好的土壤,诱导上皮间质转化、调节黏附相关分子、金属蛋白酶的表达从而促进细胞发生腹膜转移[9-10]。所以我们认为通过调控TGF-β1信号通路可以抑制大肠黏液腺癌腹膜转移的发生发展。

图5 Transwell显示各组细胞迁移能力
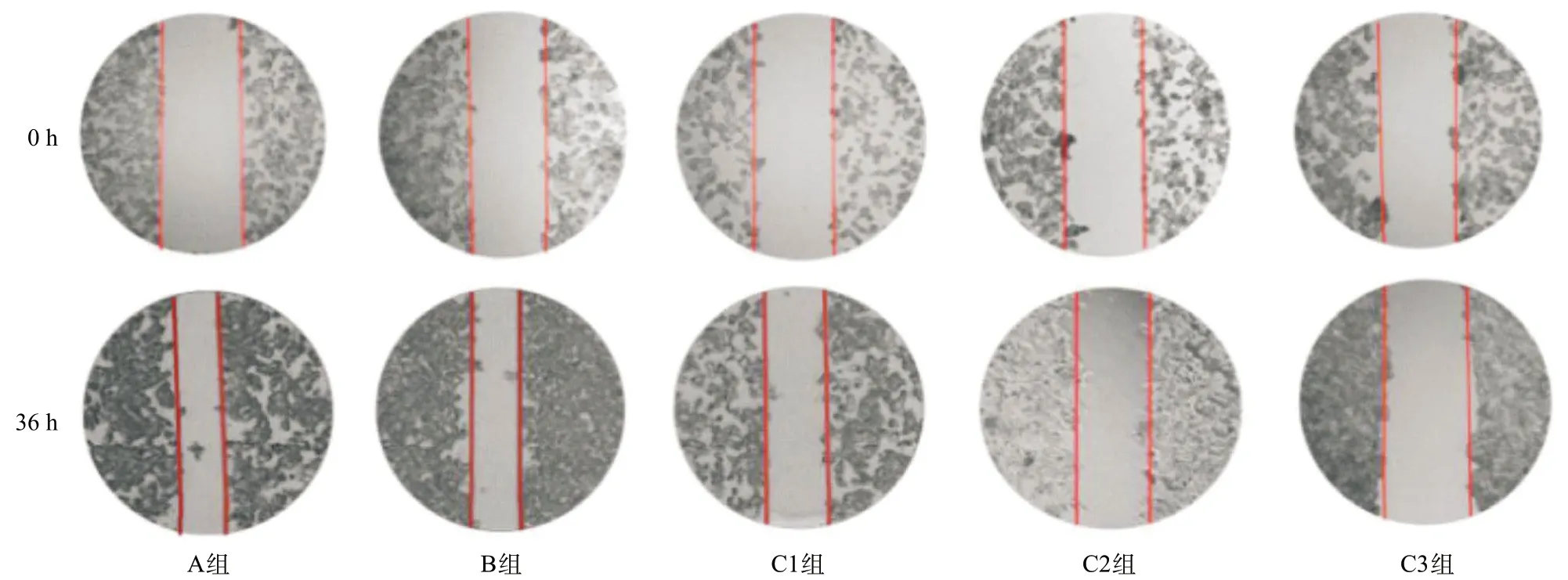
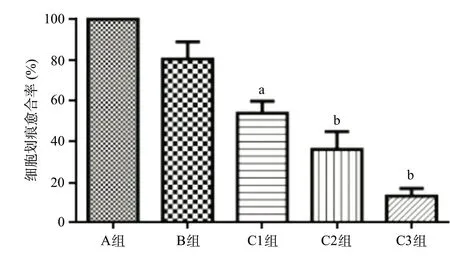
图6 划痕实验显示各组细胞划痕愈合率(×40)
近年来发现,miRNA与肿瘤的发生发展密切相关,let-7a基因的下调已被公认为大肠癌发生发展中的关键事件,且已被证实是一个抑癌基因,研究发现它可通过调控c-myc、RAS和HMGA2下游靶基因抑制肿瘤细胞增殖、促进凋亡[11],AKAO等[12]研究发现,let-7a在结肠癌组织和细胞株中表达水平都有所下降,当用let-7a-1转染DLD-1结肠癌细胞株后,结肠癌细胞受到了明显的生长抑制,并且还发现转染后,Ras和c-myc蛋白的表达水平明显下降。本研究通过慢病毒载体介导携带人let-7a基因导入人结肠黏液腺癌LS-174T细胞,荧光倒置显微镜观察各组细胞48 h后绿色荧光表达情况,C3 感染组荧光表达最强,感染效率可达90%以上,与初始病毒浓度成正相关,表明慢病毒载体介导let-7a能成功、高效转导入人结肠癌LS-174T细胞。MTT检测结果显示各组OD值均随时间延长而增高,在第1天,5组OD值无明显差异,第2、第3、第4天,与空白对照组相比,转染组的OD值增幅明显降低,说明let-7a过表达对细胞增殖活力有明显抑制作用,且let-7a含量越高对细胞增殖抑制作用越强,空病毒对细胞增殖无明显影响。荧光定量PCR检测各组细胞let-7a mRNA表达水平,结果显示与阴性对照组相比,转染组let-7a mRNA的表达水平显著升高,且转染细胞let-7a的表达水平与含let-7a的慢病毒浓度梯度呈正相关,阴性转染组与未转染组表达水平无明显差异,实现了细胞内let-7a不同表达水平的干预。进一步结果发现let-7a高表达组即转染组细胞增殖能力、迁移能力较未转染组降低,且let-7a浓度越高降低程度越明显,未转染组与阴性对照组细胞增殖能力、迁移能力、侵袭能力无明显差异,表明上调let-7a表达水平对LS-174T细胞增殖能力、迁移能力、侵袭能力有抑制作用,而空病毒对LS-174T细胞增殖及迁移侵袭能力无明显影响。通过Western blot和RT-qPCR检测TGF-β1蛋白及mRNA的表达水平,转染组细胞内TGF-β1 mRNA及蛋白表达水平较未转染组均呈明显下降趋势,未转染组与阴性转染组无明显差异。TGF-β1表达水平同let-7a表达水平呈负相关,进而推测上调let-7a可能是通过下调TGF-β1表达水平而发挥抑制LS-174T细胞增殖活性及迁移侵袭能力,可能影响结肠癌腹膜种植转移。
综上所述,本研究初步探索了let-7a和TGF-β1在LS-174T细胞增殖、迁移及侵袭中的作用及其可能作用机制,结合实验结果,我们可以推测过表达的let-7a可明显抑制细胞生长,可能通过TGF-β信号通路,抑制肿瘤细胞增殖、迁移和侵袭,从而抑制大肠黏液腺癌腹膜转移的发生发展,但其具体分子通路、各个通路之间相互作用需进一步深入研究。
