microRNA在皮肤黑色素瘤血清与毛发中的差异表达
2019-10-19林千里张文俊王中志汪汇江华
林千里 张文俊 王中志 汪汇 江华
[摘要] 目的 探讨皮肤恶性黑色素瘤miRNA的差异表达有望为该肿瘤的诊断和靶向治疗提供依据,筛选皮肤恶性黑色素瘤血清和毛发2个部位的7个特异性miRNA表达差异。 方法 收集2016年3月~2017年10月在海军军医大学附属长征医院手术局部切除并经常规组织病理学和免疫组织化学检测证实为恶性皮肤黑色素瘤(CM)的12个病例作为CM组,同期收集非肿瘤疾病的17个皮肤病病例作为对照组。采用qRT-PCR技术检测两组患者的血清和毛发中miRNA表达情况。将检测结果一致的候选miRNA确定为有意义的共同差异表达生物学指标,利用组间差异倍数筛选出差异>2.5倍差异表达的miRNA。 结果 CM组患者血清中7个miRNA有2个上调,5个下调,上调的miRNA包括miR-4487和miR-4706,下调的miRNA包括miR-16、miR-211、miR-4731、miR-509-3p和miR-514a;毛发中有3个上调,4个下调,上调的miRNA包括miR-211、miR-4487和miR-4731;下调的miRNA包括miR-16、miR-4706、miR-509-3p和miR-514a。与对照组比较,CM组miR-4487在血清和毛发中共同上调,但差异无统计学意义(P > 0.05)。与对照组比较,CM组血清和毛发中has-miR-16和has-miR-509-3p表达显著下调,差异均有统计学意义(P < 0.05),并且一致性较高;与对照组比较,CM组血清和毛发中miR-541a表达虽然显示共同下调,但差异无统计学意义(P > 0.05)。血清和毛发差异表达2.5倍以上的miRNA为miR-16和miR-514a;单独毛发差异表达2.5倍以上的miRNA为miR-4706;单独血清标本4倍以上差异表达为miR-4731;血清标本10倍以上差异表达的miRNA为miR-211和miR-509-3p。 结論 与非肿瘤疾病患者比较,血清和毛发中存在多种miRNA的差异表达,CM患者血清中miR-211和miR-509-3p存在高度显著差异表达,可以作为该肿瘤的生物学标志物;毛发标本miR-4706的差异表达有可能成为黑色素瘤早期非创伤性检测的生物学指标。miRNA检测对CM是可利用的生物学指标,也可能成为今后靶基因治疗的手段。
[关键词] 皮肤黑色素瘤;微小RNA;信号转导通路;差异表达
[中图分类号] R739.5 [文献标识码] A [文章编号] 1673-7210(2019)09(b)-0007-06
Differential expression of microRNAs in serum and hairs different position of cutaneous melanoma
LIN Qianli ZHANG Wenjun WANG Zhongzhi WANG Hui JIANG Hua
Department of Plastic Surgery, Shanghai Changzheng Hospital, Navy Military Medical University, Shanghai 200003, China
[Abstract] Objective To investigate the differential expression of microRNAs in cutaneous malignance melanoma in order to provide a basis for the diagnosis and targeted treatment of this malignancy; to screen seven specific microRNAs in serum and hairs of cutaneous malignancy melanoma. Methods From March 2016 to October 2017, 12 cases of cutaneous melanoma (CM) confirmed by routine histopathology and immunohistochemistry in Shanghai Changzheng Hospital, Navy Military Medical University, were collected as CM group, while 17 cases of non-neoplastic skin diseases were collected as control group. The expression situation of microRNAs in serum and hair of two groups were detected by qRT-PCR. Candidate microRNAs with consistent results were identified as significant common differential expression biological indicators. The differentially expressed microRNAs (> 2.5 times) were screened by the multiple of differences between groups. Results There were 2 up-regulated and 5 down-regulated microRNAs in serum among 7 microRNAs of patients in CM group. The up-regulated microRNAs included miR-4487 and miR-4706, the down-regulated microRNAs included miR-16, miR-211, miR-4731, miR-509-3p and miR-514a. There were 3 up-regulated and 4 down-regulated microRNAs in hairs, the up-regulated microRNAs included miR-211, miR-4487 and miR-4731; the down-regulated microRNAs included miR-16, miR-4706, miR-509-3p and miR-514a. The co-up-regulated microRNAs in serum and hairs of the CM group were microRNAs-4487, but there was no statistically significant difference between the two groups (P > 0.05). Compared with the control group, the expressions of has-microRNA-16 and has-microRNA-509-3p were significantly down-regulated, the differences were statistically significant (P < 0.05), and with high consistency. Compared with control group, the expression of miRNA-541a in serum and hairs of CM group was down-regulated, but there was no statistically significant difference (P > 0.05). MiRNAs with more than 2.5 times differential expression in serum and hairs were miR-16 and miR-514a. In hair alone, miR-4706 was with differential expression of more than 2.5 times. The miR-4731 was more than 4 times differentially expressed in serum samples alone. MiRNAs with more than 10 times differential expression in serum were miR-211 and miR-509-3p. Conclusion Compared with non-cancer patients, there are many differentially expressed microRNAs in serum and hairs. There are highly significant differentially expressed microRNAs 211 and 509-3p in serum of CM patients, which can be used as biological markers of the tumor. Differential expression of microRNAs 4706 in hair samples may be the biology of early noninvasive detection of melanoma. Indicators. Detection of microRNAs is an available biological indicator for CM, and may become a means of target gene therapy in the future.
[Key words] Cutaneous melanoma; MicroRNA; Signal transduction pathway; Differential expression
恶性黑色素瘤是最具侵袭性和转移性的肿瘤,虽然在各种皮肤恶性肿瘤发病中仅占4%,但易转移,已成为一种严重威胁人类健康的癌症,死亡率高达70%左右[1],转移性黑素瘤(CM)患者的5年生存率不足15%[2]。皮肤黑素瘤中存在异常表达的微小核糖核酸(microRNA,miRNA),而且与该疾病病情演进和转移等恶性程度的研究报道日益增多[3-5]。miRNA是一类长度为20~24 nt的非编码单链小RNA,约占整个基因组的1%,有研究[6-7]认为人类基因组中约1/3受miRNA调控。miRNA参与了人类大多数肿瘤疾病的发生和发展,其作用类似抑癌基因或癌基因,目前相关研究主要集中于乳腺癌、肺肿瘤、肝癌、前列腺癌和白血病等。本研究运用PCR技术检测血清和毛发不同部位CM miRNA表达,以便进一步研究CM在早期诊断上的意义以及转录后调控水平的發病机制。
1 资料与方法
1.1 一般资料
选择2016年3月~2017年10月在第二军医大学附属长征医院(以下简称“我院”)手术局部切除并经常规组织病理学和免疫组织化学检测证实为皮肤恶性黑色素瘤(cutaneous malignance melanoma,CMM)的12例患者,并设为CM组;选择同期我院收集17个非肿瘤皮肤病病例作为对照组。12例CM组患者中,男7例,女5例;年龄29~81岁,平均(54.3±13.3)岁。临床皮损表现为黑斑、结节、肿块和溃疡等,分布于肢端7例,腹壁5例。其中1例已发生局部淋巴结内转移。术后分别经2名及以上病理医师单独诊断。所有患者术前均未接受任何治疗。17例对照组患者均经病理确诊排除黑色素瘤样病变,其中男12例,女5例;年龄19~73岁,平均(52.5±10.4)岁。两组病例年龄和性别比较,差异无统计学意义(P > 0.05),具有可比性。本研究获医院医学伦理委员会批准,所有患者均在术前均签署知情同意书。
1.2 样本采集
1.2.1 血液样本 采集受试者静脉全血,置于5 mL血清采集管中,室温静置1 h后离心(2700×g,10 min),冰浴上小心吸取上层血清至EP管中,标记后置于-80℃保存备用。
1.2.2 毛发样本 留取受试者枕部毛发发梢,每例受试者留取10根,长度为1 cm,用70%乙醇5 mL浸泡1 h,加若干蒸馏水洗净,加入5 mL 4℃ 0.9%NaCl溶液置粉碎机中充分粉碎10 min,收集后置EP管中,随后加入5% β-巯基乙醇1 mL和20 μL蛋白酶K(20 mg/μL),置37℃孵育箱10~12 h,再加入2 mL氯仿,经离心(4700×g,3 min),置1.5 mL EP管,标记后置于-80℃保存备用。
1.3 主要试剂
mirVanaTM miRNA提取试剂盒、mirVanaTM miRNA标记试剂盒均购自美国Ambion公司。逆转录试剂盒、荧光定量PCR试剂盒均购自德国Qiagen公司,Applied Biosystems 7300荧光定量PCR仪为美国ABI公司。1.5 mL无核酸酶离心管(美国Axygen公司);磁力搅拌棒、磁力搅拌盘(美国Corning公司);微型离心器(美国ThermoFisher公司);染色盘和滑架(×3)(英国ThermoShandon公司);NanoDrop ND-2000紫外分光光度仪(美国Thermo公司)。
1.4 方法
1.4.1 提取miRNA 依照说明书提取血清和毛发组织中的总RNA(富集miRNA)。提取总RNA每个标本用1 mL Trizol试剂对组织进行裂解,将上述裂解液转入EP管中,室温下静置5 min;每1 mL Trizol加0.2 mL氯仿后振荡15 s,室温静置2~3 min,2~8℃条件下12000×g离心15 min;收集上层水相置于新EP管中,每1 mL Trizol中加0.5 mL异丙醇,室温下静置10 min,12000×g离心10 min;弃上清液,每1 mL Trizol加1 mL 75%乙醇进行洗涤,涡旋混合,7500×g离心5 min,弃上清;让沉淀的RNA在室温下自然干燥。无核酶水中溶解RNA沉淀,采用ND-1000紫外分光光度计检测波长为260、280和230 nm处所抽提的总RNA中的吸光度(A)值,确定样品浓度和总量。采用琼脂糖凝胶电泳检测RNA的完整性。
1.4.2 荧光实时定量RT-PCR法测定miRNA ①逆转录合成cDNA:取总RNA 1 μg,miScript逆转录酶混合液1 μL,5×miScript RT缓冲液4 μL,加无RNA酶水至反应体积为20 μL。37℃温浴60 min,95℃ 5 min,终止反应。②荧光实时定量PCR检测差异表达基因:cDNA进行PCR反应,探针目标序列见表1。cDNA模板2 μL,加无RNA酶水定容至总反应体积50 μL。反应条件:初始活化95℃ 15 min;变性94℃ 15 s,退火55℃ 30 s,延伸70℃ 34 s,共40个循环。相同条件下实验重复3次。miRNA测定选取U6 snRNA作为内参;相对表达量用2-ΔΔCt值表达。2-ΔΔCt值以>2.5倍为显著性差异,即两组样本miRNA表达差异倍数>2.5倍。
表1 定量PCR探针目标序列
1.5 统计学方法
采用GeneSpringGX基因分析统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,两组间比较采用Mann-Whitney U检验。以P < 0.05为差异有统计学意义。
2 结果
2.1 血清和毛发2种不同来源的miRNA qRT-PCR检测结果
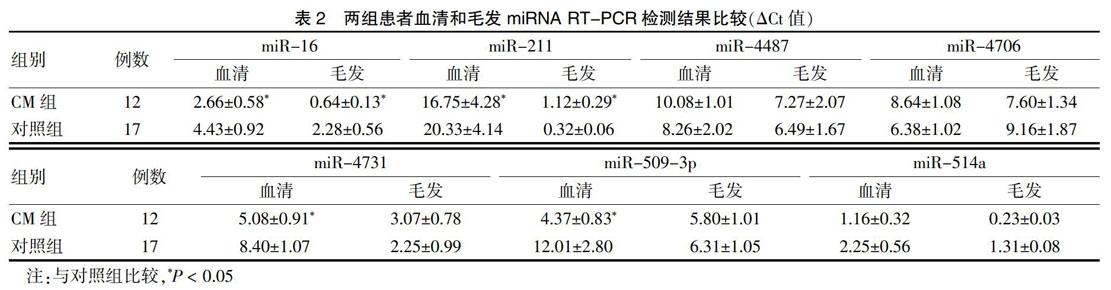
与对照组比较,CM组患者血清中上调的miRNA为miR-4487和miR-4706,下调的miRNA为miR-16、miR-211、miR-4731、miR-509-3p和miR-514a;CM组患者毛发中上调的miRNA为miR-211、miR-4487和miR-4731,下调的miRNA为miR-16、miR-4706、miR-509-3p和miR-514a;在2种不同类型取材中共同上调的miRNA为miR-4487,共同下调的miRNA为miR-16、miR-509-3p和miR-514a。见表2。
2种不同来源的miRNA RT-PCR检测结果显示,与对照组比较,CM组患者血清及毛发中has-miR-4478在血清和毛发中共同上调,但差异无统计学意义(P > 0.05);两组miR-4706的表达比较,差异均无统计学意义(P > 0.05);CM组血清has- miR-4731表达低于对照组,且差异有统计学意义(P < 0.05),而毛发has- miR-4731表达高于对照组,但差异无统计学意义(P > 0.05);与对照组比较,CM组血清和毛发中has-miR-16和has-miR-509-3p的表达均下调,但仅血清中has-miR-16差异有统计学意义(P < 0.05);而CM组血清和毛发中miR-514a表达虽然显示共同下调,但与对照组比较,差异均无统计学意义(P > 0.05)。血清和毛发中has-miR-211的表达相反,CM组血清中miR-211较对照组显著下调,而毛发中has-miR-211的表达却较对照组明显增高,差异均有统计学意义(P < 0.05)。见表2。
2.2 CM患者血清与毛发组织中miRNA表达谱的差异表达
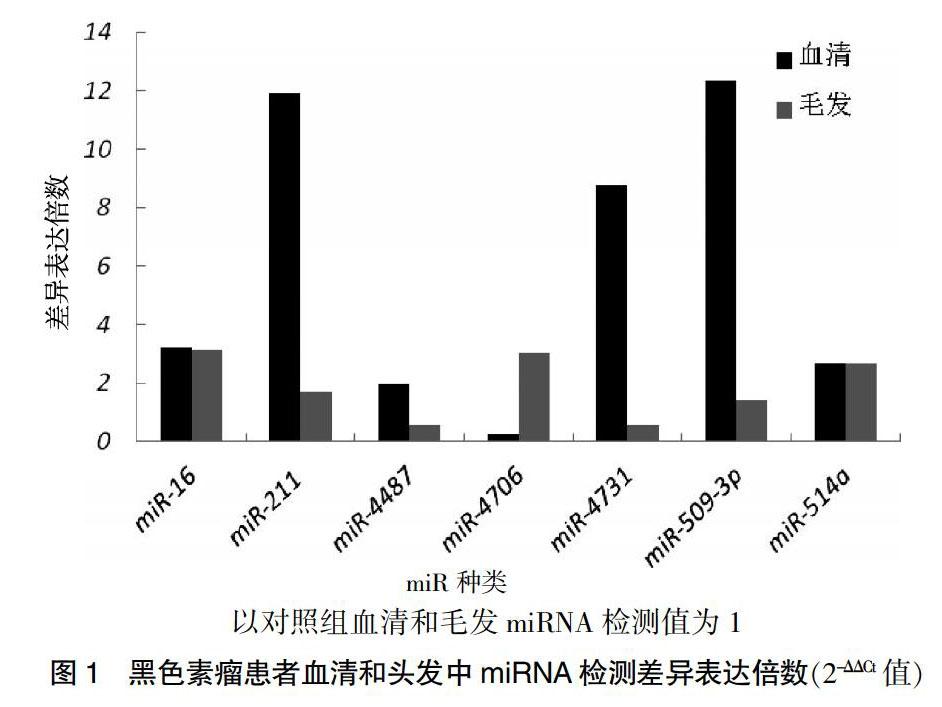
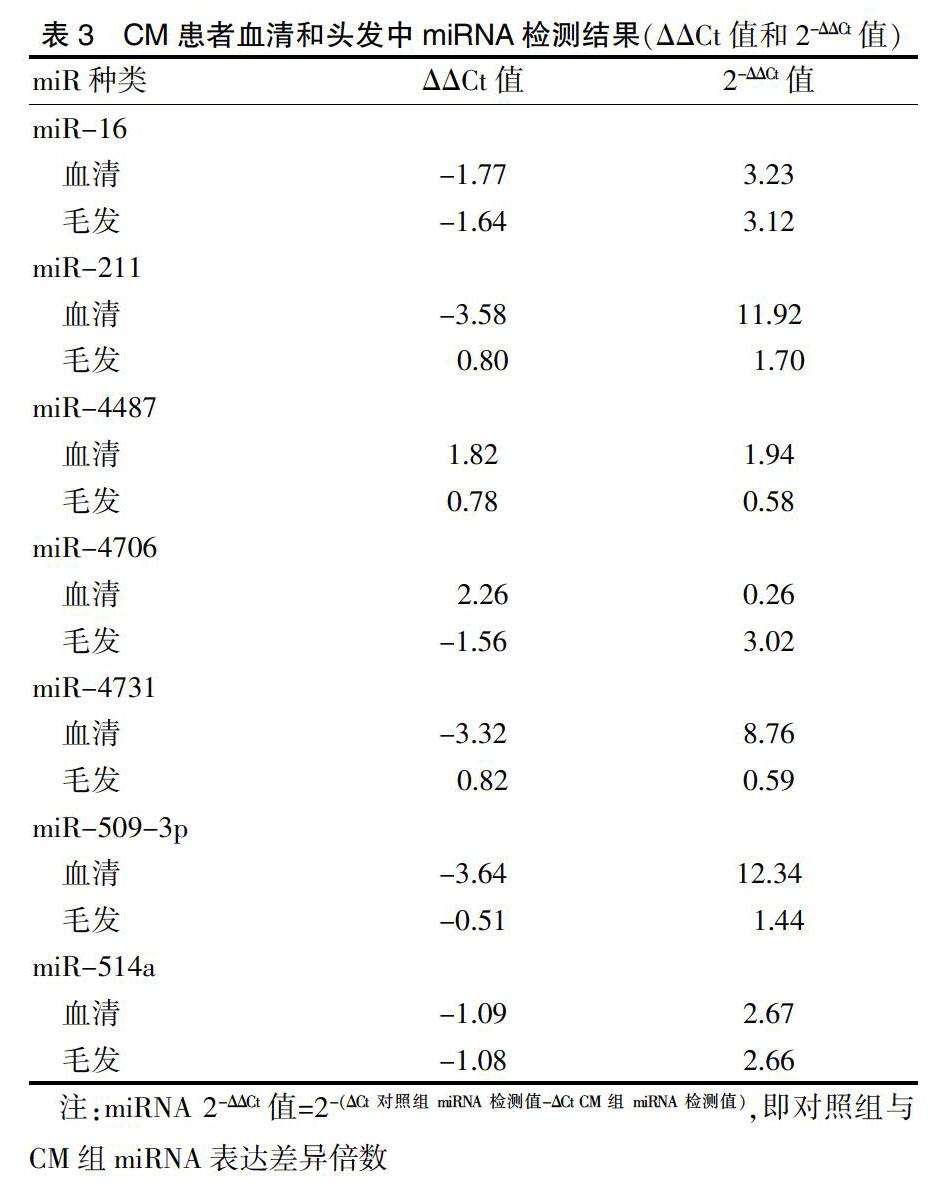
将12例CM患者血清分别与毛发组织相对应的miRNA表达进行比较,2.5倍以上差异表达miRNA为miR-16(血清中表达降低3.23倍和毛发中表达降低3.12倍)、miR-4706(仅毛发中表达降低3.03倍) 和miR-514a(血清和毛发均存在表达差异性降低,分别降低2.67、2.66倍);4倍以上差异表达仅为miR-4731(仅血清差异性表达降低8.76倍);10倍以上差异表达分别为血清miR-211和miR-509-3p(分别降低11.92、12.34倍)。见表3、图1。
表3 CM患者血清和头发中miRNA检测结果(ΔΔCt值和2-ΔΔCt值)
注:miRNA 2-ΔΔCt值=2-(ΔCt对照组miRNA检测值-ΔCt CM组miRNA检测值),即对照组与CM组miRNA表达差异倍数
以对照组血清和毛发miRNA检测值为1
图1 黑色素瘤患者血清和头发中miRNA检测差异表达倍数(2-ΔΔCt值)
3 讨论
miRNA是一种内源性、非编码蛋白质的短小序列RNA。Zhang等[8]发现miRNA相应的DNA基因拷贝数与转录水平的miRNA一致,它可导致miRNA下调。黑素瘤中有85.9%的DNA基因变异相关miRNA表达异常。既往黑色素瘤的研究多基于基因或蛋白水平,近十年来众多研究表明,表达异常的miRNA与恶性肿瘤的发生和发展密切相关。miRNA调节了人类1/3的编码基因,因此找出与黑色素瘤发生和增殖相关的关键miRNA,并研究这些miRNA与其靶基因的调控关系,可为黑色素瘤早期诊断以及治疗的研究奠定基础[9]。PCR检测技术因精确精准且价廉,大大加快了其在肿瘤miRNA诊断方面的应用。
目前临床上缺乏有效的黑色素瘤早期诊断指标。大部分黑色素瘤发现时已为晚期并已发生转移,因此黑色素瘤的早期诊断有极其重要的意义,而miRNA异常表达的检测可为黑色素瘤早期诊断提供可能。2012年,Xu等[10]研究发现,与色素痣比较,miR-203和miR-205在黑色素瘤中明显下调,可作为黑色素瘤早期诊断的生物学标志物。Babapoor等[11]前期研究发现,黑色素瘤组织中miRNA-211显著低表达。该研究进一步对石蜡包埋黑色素瘤和色素痣组织中进行miR-211原位杂交实验,结果显示黑色素瘤中miR-211表达水平明显低于色素痣,其作为黑色素瘤早期诊断指标的敏感性和特异性分别为90%和86.2%。
本研究运用7条成熟miRNA在人皮肤黑素瘤组织中的表达情况,发现在共同高度差异表达(>4倍)的miRNA为miR-211、miR-509-3p、miR-4731。miR-211在黑色素瘤中的表达水平明显下调,是该肿瘤的早期辅助诊断指标[12]。本研究中用RT-PCR方法筛选出miRNA与非黑色素瘤患者组织中存在的差异表达,这些差异表达高度下调的miR-211与既往发表的研究结果相同[13-14];同时对于编码RAF家族丝氨酸/苏氨酸蛋白激酶(BRAF)V600突变阳性和不能手术切除或转移性的黑素瘤,采用维罗非尼(Vemurafenib)个体化靶向治疗,可观察到miR-211显著升高[13]。同樣,本次实验中发现皮肤黑素瘤患者血清miR-509-3p显著下调(达12.34倍)。有研究发现,磷脂酰肌醇蛋白聚糖6(Glypicans 6)通过对Wnt、纤维母细胞生长因子(fibroblast growth factors,FGFs)和骨形成蛋白(bone morphogenetic proteins,BMPs)等信号通路导致皮肤黑素瘤生长和转移,而这一过程可以被miR-509-3p所抑制,反之也说明血清miR-509-3p显著下调是皮肤黑素瘤进展的重要标志物[14]。但这个实验结果与丹麦的研究不同,可能与他们所关注的眼结膜黑色素瘤的肿瘤种类不同有关[15]。本研究发现皮肤黑素瘤患者血清miR-4731显著下调(达8.76倍),Stark等[16]基础研究证明,miR-4731与细胞周期通路和黑色素瘤发生高度相关,miR-4731过表达可调节细胞周期通路中的CCNA2、ORC5L和PCNA;同时可调节黑色素瘤相关基因RAB7A、CTSD和GNA13的表达,总之,miR-4731表达降低是黑色素瘤的危险因素。
用血清和毛發不同部位黑色素瘤患者标本差异表达miRNA预测到的靶基因参与的信号通路不尽相同,仅miR-16和miR-514a共同低表达于血清和毛发,已有报道,miR-16表达有助于抑制CM肿瘤细胞的增殖[17];目前关于miR-514a对黑色素瘤的作用尚不明确,但有研究报道,miR-514a通过EGFR/MAPK/ERK信号通路,对肾脏肿瘤是一个新的抑制剂[18]。而miR-4706独特表现于头发标本,可能与黑色素瘤患者不同部位黑色素形成和功能有关,这也可能是黑色素瘤诊断以及今后设计药物的靶点。经检索PubMed、Medline、miRBase22.0、国内万方和中国知网等数据库均未发现有miR-4706的相关研究报道,于miRBase22.0数据库中可以了解miR-4706主要来源于黑色素瘤、成黑素细胞(melanoblast)和视网膜黑色素瘤(uveal melanoma)。差异表达研究中,突出表现在组织来源不同所呈现出相反的结果,如:CM患者血清miR-211和miR-4731检测结果均表现为显著下降(ΔΔCt值分别为-3.58和-3.32),而毛发标本检测结果均为增高(ΔΔCt值分别为0.80和0.82),因此对于miRNA检测分析中必需加入条件设定,如本研究设定2-ΔΔCt值以>2.5倍为显著性差异,而对照组均设定为1倍。一般而言,低于2.5倍的DNA或RNA检测值(2-ΔΔCt值)可被认定为无显著性差异。在2-ΔΔCt 计算值表达上,与对照组比较,本研究观察到CM患者血清miR-211显著降低11.92倍,而毛发部位miR-211表达增高1.70倍;同样,CM患者血清miR-4731显著低表达,为8.76倍,而毛发中的表达略增高0.59倍。即miR-211和miR-4731在毛发中的表达基本等同于对照组,可认定为这2个miRNA在毛发中不能灵敏检测CM病变。
本研究存在的不足之处在于:①收集的标本量不足,容易造成生物信息学分析的遗漏和数据偏移。②本研究中采用的研究方法较简单,采用倍数分析对基因表达情况进行简单的统计学推断方法可比性稍差。③本研究中对研究结果未采用荧光素酶报告基因(Luciferase)和Western blot法的验证,也未进行体外黑色素瘤细胞株结合体内研究进行验证。④由于实验所有的CM标本均来自近2年内的手术患者,患者的预后随访以及生存率还无法进行评估。有待进一步深入研究,为黑色素瘤的早期诊断、治疗和预后研究提供新的策略。
4 结论与展望
本实验对12例黑色素瘤和17例非黑色素瘤皮肤病血清和头发组织miRNA表达水平进行了比较,初步取得了CM有差异性表达的miRNA结果。CM患者血清标本显示miR-211和miR-509-3p与非肿瘤患者具有10倍以上的差异,是黑色素瘤显著的生物学标志物;而CM患者毛发标本miR-4706特异性的下调可能是诊断黑色素瘤早期非创伤性检查生物学标志物。
应用小干扰RNA(small interference RNA,siRNA)技术治疗黑色素瘤已成为一种新型治疗途径,有研究者探索将siRNA用于治疗,但有效性仍需进一步验证[19]。由于RNA干扰技术的迅猛发展及临床实践的有效性,相信miRNA作为生物标志物极有可能成为未来治疗恶性黑色素瘤的治疗靶点。未来在增加例数和对各型黑色素瘤分析基础上,更深入地研究,探讨其发病机制及基因治疗的思路。miRNA的研究也符合最新美国皮肤病学学会2019黑色素瘤指南的要求,可以为临床早期辅助诊断、治疗以及预后判断提供更有效的手段[20]。
[参考文献]
[1] Kudchadkar RR,Smalley KS,Glass LF,et al. Targeted therapy in melanoma [J]. Clin Dermatol,2013,31(2):200-208.
[2] Meng F,Henson R,Wehbe-Janek H,et al. MicroRNA-21 regulates expression of the PTEN tumor suppressor gene in human hepatocellular cancer [J]. Gastroenterology,2007, 133(2):647-658.
[3] Lorio MV,Ferracin M,Liu CG,et al. MicroRNA gene expression deregulation in human breast cancer [J]. Cancer Res,2005,65(16):7065-7070.
[4] Svedman FC,Lohcharoenkal W,Bottai M,et al. Extracellular microvesicle microRNAs as predictive biomarkers for targeted therapy in metastastic cutaneous malignant melanoma [J]. PLoS One,2018,13(11):e0206942. doi:10.1371/journal. pone.0206942. eCollection 2018.
[5] Mohammadpour A,Derakhshan M,Darabi H,et al. Melanoma:Where we are and where we go [J]. J Cell Physiol,2019, 234(4):3307-3320.
[6] Lee RC,Feinbaum RL,Ambros V. The C Elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14 [J]. Cell,1993,75(5):843-854.
[7] Van Laar R,Lincoln M,Fereday S. Characterisation and validation of Mel38;A multi-tissue microRNA signature of cutaneous melanoma [J]. PLoS One,2019,14(2):e0211504. doi:10.1371/journal.pone.0211504. eCollection 2019.
[8] Zhang L,Huang J,Yang N,et al. MicroRNAs exhibit high frequency genomic alterations in human cancer [J].Proc Nail Acad Sci USA,2006,103(24):9136-9141.
[9] Sabarimurugan S,Madurantakam Royam M,Das A,et al. Systematic Review and Meta-analysis of the Prognostic Significance of miRNAs in Melanoma Patients [J]. Mol Diagn Ther,2018,22(6):653-669.
[10] Xu Y,Brenn T,Brown ER,et al. Differential expression of microRNAs during melanoma progression:miR-200C,miR-205 and miR-211 are downregulated in melanoma and act as tumor suppressors [J]. Br J Cancer,2012,106(3):553-561. doi:10.1038/bjc.2011.568.
[11] Babapoor S,Horwich M,Wu R,et al. microRNA in situ hybridization form miR-211 detection as ancillary test in melanoma diagnosis [J]. Mod Pathol,2016,29(5):461-475. doi:10.1038/modpathol.2016.44.
[12] Margue C,Philippidou D,Reinsbach SE,et al. New target genes of MITF - induced microRNA-211 contribute to melanoma cell invasion [J]. PLoS One,2013,8(9):e73473. doi:10.1371/journal.pone.0073473. eCollection 2013.
[13] Díaz-Martínez M,Benito-Jardón L,Alonso L,et al. miR-204-5p and miR-211-5p Contribute to BRAF Inhibitor Resistance in Melanoma [J]. Cancer Res,2018,78(4):1017-1030.
[14] Li Y,Li M,Shats I,et al. Glypican 6 is a putative biomarker for metastatic progression of cutaneous melanoma [J]. PLoS One,2019,14(6):e0218067.doi:10.1371/journal.pone.0218067. eCollection 2019.
[15] Larsen AC. Conjunctival malignant melanoma in Denmark:epidemiology,treatment and prognosis with special emphasis on tumorigenesis and genetic profile [J]. Acta Ophthalmol,2016,94 Thesis 1:1-27. doi:10.1111/aos.13100.
[16] Stark MS,Tom LN,Boyle GM,et al. The "melanoma-enriched" microRNA miR-4731-5p acts as a tumor suppressor [J]. Oncotarget,2016,7(31):49 677-49 687.
[17] Poell JB,van Haastert RJ,de Gunst T,et al. A functional screen identifies specific microRNAs capable of inhibiting human melanoma cell viability [J]. PLoS One,2012,7(8):e43569. doi:10.1371/journal.pone.0043569.
[18] Ke X,Zeng X,Wei X,et al. MiR-514a-3p inhibits cell proliferation and epithelial-mesenchymal transition by targeting EGFR in clear cell renal cell carcinoma [J]. Am J Transl Res,2017,9(12):5332-5346.
[19] Davis ME,Zuckerman JE,Choi CHJ,et al. Evidence of RNAi in humans from systemically administered siRNA via targeted nanoparticles [J]. Nature,2010,464:1067-1070.
[20] Swetter SM,Tsao H,Bichakjian CK,et al. Guidelines of care for the management of primary cutaneous melanoma [J]. J Am Acad Dermatol,2019,80(1):208-250.
(收稿日期:2019-06-05 本文編辑:任 念)
