艾滋病相关肺部卡波西肉瘤的临床与CT表现
2019-10-19王艳宋玉霞邓江玲赵瑞阳
王艳,宋玉霞,邓江玲,赵瑞阳
1.新疆维吾尔自治区第六人民医院放射科,新疆乌鲁木齐 830001;2.新疆维吾尔自治区第六人民医院感染一科,新疆乌鲁木齐830001;3.石河子大学,新疆石河子 832003; *通讯作者 宋玉霞 .grksyx@sina.com
卡波西肉瘤(Kaposi sarcoma,KS)是一种全身多发性的血管肉瘤样病变,起源于血管内皮及周皮细胞,由Moritz Kaposi首次描述,分布地区以东欧、地中海和撒哈拉非洲较多,在我国常见于新疆地区[1-3]。KS作为艾滋病的定义恶性肿瘤,通常累及淋巴结、皮肤、胃肠道甚至骨骼,而侵袭肺部病例较少[4]。目前关于国内艾滋病相关KS的肺部影像学表现报道病例数较少,患者多为中青年;同时涉及的肺部KS情况较为单一。临床工作中,因艾滋病患者免疫力低下,肺部KS表现为多种形态,并可伴有肺部其他感染,临床及影像诊断较复杂。本研究回顾性分析46例艾滋病相关KS患者的肺部CT表现,以提高对本病的认知。
1 资料与方法
1.1 研究对象 回顾性分析 2015年 1月—2018年12月新疆维吾尔自治区第六人民医院经病理确诊为艾滋病相关KS的46例患者,其中男37例,女9例;年龄3~72岁,平均(39.83±11.98)岁。HIV感染途径:性行为传播35例,静脉注射传播10例,母婴垂直传播1例。临床症状包括发热,咳嗽咳痰,乏力,全身皮疹,颈部、腋窝或腹股沟区淋巴结肿大及口腔肿物等。CD4+T淋巴细胞计数3~1713个/μl。
1.2 诊断标准 46例患者抗人免疫缺陷病毒(human immunodeficiency virus,HIV)抗体初筛和确证试验均呈阳性,艾滋病诊断均符合中国艾滋病诊疗指南(2018年版)的诊断标准[5]。KS诊断:HE染色见梭形细胞及增生的血管和(或)免疫组化CD31、CD34、人类疱疹病毒-8型(human herpes virus 8,HHV-8)阳性确诊。
1.3 CT图像分析及分型依据 所有病例的肺部 CT资料均以首次发现KS阶段的图像进行收集,并由2位高年资影像诊断专业的主治医师分别进行分析,意见不一致时经上级医师进一步确认,确定KS的肺部影像分型。影像学分析指标包括:①肺内病变:支气管血管束增粗型(支气管血管束边缘光整、扭曲变形、增粗);结节型(边缘光整或不光整,<3 cm);肺炎样渗出型(以斑片状渗出为主,边缘不光整,可融合成片)。②伴随症状:淋巴结肿大(横径>1 cm);胸腔积液(单/双侧);心包积液;皮下脂肪水肿。③骨转移。④合并其他病变。
依据KS肺部不同CT表现分为以下类型,①支气管血管束(支气管、血管及周围结缔组织)增粗型:即 KS仅侵犯支气管血管束内壁,而无周围肺叶病变,临床症状可表现为呼吸困难、顽固性干咳[4];②结节型:即KS在侵犯肺间质基础上伴有细胞增生呈结节状改变;③肺炎样渗出型:即KS在侵犯肺间质基础上伴周围炎性渗出,可融合成片状实变,边缘模糊,也有文献报道病变边缘模糊通常提示出血[6-7]。
1.4 仪器与方法 通过东软64层螺旋CT行肺部螺旋扫描。所有患者均行胸部CT平扫,取仰卧位,头先进,扫描范围由肺尖至肺底,螺旋容积数据扫描,成人管电压120 kV,管电流100 mA;儿童管电压100 kV,管电流80 mA。扫描原始图像层厚5 mm,重建层厚1 mm。
2 结果
2.1 病理与临床特征 46例KS患者中,45例行皮肤活检确诊KS,35例行内镜检查确诊消化道KS,3例分别行颈部、腋窝及腹股沟区淋巴结活检确诊KS,5例行支气管镜活检确诊KS;2例合并肋骨、脊柱骨转移,2例合并肺结核,3例合并支气管感染。化疗后复查33例,其中吸收好转23例、进展8例、化疗前后病变相仿2例。
2.2 CT表现 本组5例(10.9%)患者表现为支气管血管束增粗型,CT图像仅表现为肺支气管血管束增粗(图1)。19例(41.3%)患者表现为结节型,其中12例表现为结节边界清晰,大小相对均等(直径<3 cm),早期散在分布,后期多呈双肺对称均匀分布(图2);7例表现为边界不清晰的结节状改变(图3)。22例(47.8%)患者表现为肺炎样渗出型,CT图像表现为边界模糊的“火焰状”或斑片状改变,亦可融合实变,病变多对称分布,少数不对称分布(图4)。3种类型患者KS肺部CT表现均以双侧肺门为起始,支气管血管束及小叶间隔明显增粗,且病变沿支气管血管束侧旁分布。
2.3 KS伴发症状 本组患者淋巴结肿大33例[颈部、纵隔、腋窝和(或)双肺门区],胸腔积液25例(左、右侧各4例,双侧17例),心包积液9例,皮下水肿11例。
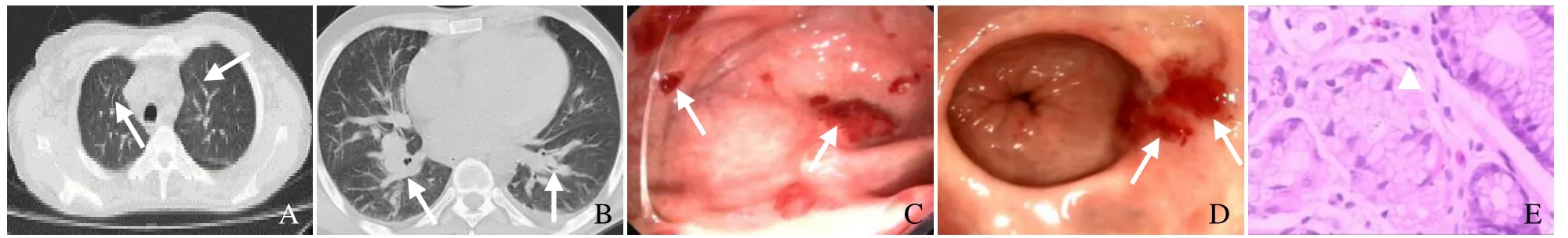
图1 男,50岁,肺部、皮肤及消化道KS。肺部CT表现为小叶间隔及支气管血管束明显增粗(箭),双侧胸腔少量积液,双侧腋窝多发肿大淋巴结(A、B);支气管镜及胃镜显示黏膜多发红色斑丘疹,表面毛细血管丰富(箭,C、D);幽门前弯病理活检KS(箭头,HE,×40,E)
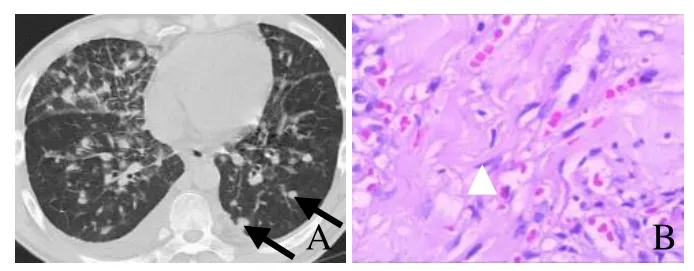
图2 男,30岁,多器官KS,脊柱及肋骨多发转移。CT表现为沿增粗的肺间质旁多发境界清晰的结节,双侧胸腔少量积液(箭,A);皮肤病理活检KS(箭头,HE,×40,B)
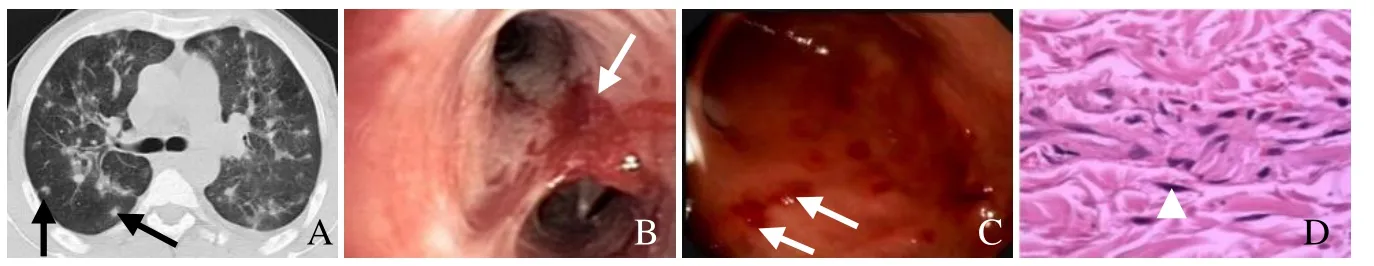
图3 男,43岁,肺部、皮肤及消化道KS。CT表现为沿增粗的肺间质旁多发境界不清晰的结节(箭,A);支气管镜及胃镜显示黏膜多发红色斑丘疹,表面毛细血管丰富(箭,B、C);皮肤病理活检KS(箭头,HE,×40,D)
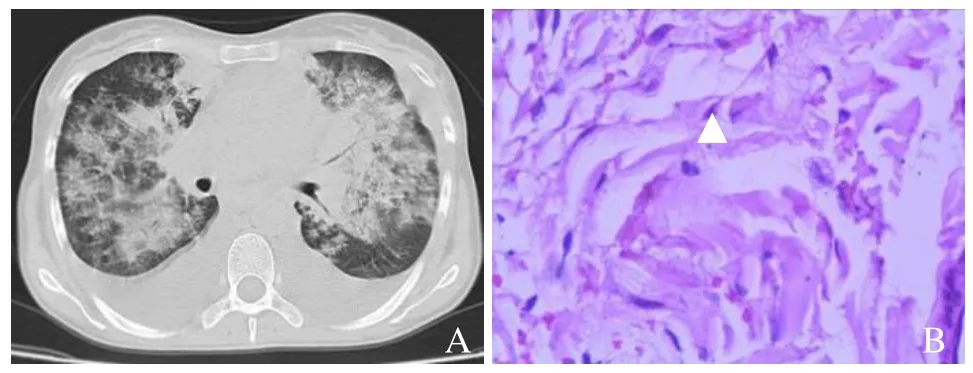
图4 女,31岁,肺部、皮肤KS。CT表现为沿增粗的肺间质旁多发分布的斑片状及“火焰状”渗出影,病变趋于融合,左侧局部实变,双侧胸腔少量积液(A);皮肤病理活检KS(箭头,HE,×40,B)
3 讨论
HIV感染人群肿瘤的发生率明显增高[8],其原因为HIV人群机体免疫处于缺陷状态,从而使促肿瘤生成的病毒逃过免疫监控,诱发肿瘤形成[9]。Radu等[10]报道KS的发生与感染HHV-8密切相关;Zhou等[11]报道HIV tat蛋白能够促进HHV-8的直接传播。上述研究结论证实KS的发生与HHV-8、HIV病毒共感染密切相关。KS病变多首发于四肢,多为皮肤病变,皮损主要表现为暗红色或紫黑色丘疹斑块[12]。本组患者侵犯肺部亦不少见。临床上,患者常出现慢性咳嗽、发热、咯血、胸闷、呼吸困难;血气分析显示氧分压降低,CD4计数可正常,亦可明显降低,单纯依靠临床症状及实验室检查诊断KS困难[13]。支气管镜活检或肺穿刺可确诊;但其为有创操作,且受限于患者身体状况,即使进行支气管镜检查也可因取材因素影响诊断。KS的病理组织学表现为新生血管形成,炎症细胞浸润和细胞增生,晚期斑片状肿瘤灶内见梭形细胞,存在于胶原束带和炎性浸润中,其演变过程从早期(斑块期)黄斑转为斑块(斑块期),并发展为更大的结节(肿瘤期)[10]。
CT检查简单易行、无创。艾滋病相关肺部KS的CT表现具有特征性,并与其病理组织学改变密切相关;本研究将肺部KS的CT图像概括分为3种类型,即支气管血管束增粗型、结节型及肺炎样渗出型,有利于提高对本病的认识。临床上,KS患者的CT表现可以其中某一种类型为主,也可以多种类型并存[14]。KS本质上是一种肿瘤性病变,也可引起其他部位转移、侵犯及伴随症状,包括颈部、纵隔、腋窝和(或)双肺门区淋巴结肿大、胸腔积液、心包积液、骨质破坏转移及皮下水肿等改变。既往有文献报道KS在CT图像上主要表现为支气管血管束增粗,结节灶分布于支气管血管束周围[15-16]。结节边缘显著不规则呈“火焰”样,病变倾向于双侧对称分布,小叶间隔增厚呈“蚁足”样,可伴肺部实变,考虑由肿瘤的侵犯、出血或阻塞性肺炎形成[17]。胸腔积液及心包积液多见,颈部、肺门、腋窝及纵隔淋巴结多发肿大[18]。本组KS患者的CT表现与文献报道部分一致,并在此基础上进一步分型,有利于提高对艾滋病相关肺部KS的认识。
除KS外,另一种常见的艾滋病相关肺部肿瘤是非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL),两者均表现为侵犯肺间质,肺内多发结节影或斑片状渗出,多发淋巴结肿大,鉴别困难;但NHL结节多较大,形态规整,边界清,内见支气管及血管穿行[19]。肺部感染包括肺部非特异性感染及特异性感染。KS渗出的CT图像改变多在肺间质增粗的基础上出现病变对称分布;但在KS合并多重感染时,临床医师需密切结合临床症状及实验室检查进行鉴别。
本组肺部 KS病例较多,但行支气管镜活检病理数量少,缺少肺穿刺活检病理结果。肺部 KS化疗后 CT复查图像信息相对完整,但缺乏与之相对应的支气管镜下 KS资料,这也是今后进一步研究的方向。
总之,KS可发生于患者任何免疫状态下器官的任何部位,其中侵犯肺部发生率较高。KS肺部CT图像以倾向于支气管血管束周围对称生长为特征,影像学表现可分为3种类型。临床工作中当艾滋病患者在抗感染治疗肺部病变仍表现进展,特别是在伴随有皮肤、消化道损伤的情况下,应考虑KS的可能。
