锑矿区土壤中锑氧化菌的分离鉴定及其特性
2019-10-18杨春燕李军军
花 莉,杨春燕,吴 川,李军军
(1.陕西科技大学 环境科学与工程学院,陕西 西安 710021;2.河南省栾川县自然资源局,河南 栾川 471500)
0 引言
锑(Sb)位于元素周期表第五周期第ⅤA族,Sb在自然条件下以较低的浓度广泛分布于水体以及土壤.近几年锑的工业用量不断上升,导致了锑向人类生活环境不断扩散[1].锑及其化合物在1979年就已经被国际环境保护组织列为重要污染物,并被美国环境保护局列为优先控制污染物[2].根据世界健康组织的规定,饮用水中的锑浓度不得超过5μg/L[3].我国《重金属污染综合防治“十二五”规划》中把锑列为主要控制污染物之一,根据我国《锡、锑、汞工业污染物排放标准》(GB30770-2014)规定,锑在工业排污过程中不得超过1.0 mg/L[4].
锑在自然界中的存在形式以辉锑矿(Sb2S3)为主,常见价态为Sb(Ⅲ)和Sb(Ⅴ),Sb(Ⅲ)毒性害高于Sb(Ⅴ).有研究报道,Sb(Ⅲ)毒性是Sb(Ⅴ)毒性的十倍[5].Paul Westerhoff等[6]和Maher[7]研究发现,水体中的锑同时具有急性与慢性毒理效应,短时间接触会造成人体恶心,呕吐等症状,长期接触可能会引起人体的角膜炎、结膜炎和胃炎等病症.我国锑矿储量位居世界第一,锑产量约占世界总量的79.6%[8].在中国湖南冷水江,因为锑矿分布较多,被称为世界锑都,此外,在贵州和广西等省份也有比较集中的锑矿分布[9].近年来由于人类对锑矿的开采,冶炼以及运输也对当地造成了锑污染[10],严重影响了当地的土壤环境.
目前,Sb污染土壤的修复方法包括生物氧化、植物修复、生物修复和吸附等.研究发现,自然界中存在部分植物,原生生物,藻类以及微生物可以通过自身作用氧化Sb(Ⅲ),污染地区的Sb(Ⅲ)可以通过锑氧化细菌转化为毒性较小的Sb(Ⅴ),从而达到对锑的解毒,减轻锑对周围动植物的毒害作用,改善周围动植物的生存条件[11].Lialikova[12]首次报道了一株锑氧化细菌,该菌株能够把 Sb(Ⅲ)氧化成 Sb(Ⅴ),并为自身提供能量.微生物的氧化作用被认为是一种锑污染环境潜在的修复方法.这些微生物在整个锑的地球循环过程中发挥着重要作用.近年来,对Sb(Ⅲ)氧化菌的发现已有报道,Li等[13]从锡矿山分离得到了 6 株具有Sb(Ⅲ)氧化能力的菌,这些菌株表现出不同的Sb(Ⅲ)氧化能力.Hamamura等[14]从日本锑矿区分离到了 3 株具有Sb(Ⅲ)氧化能力的菌株,经过鉴定属于α-和γ-变形菌门.然而,由于对于锑氧化微生物的研究开展得相对较晚,目前报道的锑氧化微生物的种类相对较少.微生物对于锑的代谢机制具有一定的多样性.截止目前,完整的锑氧化酶系统还没有被鉴定得到.为了尽快开展对锑氧化酶的深入探索,急需从不同锑污染样品中分离纯化得到多株高效锑氧化菌,以全面揭示锑氧化微生物的氧化机制,从而利用微生物修复锑污染土壤.
基于此,本研究采用湖南锑矿区的锑污染土壤,为分离更多种不同的锑氧化菌,并探究这些锑氧化菌氧化效率和最佳生长条件,为完善锑氧化酶系统以及利用微生物修复锑污染土壤技术的推广应用提供更多的理论依据.
1 实验部分
1.1 锑污染土壤的收集与处理
锑污染土壤取自于湖南冷水江锑矿区(27 °43′08.60″N,111 °27′08.66″E),采用无菌袋密封运输,在实验室内风干并剔除植物残体以及其他杂物,研磨并过2 mm筛使用.土壤的pH/Eh采用1∶10土水比,pH计(Sartorius pH 10,中国)测定;电导率(EC)采用1∶5土水比,电导仪(YP220,中国)测[15].土壤的阳离子交换量(CEC)的测定方法参考(NIAST,2000)[16],有效磷(P)含量的测定采用国标法NY/T 1121.7-2014.土壤Sb、As、Pb、Zn、Cu总含量采用浓硝酸-氢氟酸电热板消解法,将Guo等[17]的测定方法改进,具体方法:称取0.25 g土样于加消解管中,加入10 mL浓硝酸,4 mL氢氟酸泡酸过夜,于电热消解仪(DigiBlock ED54,LabTech)中120 ℃下消解1 h,150 ℃消解2 h(该过程中间断摇匀消解管),175 ℃赶酸至1 mL,冷却后用1%的硝酸冲洗,转移并定容,用0.45μm的滤膜过滤后,采用电感耦合等离子体发射光谱仪(ICP-OES,ICAP6000 Radial,Thermo,英国)测定土壤中重金属总含量.
土壤的理化性质如表1所示.供试土壤中锑含量高达220.97 mg·kg-1,已达到重度污染级别.

表1 锑污染土壤基本理化性质
1.2 耐锑细菌的分离及其氧化性的鉴定
用于细菌分离的培养基CDM[18](MgSO4·7H2O,2.0 g;NH4Cl,1.0 g;Na2SO4,1.0 g;K2HPO4,0.013 g;CaCl2·2H2O,0.067 g;Na-lactate,5.0 g;琼脂,15.0 g;蒸馏水1 000 mL;pH7.2),其中酒石酸锑钾([C8H4K2O12Sb2·3(H2O)])最终浓度为100μmol·L-1,培养基经过1×105Pa 灭菌20 min后,用于分离耐锑细菌.
具体分离方法:取1 g孵化的土壤到9 mL 0.85%的NaCl 溶液中,30 ℃,180 r·min-1,震荡30 min,采用连续稀释的方法在CDM-A固体培养基涂布培养1周,挑取单菌落划线纯化培养1周,分离出耐锑的纯菌株.对于耐锑菌株的锑氧化性鉴定,挑取纯化后的单菌株在无菌条件下接种到装有10 mL已灭菌的CDM-A液体培养基的试管中,在30 ℃,180 r·min-1条件下连续震荡培养10 d,10 d后取9 mL菌液用0.22μm水系滤膜过滤细菌后,加入1mL 1% APDC溶液(吡咯烷二硫代氨基甲铵),摇匀,震荡10 min后,滤过C-18固相萃取小柱.由于APDC与Sb(Ⅲ)生成络合物,无法通过萃取小柱,被氧化的Sb(Ⅴ)无法与APDC络合,可以通过萃取小柱.以不加菌的培养基作为空白对照,因此用ICP-OES测定滤液中Sb的含量,该含量与空白的差值即为被氧化的Sb(Ⅲ)含量,即生成的Sb(Ⅴ)的量[1].
1.3 锑氧化菌的系统发育鉴定
将分离的纯菌株在LB培养基中培养之后进行16sPCR扩增,16s引物序列为:27F(5-AGAGTTTGATCCTGGCTCAG-3)and 1492R(5-GGTTACCTTGTTACGACTT-3),扩增产物送至上海生物工程有限公司测序进行菌种鉴定[13].
1.4 锑氧化菌的形貌特征分析
取液体或固体培养基中培养20 h左右、旺盛生长的菌体.
(1)收集菌体:①液体培养基中的菌体,取10 mL培养液8 000 rpm离心3~5 min,弃上清液,倒入2.5%戊二醛固定液;②固体培养基上的菌体,在菌落表面滴几滴戊二醛固定液,轻刮菌落.将菌液吸入离心管,离心后换入新鲜戊二醛固定.
(2)固定、脱水,按常规方法进行:2.5%戊二醛,磷酸缓冲液清洗3次-乙醇梯度脱水,30%,50%,70%,85%,95%各一次,100%乙醇2次,15~20 min/次-乙酸异戊酯置换2次,20 min/次.将样品进行冷冻干燥处理.干燥后的样品进行离子溅射仪喷镀后,透射电子显微镜(美国FEI,FEI Tecnai G2 F20 S-TWIN)观察、拍照[19,20].
1.5 锑氧化菌的氧化效率及生长特性
将具有氧化性的单菌落挑在100 mL LB液体培养基中,28 ℃,180 r·min-1振荡培养至对数期,将菌液在6 000 g下离心5 min后用PBS溶液洗涤两次,将OD600调到1.取1 mL菌液接种到200 mL的CDM-A培养基中,28 ℃,180 r·min-1振荡培养10 d,前24 h每隔2 h取一次样,随后每隔12 h取一次样测OD值(用96孔板测,每个样只需要200 uL),同时每2 d取样采用1.2中氧化性鉴定的方法测定生成的Sb(Ⅴ)浓度(每次需要取10 mL).试验均设置三个平行.
1.6 锑氧化菌最佳生长条件测定
根据氧化效率结果,选择氧化效率最强的菌株,采用正交试验考察温度,pH,盐度以及锑浓度对该菌株生长的影响并研究其最佳生长条件.用于试验的CDM-A培养基除锑含量以及盐分浓度变化外,其余各组分保持一致,并按照正交试验安排调整培养基pH.将具有氧化性的单菌落先挑在100 mL LB液体培养基中,28 ℃,180 r·min-1振荡培养至对数期(OD600=0.4~0.5左右),将菌液在6 000 g下离心5 min后用PBS溶液洗涤两次,将OD600调到1.取1 mL菌液接种到50 mL的CDM-A培养基中,按照正交试验安排调整试验温度,在180 r·min-1振荡培养24 h后测定OD值.试验均设置三个平行,同时做不加菌的空白[21-23].
2 结果与讨论
2.1 耐锑细菌的分离及其锑氧化性的鉴定
本研究从锑污染土壤中分离了8株耐锑细菌,对8株细菌进行氧化性鉴定,结果如图1所示.8株耐锑细菌均表现出一定的氧化能力,且ZH1、ZH2、ZH3、ZH4、ZH6表现出了较强的氧化能力,ZH4的氧化能力显著较高(p<0.01).在自然界中,锑的氧化是一个极其缓慢的过程[24],而在微生物的作用下,锑的氧化速率明显提高[25].此类微生物的存在,有利于促进锑从低价态往高价态转变,从而降低其环境风险.
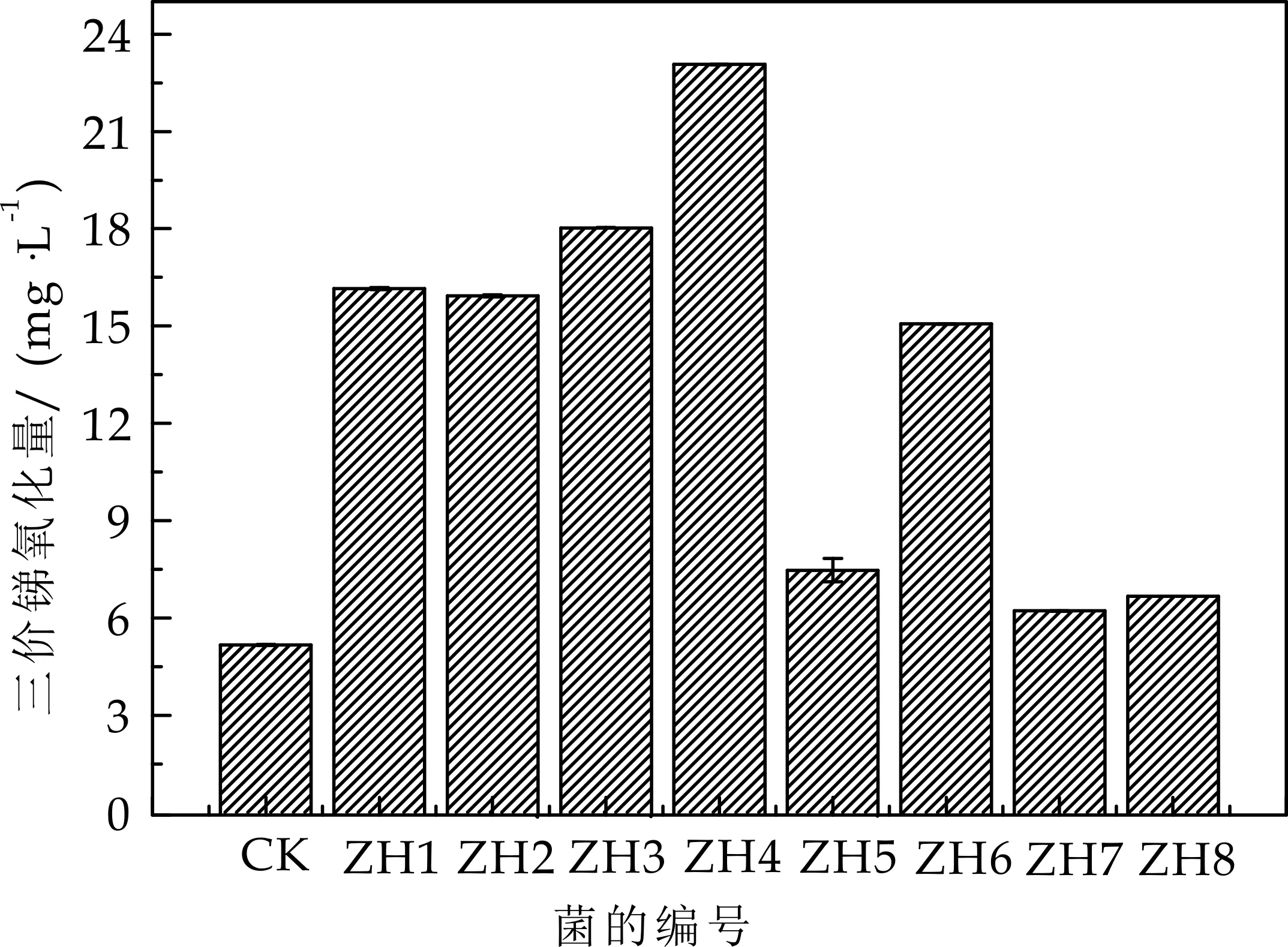
图1 耐锑细菌锑氧化性能力测定
2.2 锑氧化菌的微观形态及系统发育鉴定
对Sb矿区土壤进行Sb氧化菌的分离筛选,从Sb浓度为200 umol·L-1的CDM-A培养基中分离筛选出8株耐Sb的细菌.对菌进行氧化性鉴定之后发现有6株具有氧化性.菌株ZH1(如图2所示)属于假单胞菌属,该菌株为杆状,菌落呈乳白色,圆形,表面凸起.菌株ZH2属于假单胞菌属,该菌株为球状,菌落不规则形状,皱纹,干燥.ZH3为不动杆菌属,该菌株为杆状,菌落为圆形,边缘湿润,黄色.ZH4为假单胞菌属,该菌株球状,表面有褶皱,菌落较干燥,贴合培养基不易脱落,淡黄色.ZH6为贪铜菌属,该菌株为杆状,菌落呈圆形,光滑,湿润.其中前四株菌的基因测序序列上传NCBI数据库并获取ACCESSION No.分别为SUB5682247 ZH1 MK990007,SUB5682247 ZH2 MK990008,SUB5682247 ZH3 MK990009,SUB5682247 ZH4 MK990010.

(a)菌株ZH1 (b)菌株ZH2

(c)菌株ZH3 (d)菌株ZH4

(e)菌株ZH6图2 氧化菌株的电镜照片
将分离的耐锑细菌的16s rRNA基因序列经过BLAST比对发现,分离的菌株与已发表的模式菌株的相似度达99%~100%.菌株ZH1,ZH2,ZH4,ZH5属于假单胞菌属(Pseudomonas)(最大相似度99%~100%),菌株ZH3,ZH7,ZH8属于不动杆菌属(Acinetobacter)(最大相似度99%~100%),菌株ZH6属于贪铜菌属(Cupriavidus)(最大相似度100%)(如图3所示).因此该土壤中锑氧化菌主要是假单胞菌属(P-seudomonas)和不动杆菌属(Acinetobacter).这与Shi等[11]的研究结果一致.Shi 等从中国采集了11种不同的矿物样品(富含Sb/Cu等),分离得到了100多株耐锑和耐铜菌,其中36株具有Sb(Ⅲ)氧化能力,这些菌株主要来自于假单胞菌属(Pseudomonas)、丛毛单胞菌属(Comamonas)和不动杆菌属(A-cinetobacter).
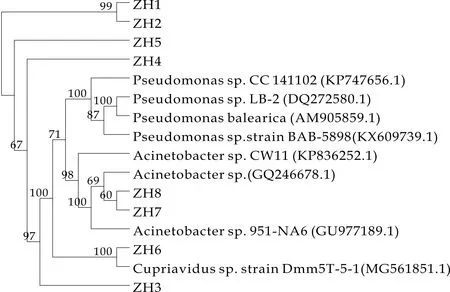
图3 基于16S rRNA基因序列Neighbor-Joining法构建的系统发育树
2.3 锑氧化菌的氧化效率以及生长曲线
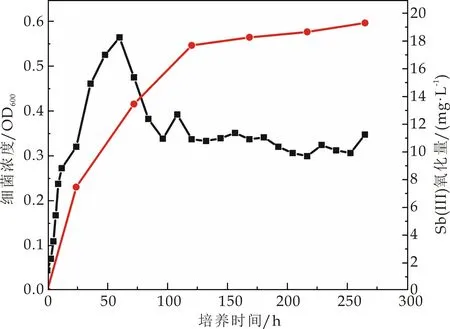
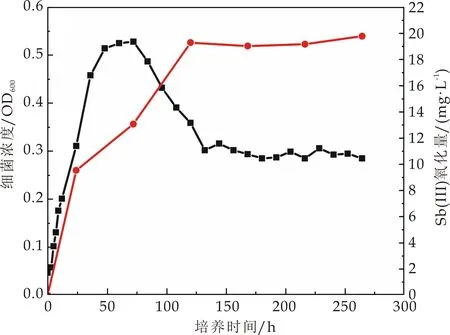
选择氧化能力较强的ZH1、ZH2、ZH3、ZH4、ZH6进行氧化效率及生长测定.5株锑氧化菌的氧化效率如图4(a)~(e)所示,5株菌均表现出良好的三价锑氧化能力,其中ZH1、ZH2和ZH6号菌在培养的第10天能氧化超过60%的三价锑,ZH3号菌在培养的第10天氧化超过70%的三价锑,而ZH4号菌能在培养的第10天氧化培养基中95%的三价锑.这与Nguyen V K等[1]的研究结果相似.Van等共分离出8株锑氧化菌,培养基所含三价锑浓度为100μmol·L-1,8株菌的氧化性在35.8%以上,其中氧化效率最高的菌Cupriavidus sp.NL4在21天内可氧化掉98.7%的锑.此外,在Li等[13]分离得到的锑氧化菌中,Comamonas spp.S44和JL40,能在3~5天后氧化50 mmol·L-1Sb(Ⅲ).
由此可知,相比于已有的研究分离的锑氧化菌,本研究中所分离出来的几种锑氧化菌均可在10 d内达到60%甚至95%的氧化能力.此外本研究分离菌所用土壤,除了锑浓度较高之外,Pb、Zn、Cu的含量也严重超标(表1),说明这些菌株在复合重金属污染土壤中的耐受性较强,其应用范围更加广泛.
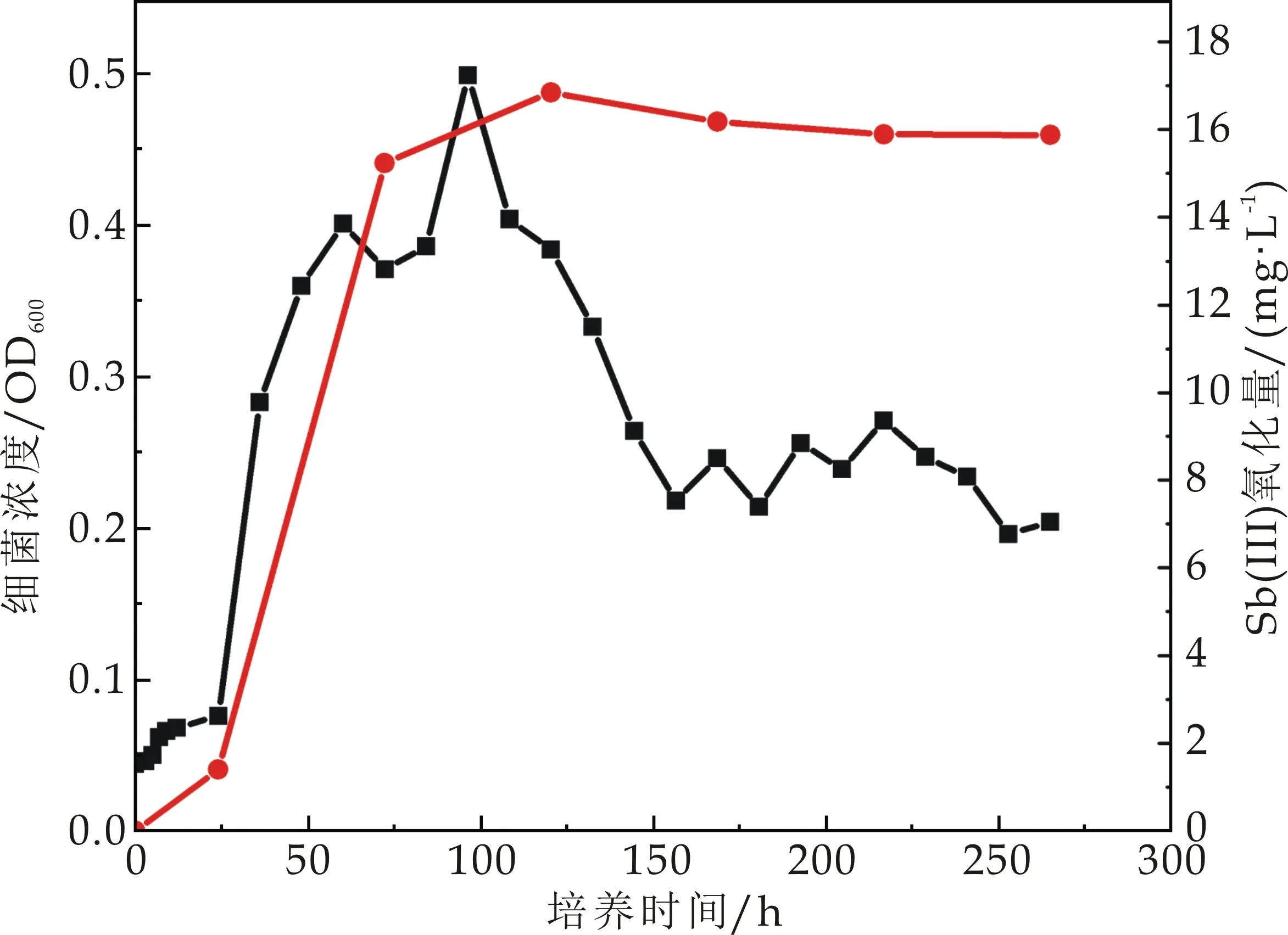
(a)菌株ZH1
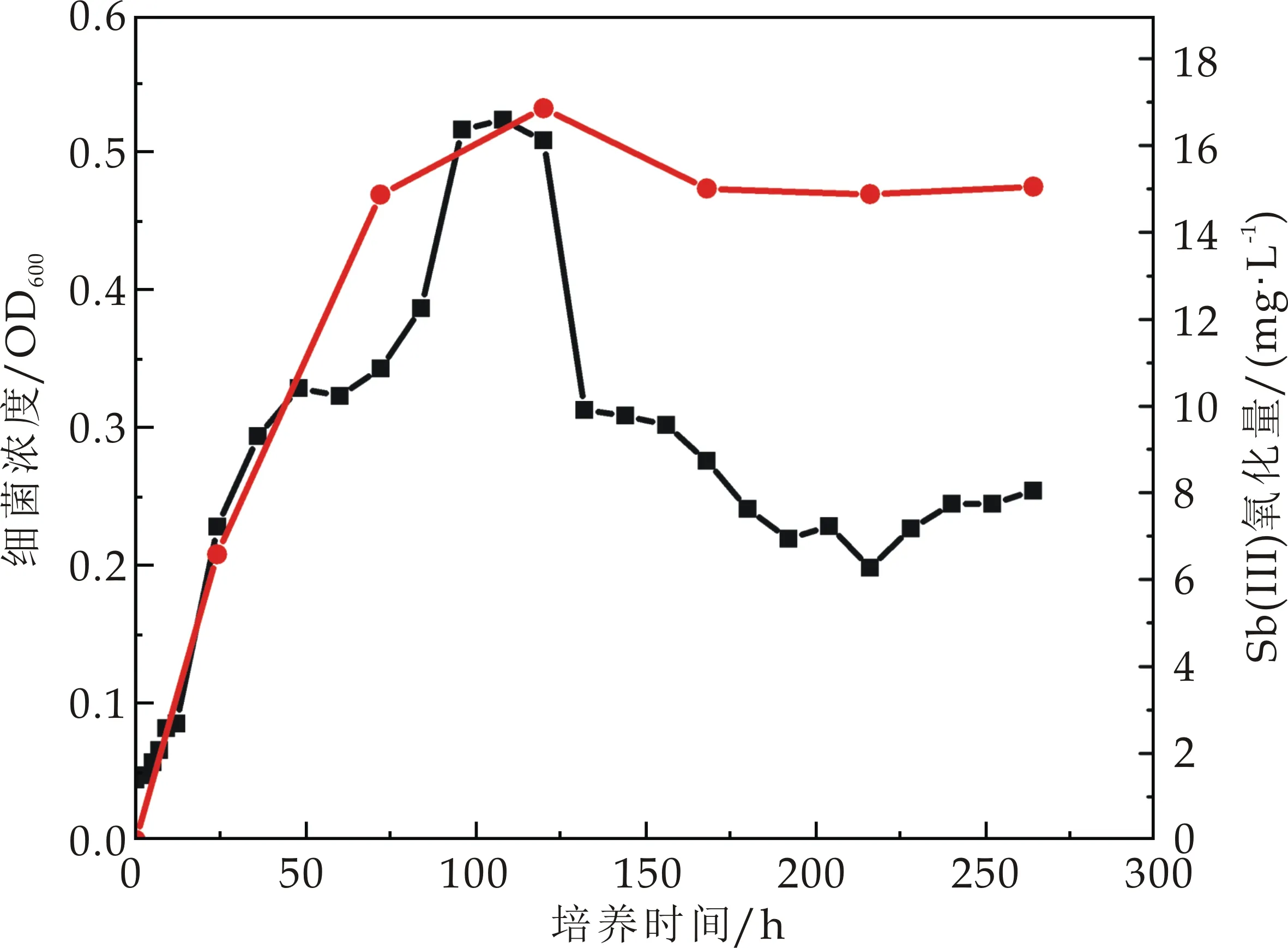
(b)菌株ZH2
(c)菌株ZH3
(d)菌株ZH4
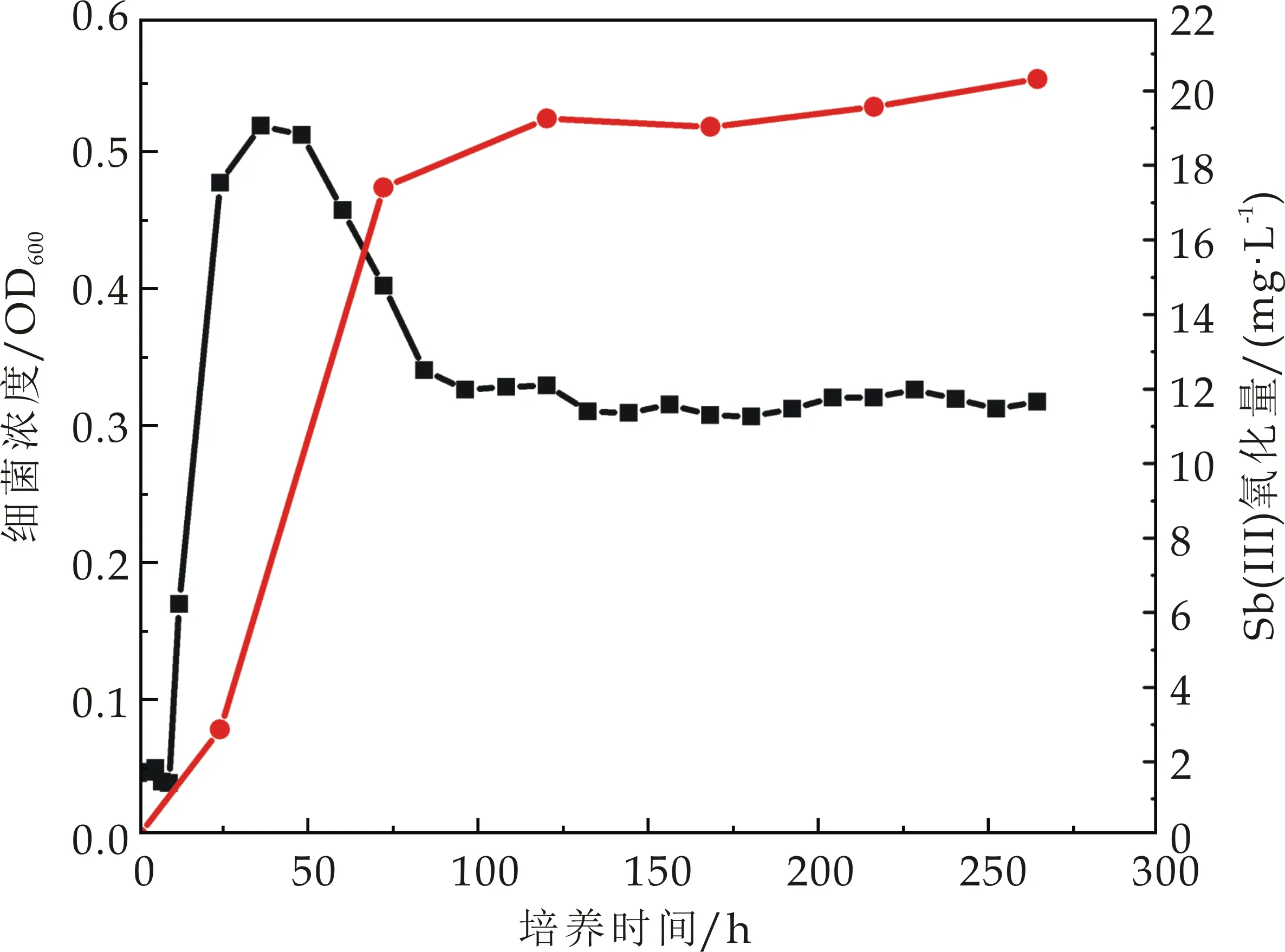
(e)菌株ZH6图4 不同锑氧化菌氧化曲线和生长曲线(图中红线代表三价锑氧化曲线;黑线代表生长曲线)
5株菌生长曲线结果显示,不同菌株达到对数生长期所用的时间不同.ZH1、ZH2生长到96 h左右OD600分别达到0.5 mg/L,0.54 mg/L.ZH3、ZH4在72 h左右OD600分别达到0.58 mg/L,0.53 mg/L.ZH6在36 h左右OD600达到0.54 mg/L.在实际的锑氧化菌运用中,应明确不同锑氧化菌生长周期,使得其在生长对数期发挥最大的氧化效率.
2.4 锑氧化菌最佳生长条件测定
选择氧化性最强的ZH4进行最佳生长条件的测定,采用正交试验考察温度、pH、锑浓度以及盐度对ZH4生长的影响.正交试验结果如表2所示.由极差分析,可以得出主要因子为盐度以及温度,次要因子为锑浓度和pH;最佳水平组合为A3B2C2D1,即ZH4在温度为28 ℃,pH为5.2,锑浓度为50μmol·L-1,盐度为1%条件下生长,其OD600达到最高,说明该条件适合该菌株的生长,通过Design-Expert 8.06 Trial 对因子数据进行进一步分析,得到该菌株菌体个数和生长条件的函数公式如下:
OD600=
0.118 91-0.136 19*A+0.074 801*B+
6.112 91×10-4*C+0.143 9*D
(1)
式(1)中:A代表温度,B代表pH,C代表锑浓度,D代表盐度.
该条件适合该菌株的生长,但其他条件下的氧化效率,还有待进一步的实验研究.刘成佐等[26]发现,从锑矿区受污染的土壤中筛选的菌株对碱性环境最为敏感,适宜生长的pH在6.5左右.其次是温度,适宜温度为25 ℃左右.适宜的培养基锑质量浓度为300μg·mL-1,锑质量浓度过高会对菌株有一定抑制作用;聂孝红等[27]的研究中4株细菌的生长对pH和渗透压变化的响应也存在差异,不同的菌株对pH和渗透压条件要求不同.
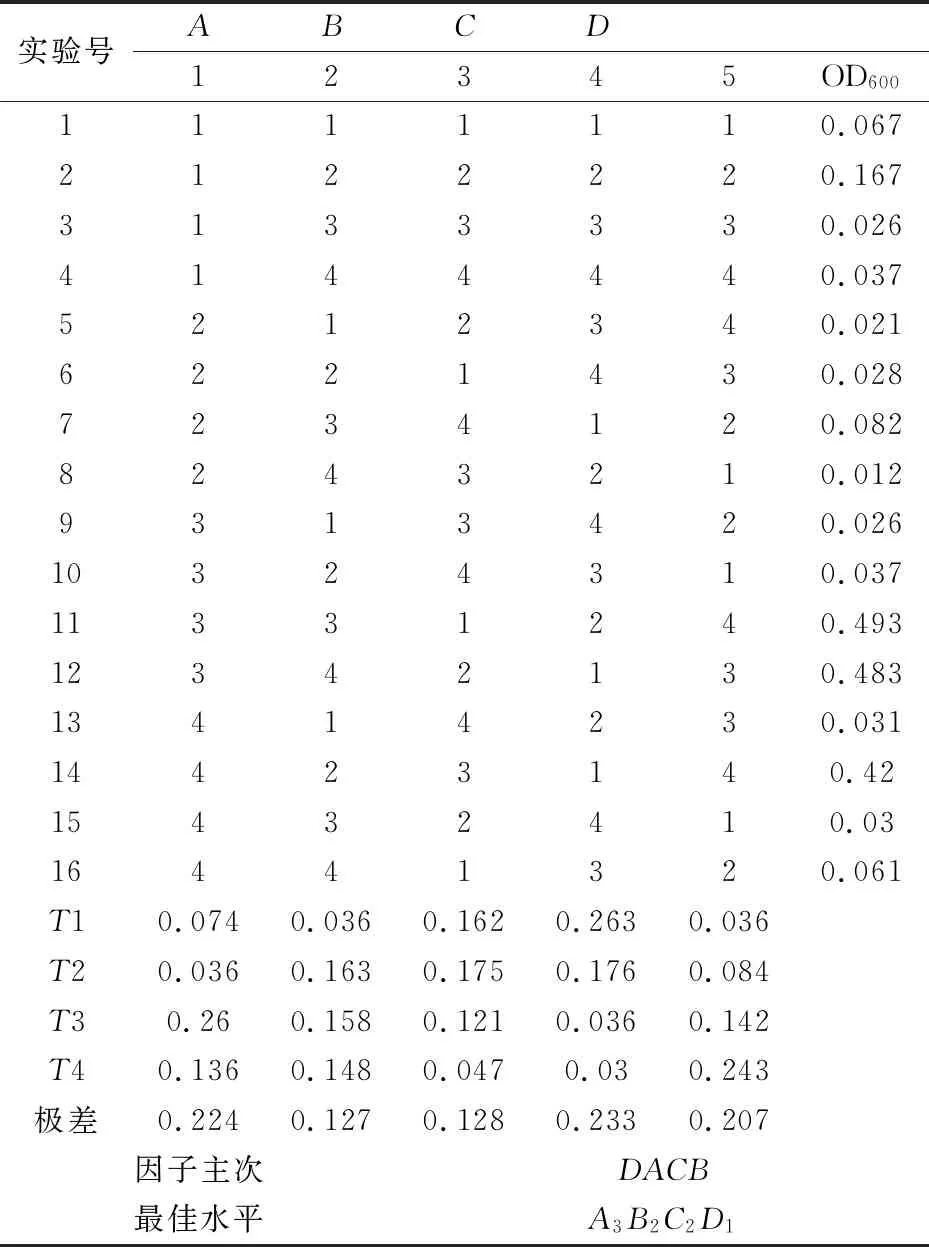
表2 正交试验表 L16(45)
3 结论
本研究从锑矿区土壤中分离筛选出8株耐锑菌,其中有5株菌均表现出了较强的氧化能力,分离的锑氧化菌主要属于假单胞菌属(Pseudomonas)和不动杆菌属(Acinetobacter),不同的锑氧化菌其形态存在差异.其中ZH4的氧化性最强,ZH3、ZH4、ZH6的氧化效率较高,且不同的菌株表现出不同的生长特性,且在常规的自然条件下便能很好的繁殖,为微生物修复锑污染提供了良好的菌种资源,可以作为较好的试验材料应用于生物修复Sb污染土壤的研究.
