WNT1、β-catenin、PD-L1蛋白在上皮性卵巢浆液性癌中的表达及临床意义
2019-10-17杨尊敬杜先玲
杨尊敬,杜先玲
恩施自治州中心医院肿瘤科,湖北 恩施445000
卵巢浆液性癌是临床常见的妇科恶性肿瘤之一[1],其预后较差,短期内肿瘤病情进展速度较快,患者的总体生存时间较短[2]。在揭示卵巢浆液性癌发病机制的过程中发现,肿瘤相关信号转导通路的改变、免疫调节紊乱等,均可影响肿瘤细胞的生物学特征,促进肿瘤细胞的免疫逃逸,进而导致卵巢上皮性恶性肿瘤的发生、发展[3]。无翅型MMTV整合位点家族成员1(wingless-type MMTV integration site family member 1,WNT1)/β-联蛋白(β-catenin)信号通路是一种重要的保守性信号通路,该通路相关信号蛋白的激活,能够通过促进肿瘤细胞的增殖及上皮细胞的异常分化,影响肿瘤细胞的上皮-间充质转换过程,进而促进肿瘤细胞的浸润和转移[4-5]。程序性死亡受体配体1(programmed cell death 1 ligand 1,PDCD1LG1,也称PD-L1)是 B7家族共刺激分子配体,能够抑制T淋巴细胞的免疫功能,促进肿瘤细胞免疫逃逸[6]。为了揭示WNT1、β-catenin、PD-L1的表达与卵巢浆液性癌的关系,为临床上卵巢浆液性癌的诊疗提供参考,本研究对上皮性卵巢浆液性癌患者WNT1、β-catenin、PD-L1的表达水平及其与患者临床特征的关系进行分析,现报道如下。
1 对象与方法
1.1 研究对象
选取2013年1月至2017年10月于恩施自治州中心医院肿瘤科住院并行手术治疗的上皮性卵巢浆液性癌患者200例,并收集患者的卵巢浆液性癌组织。纳入标准:经常规病理检查确诊为上皮性卵巢浆液性癌。排除标准:①术前接受放疗、化疗等抗肿瘤治疗者;②合并其他部位肿瘤者;③肝肾功能严重不全者;④患有自身免疫性疾病者;⑤凝血功能障碍者。另外,选取同时期于恩施自治州中心医院因子宫肌瘤行子宫切除术及附件切除术的患者120例,并选取经病理检查确诊的正常卵巢组织为对照。上皮性卵巢浆液性癌患者的年龄为38~70岁,平均年龄(55.3±11.9)岁;国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期:Ⅰ~Ⅱ期59例,Ⅲ~Ⅳ期141例;分化程度:高分化78例,低分化122例。子宫肌瘤患者的年龄为36~69岁,平均年龄(54.1±10.8)岁。本研究经医院伦理委员会审核通过,所有患者及家属均对本研究知情同意并签署知情同意书。
1.2 检测方法
选取卵巢浆液性癌组织和正常卵巢组织,大小约为0.5 cm×0.5 cm×0.5 cm,常规制作石蜡切片,采用免疫组化链霉菌抗生物素蛋白-过氧化物酶连结法(streptavidin-perosidase,SP)检测不同组织中WNT1、β-catenin、PD-L1蛋白的表达情况。具体方法:采用石蜡进行连续性切片,脱蜡至水后采用H2O2室温下孵育10 min,磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗3次,每次3~5 min,8%蛋白粉封闭液封闭2 h,弃去封闭液后加入一抗[兔来源,1∶(1000~1500)],4℃冰箱过夜,PBS冲洗3次,每次3~5 min,加入二抗[鼠来源,1∶(400~500)],室温孵育20~30 min,PBS冲洗3次,每次3~5 min,加入辣根过氧化物酶或碱性磷酸酶的标记物,室温孵育10 min,PBS冲洗3次,每次3~5 min,滴加二氨基联苯胺显色,复染、脱水、封片。
1.3 判定标准
以细胞膜内出现棕黄色颗粒为阳性染色,根据阳性细胞所占比例和着色强度进行半定量判定。根据着色强度判定:不着色为0分,浅黄色为1分,黄棕色为2分,棕褐色为3分。根据阳性细胞所占比例判定:选择5~10个高倍视野,计算1000个细胞中阳性细胞所占比例,阳性细胞所占比例<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。将着色强度评分和阳性细胞所占比例评分相加,0~1分为阴性(-),2分为弱阳性(+),3~4分为强阳性(++),5~7分为极强阳性(+++)。阳性率=(弱阳性+强阳性+极强阳性)例数/总例数×100%。
1.4 统计学方法
采用SPSS 22.0统计软件对数据进行分析。计量资料以均数±标准差(±s)表示;计数资料以例数和率(%)表示,组间比较采用χ2检验;等级资料比较采用Mann-Whitney秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 不同组织中WNT1、β-catenin、PD-L1蛋白表达情况的比较
卵巢浆液性癌组织与正常卵巢组织中WNT1、β-catenin、PD-L1蛋白的表达情况比较,差异均有统计学意义(Z=10.698、12.397、9.450,P<0.01)。卵巢浆液性癌组织中WNT1、β-catenin、PD-L1蛋白的阳性表达率分别为94.00%(188/200)、97.50%(195/200)、84.50%(169/200),均明显高于正常卵巢组织的73.33%(88/120)、69.17%(83/120)、45.83%(55/120),差异均有统计学意义(χ2=27.011、52.803、53.397,P<0.01)。(表1)

表1 卵巢浆液性癌组织与正常卵巢组织中WNT1、β-catenin、PD-L1蛋白的表达情况[n(%)]*
2.2 卵巢浆液性癌组织中WNT 1蛋白表达与上皮性卵巢浆液性癌患者临床特征的关系
不同FIGO分期上皮性卵巢浆液性癌患者卵巢浆液性癌组织中WNT1蛋白的表达情况比较,差异有统计学意义(Z=5.250,P<0.01);FIGO分期为Ⅲ~Ⅳ期上皮性卵巢浆液性癌患者卵巢浆液性癌组织中WNT1蛋白的阳性表达率为98.58%(139/141),明显高于FIGO分期为Ⅰ~Ⅱ期患者的83.05%(49/59),差异有统计学意义(χ2=17.789,P<0.01)。不同分化程度上皮性卵巢浆液性癌患者卵巢浆液性癌组织中WNT1蛋白的表达情况比较,差异无统计学意义(P>0.05)。(表2)

表2 不同临床特征上皮性卵巢浆液性癌患者卵巢浆液性癌组织中WNT1蛋白的表达情况(n=200)
2.3 卵巢浆液性癌组织中 β-catenin蛋白表达与上皮性卵巢浆液性癌患者临床特征的关系
不同FIGO分期、分化程度上皮性卵巢浆液性癌患者卵巢浆液性癌组织中β-catenin蛋白的表达情况比较,差异均有统计学意义(Z=2.363、3.309,P<0.05)。FIGO分期为Ⅲ~Ⅳ期上皮性卵巢浆液性癌患者卵巢浆液性癌组织中β-catenin蛋白的阳性表达率为99.29%(140/141),高于FIGO分期为Ⅰ~Ⅱ期患者的93.22%(55/59),差异有统计学意义(χ2=6.288,P=0.012);低分化上皮性卵巢浆液性癌患者卵巢浆液性癌组织中β-catenin蛋白的阳性表达率为97.54%(119/122),与高分化患者的97.44%(76/78)比较,差异无统计学意义(χ2=0.002,P=0.963)。(表3)
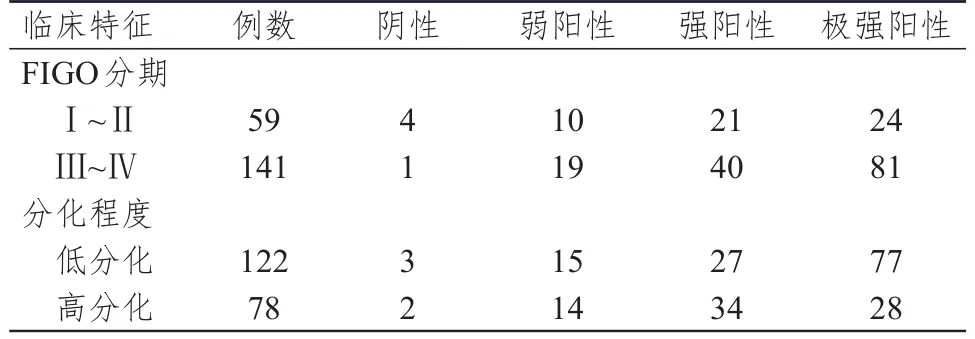
表3 不同临床特征上皮性卵巢浆液性癌患者卵巢浆液性癌组织中 β-catenin蛋白的表达情况(n=200)
2.4 卵巢浆液性癌组织中PD-L 1蛋白表达与上皮性卵巢浆液性癌患者临床特征的关系
不同FIGO分期、分化程度上皮性卵巢浆液性癌患者卵巢浆液性癌组织中PD-L1蛋白的表达情况比较,差异均有统计学意义(Z=3.963、2.534,P<0.05)。FIGO分期为Ⅲ~Ⅳ期上皮性卵巢浆液性癌患者卵巢浆液性癌组织中PD-L1蛋白的阳性表达率为90.78%(128/141),明显高于FIGO分期为Ⅰ~Ⅱ期患者的69.49%(41/59),差异有统计学意义(χ2=14.393,P<0.01);低分化上皮性卵巢浆液性癌患者卵巢浆液性癌组织中PD-L1蛋白的阳性表达率为86.89%(106/122),与高分化患者的80.77%(63/78)比较,差异无统计学意义(χ2=0.386,P=0.538)。(表4)
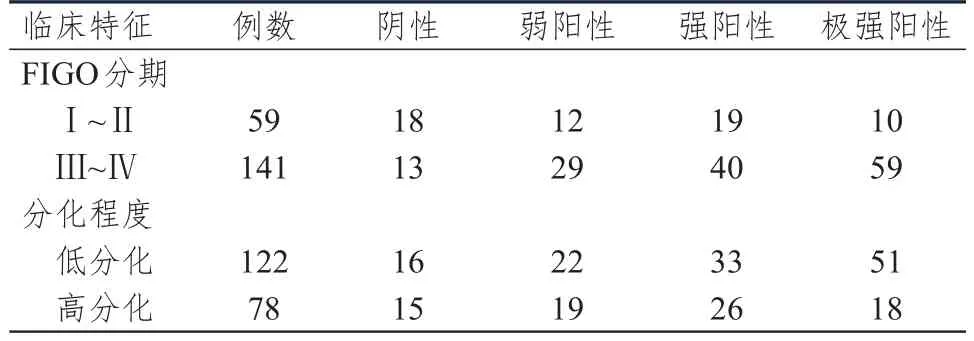
表4 不同临床特征上皮性卵巢浆液性癌患者卵巢浆液性癌组织中PD-L 1蛋白的表达情况(n=200)
3 讨论
卵巢浆液性癌占所有类型卵巢上皮性恶性肿瘤的25%以上[7-9]。免疫靶向治疗在卵巢恶性肿瘤的治疗过程中发挥着重要作用,因而本研究对上皮性卵巢浆液性癌患者体内不同肿瘤相关蛋白表达情况进行分析,旨在揭示卵巢浆液性癌的生物学进展机制,为临床上卵巢浆液性癌患者免疫靶向治疗中靶点的选择提供参考。
WNT1、β-catenin为 WNT1/β-catenin信号通路上的效应分子,WNT1/β-catenin信号通路的激活能够上调WNT1、β-catenin蛋白的表达,提高肿瘤细胞的持续性自我扩增的速度。相关研究表明,WNT1、β-catenin蛋白表达上调,能够提高卵巢肿瘤细胞的变形能力及对临近正常盆腔脏器组织的浸润和黏附能力,进而促进卵巢浆液性癌的转移[10];PD-L1是共刺激分子家族成员,其与淋巴细胞膜表面Fas配体结合,可以显著抑制T淋巴细胞的活化,降低抗原呈递细胞的抗原体呈递功能,降低CD4+T淋巴细胞的免疫应答水平,进而促进肿瘤细胞的免疫逃逸。相关研究显示,PD-L1的表达不仅能够参与卵巢肿瘤患者的免疫抑制过程,同时还能够降低肿瘤细胞核DNA的错配修复能力,导致癌基因异常突变风险的显著上升[11]。部分研究者探讨了WNT1、β-catenin在卵巢浆液性癌患者中的表达情况,认为WNT1、β-catenin表达水平升高与卵巢癌的发生密切相关[10],但缺乏对于卵巢浆液性癌这一特定肿瘤类型的具体分析,同时对于PDL1的分析探讨仍然不足。
本研究结果显示,卵巢浆液性癌组织中WNT1、β-catenin、PD-L1蛋白的阳性表达率均明显高于正常卵巢组织,差异均有统计学意义(P<0.01),提示WNT1、β-catenin、PD-L1蛋白均可能参与卵巢浆液性癌的发生过程。究其原因可能主要与WNT1、β-catenin、PD-L1蛋白的下列两个方面的作用有关[12-13]:①WNT1、β-catenin蛋白表达水平升高能够促进相关信号通路的激活,促进肿瘤细胞的持续性扩增;②PD-L1蛋白表达上调,能够通过促进肿瘤细胞分泌抑制性免疫分子转化生长因子-β,降低自然杀伤性T淋巴细胞的活性,抑制其对肿瘤细胞的杀伤和吞噬效果,从而保护肿瘤细胞的增殖和侵袭过程。李杉等[14]研究认为,在部分卵巢浆液性癌患者病灶组织中,β-catenin蛋白的阳性表达率可平均上升40%以上,特别是在特殊类型如浆液性腺癌或乳头状癌患者中,β-catenin的表达水平上升更为明显;免疫组化结果显示,WNT1、β-catenin主要表达于肿瘤细胞膜周边,而PD-L1主要表达于肿瘤细胞间质中,推测这主要由于WNT1、β-catenin能够影响到肿瘤细胞细胞膜上相关受体的激活,而PD-L1主要通过影响肿瘤细胞间免疫抑制因子的表达等有关。本研究在探讨WNT1、β-catenin、PD-L1蛋白表达与卵巢浆液性癌患者临床特征的关系中发现,FIGO分期为Ⅲ~Ⅳ期上皮性卵巢浆液性癌患者卵巢浆液性癌组织中WNT1、β-catenin、PD-L1蛋白的阳性表达率均高于FIGO分期为Ⅰ~Ⅱ期患者,差异均有统计学意义,提示WNT1、β-catenin、PD-L1蛋白表达水平增高与上皮性卵巢浆液性癌患者的病情进展密切相关,这主要由于相关指标的上升,能够提高肿瘤细胞的浸润能力,促进肿瘤细胞对远处器官的侵袭。
综上所述,在卵巢浆液性癌患者中,WNT1、β-catenin、PD-L1蛋白的表达水平均升高,而且其表达水平与上皮性卵巢浆液性癌患者的临床分期密切相关。
