A1BG、ATⅢ、VN作为原发性肝癌标志物的应用价值研究
2019-10-17贾志伟邢贺楠翁艳刘晓川
贾志伟,邢贺楠,翁艳,刘晓川
1应急总医院(煤炭总医院)消化内科,北京100029
2北京和睦家医院内镜室,北京1000160
原发性肝癌是临床常见的消化系统恶性肿瘤, 病情进展较快,多数患者就诊时已处于晚期。目前,手术切除术为原发性肝癌的主要治疗方法,但是绝大多数原发性肝癌患者由于未能及时确诊而错失了手术治疗的最佳时机,因此,早期诊断对于原发性肝癌患者的预后具有重要的意义[1]。临床上,甲胎蛋白(α-fetoprotein,AFP)是肝癌的重要血清学指标,但是该指标也具有一定的局限性,尤其是AFP在肝硬化、肝炎患者血清中的水平也会升高,因此,寻找原发性肝癌更为特异性的标志物具有重要意义[2]。本研究探讨了α-1-B糖蛋白(alpha-1-B glycoprotein,A1BG)、抗凝血酶Ⅲ(antithrombin Ⅲ,ATⅢ)、玻连蛋白(vitronectin,VN)在肝癌中的表达情况及其单独或联合检测对肝癌的诊断价值,以期为临床诊疗提供参考依据,现报道如下。
1 对象与方法
1.1 研究对象
选取2017年1—12月应急总医院(煤炭总医院)收治的54例乙型病毒性肝炎(以下简称为乙肝)相关性原发性肝癌患者(肝癌组)、44例乙肝肝硬化患者(肝硬化组)、50例乙肝患者(肝炎组)。纳入标准:①经计算机体层摄影(computed tomography,CT)等影像学检查或病理学检查证实;②检测前未行放疗、化疗等抗肿瘤治疗;③年龄≥18岁。排除标准:①合并其他部位恶性肿瘤;②妊娠期或哺乳期妇女;③合并免疫系统疾病、血液系统疾病等。肝癌组中,男33例,女21例;年龄为33~69岁,平均年龄为(59.04±8.10)岁。肝硬化组中,男24例,女20例;年龄为30~72岁,平均年龄为(61.03±9.11)岁。肝炎组中,男30例,女20例;年龄为35~74岁,平均年龄为(60.82±9.55)岁。另选取同期体检的50例健康者为对照组,纳入标准:①未合并肝、肾等重要脏器疾病、免疫系统疾病等;②年龄≥18岁。排除标准:①合并其他部位恶性肿瘤;②妊娠期或哺乳期妇女。50例健康者中,男35例,女15例;年龄为20~68岁,平均年龄为(58.69±8.59)岁。4组受试者的性别、年龄比较,差异均无统计学意义(P>0.05),具有可比性。本研究经过医院医学伦理委员会审核批准,且患者均对本研究知情并签署知情同意书。
1.2 标本采集及检测方法
于患者入院后1周、健康者体检当天抽取全部受试者的清晨空腹外周静脉血3 ml于分离胶促凝管中,以3000 r/min离心30 min,分离上层血清后,置于-80°C冰箱中低温保存备用。采用酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)检测血清ATⅢ、VN水平,采用免疫比浊法测定A1BG浓度,所有试剂盒均购自浙江爱康生物科技有限公司,所有操作严格按照试剂盒操作说明书进行。
1.3 观察指标及评价标准
观察并比较各组受试者的血清A1BG、ATⅢ和VN水平以及不同分期肝癌患者的血清A1BG、ATⅢ和VN水平。A1BG的正常值为550~1400 mg/L,ATⅢ的正常值为230~350 mg/L,VN的正常值为3.125~200 ng/ml。三项指标联合检测时,以三项指标均出现阳性结果判定为阳性,有一项出现阴性结果则判定为阴性。以病理检查结果为“金标准”,采用受试者工作特征(receiver operating characteristic,ROC)曲线检测3种肿瘤标志物单独及联合诊断原发性肝癌的效能。
1.4 统计学方法
采用SPSS 19.0软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;A1BG、ATⅢ和VN联合检测对肝癌的诊断效能采用Logistic回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 4组受试者血清A1BG、ATⅢ和VN水平的比较
4组受试者的血清A1BG、ATⅢ和VN水平比较,差异均有统计学意义(P<0.05)。肝癌组患者的血清A1BG和VN水平均高于肝硬化组、肝炎组和对照组患者,ATⅢ水平低于肝硬化组、肝炎组和对照组患者,差异均有统计学意义(P<0.05)。肝硬化组患者的血清A1BG水平低于肝炎组,但高于对照组;肝硬化组患者的血清ATⅢ水平低于肝炎组和对照组,VN水平高于对照组,差异均有统计学意义(P<0.05);肝硬化组患者的血清VN水平与肝炎组比较,差异无统计学意义(P>0.05)。肝炎组患者血清中A1BG和VN水平均高于对照组,差异有统计学意义(P<0.05);肝炎组和对照组患者的血清ATⅢ水平比较,差异无统计学意义(P>0.05)。(表1)
表1 4组受试者的血清A1BG、ATⅢ和VN水平的比较(±s)
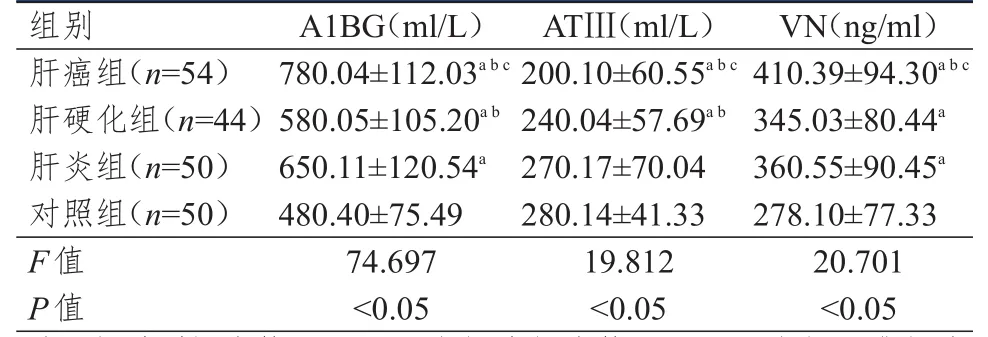
表1 4组受试者的血清A1BG、ATⅢ和VN水平的比较(±s)
注:a与对照组比较,P<0.05;b与肝炎组比较,P<0.05;c与肝硬化组比较,P<0.05
组别肝癌组(n=54)肝硬化组(n=44)肝炎组(n=50)对照组(n=50)F值P值780.04±112.03a b c 580.05±105.20a b 650.11±120.54a 480.40±75.49 74.697<0.05 200.10±60.55a b c 240.04±57.69a b 270.17±70.04 280.14±41.33 19.812<0.05 410.39±94.30a b c 345.03±80.44a 360.55±90.45a 278.10±77.33 20.701<0.05 A1BG(ml/L)ATⅢ(ml/L)VN(ng/ml)
2.2 不同分期肝癌患者血清 A 1BG、ATⅢ和VN水平的比较
不同分期肝癌患者的血清A1BG、ATⅢ水平比较,差异均有统计学意义(P<0.05);不同分期肝癌患者的血清VN水平比较,差异无统计学意义(P>0.05)。Ⅲ期肝癌患者的血清A1BG水平高于Ⅱ期和Ⅰ期肝癌患者,ATⅢ水平低于Ⅱ期和Ⅰ期肝癌患者,差异均有统计学意义(P<0.05)。Ⅱ期肝癌患者的血清A1BG水平高于Ⅰ期,ATⅢ水平低于Ⅰ期,差异均有统计学意义(P<0.05)。不同分期肝癌患者的VN水平组间两两比较,差异均无统计学意义(P>0.05)。(表2)
表2 不同分期肝癌患者血清A1BG、ATⅢ和VN水平的比较(±s)
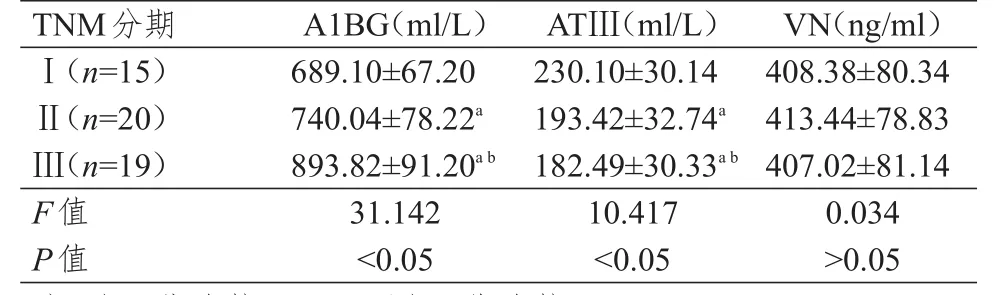
表2 不同分期肝癌患者血清A1BG、ATⅢ和VN水平的比较(±s)
注:a与Ⅰ期比较,P<0.05;b与Ⅱ期比较,P<0.05
A1BG(ml/L)ATⅢ(ml/L)VN(ng/ml)689.10±67.20 740.04±78.22a 893.82±91.20a b 31.142<0.05 230.10±30.14 193.42±32.74a 182.49±30.33a b 10.417<0.05 408.38±80.34 413.44±78.83 407.02±81.14 0.034>0.05Ⅰ(n=15)Ⅱ(n=20)Ⅲ(n=19)F值P值TNM分期
2.3 血清 A 1BG、ATⅢ和VN单独及联合检测对原发性肝癌的诊断价值
以A1BG、ATⅢ和VN检测值作为自变量,以病理诊断结果作为因变量进行Logistic回归分析,Logistic回归方程:Logit(P)=-7.902+0.011X1-0.019X2+0.010X3,其中,X1、X2和 X3分 别 代 表A1BG、ATⅢ和VN,最终得到A1BG、ATⅢ和VN三项联合诊断原发性肝癌的概率预测值(PRE_1)。将A1BG、ATⅢ和VN及三项联合诊断原发性肝癌的概率预测值进行ROC曲线分析结果显示,三者联合诊断原发性肝癌的曲线下面积最大,为0.934(95%CI:0.900~0.967),而 A1BG、ATⅢ和VN 三项指标单独检测的曲线下面积依次降低。(表3、图1)
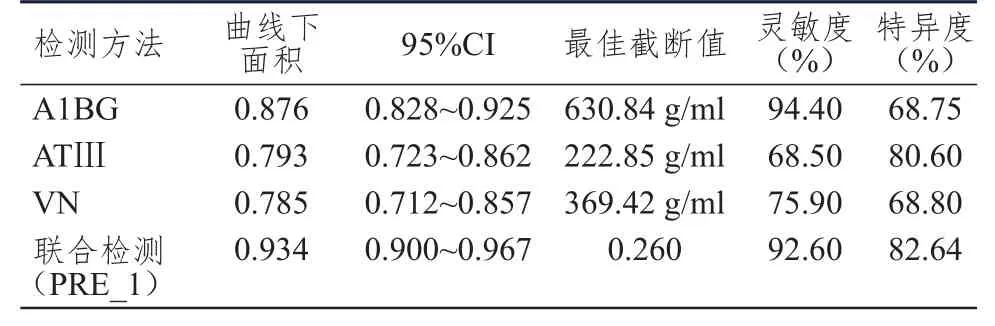
表3 血清 A 1BG、ATⅢ和VN单独及联合检测对原发性肝癌的诊断价值

图1 A1BG、ATⅢ和VN单独及联合诊断原发性肝癌的ROC曲线
3 讨论
原发性肝癌属于临床常见的消化系统恶性肿瘤,是目前世界范围内病死率极高的肿瘤之一,目前,中国原发性肝癌的发病率呈现逐渐升高的趋势,患者预后极差,有研究显示,原发性肝癌患者的5年生存率不足5%[3-4]。目前认为原发性肝癌的发生和发展是多因素、多阶段的过程,一般认为原发性肝癌主要是由乙肝病毒、丙肝病毒慢性感染或者黄曲霉毒素造成的肝硬化演变而成。目前,原发性肝癌的主要治疗手段为手术切除,但是由于原发性肝癌进展迅速,绝大部分患者就诊时已发展至晚期阶段,失去了最佳的治疗机会,因此早发现、早诊断、早治疗对于延长原发性肝癌患者的生存时间具有重要意义[5]。近年来,临床诊断肝癌的方式较多,如影像学检查等常用的检查方法可以明确肝癌的具体分期和分级,但是对于操作者的经验以及设备质量的依赖性较强,而且对于肿瘤直径<2 cm的病灶以及良恶性病灶的鉴别诊断也具有局限性。病理学检查是肝癌诊断的金标准,但是在部分患者中可能出现假阴性的现象,而且在操作的过程中也可能会发生肿瘤破裂从而存在播散种植的风险[6-7]。近年来,肿瘤标志物的检查在临床中的应用越来越广泛,其中,AFP是原发性肝癌诊断中应用最广泛的肿瘤标志物,但其诊断的灵敏度和特异度均较低,尤其是在肝炎、肝硬化患者的病情发生急剧恶化时,AFP水平也会明显升高,而且在妊娠或者炎性反应过程中,AFP也存在假阳性的结果,而在部分原发性肝癌患者中也存在AFP阴性或者灵敏度较低的情况,目前临床尚无更为可靠的血清标志物取代AFP在肝癌诊断中的地位[8]。近年来,对于恶性肿瘤的研究越来越多地集中在蛋白质水平,研究显示,一旦机体出现异常,体内的蛋白质会发生细微的变化,这对于疾病的发生具有重要的提示作用,尤其是在恶性肿瘤患者中伴随着多种蛋白质的表达发生异常,有学者认为恶性肿瘤也属于蛋白质缺陷性疾病,因此,寻找特异性的蛋白质指标对于原发性肝癌的诊断和治疗具有重要意义[9-10]。
本研究分析了原发性肝癌、肝炎、肝硬化以及健康人群体内多种蛋白质因子的变化情况,其中,A1BG属于免疫球蛋白超家族分子之一,是参与肝细胞再生过程的重要糖蛋白,其在肝炎、肝硬化和原发性肝癌中的水平呈现依次升高的趋势,但是对于其在恶性肿瘤中的作用机制仍有待进一步深入研究,但是其诊断原发性肝癌的特异度较低。本研究结果显示,A1BG诊断原发性肝癌的特异度仅为68.75%,因此,A1BG单独作为原发性肝癌的筛查指标仍需要慎重,而且对于肝炎患者而言,由于病毒刺激导致患者肝脏的代偿性再生能力增强,从而导致该项指标可能会出现代偿性升高,从而出现误诊或漏诊的现象[11-12]。ATⅢ又称肝素辅因子Ⅰ,是一种单链糖蛋白,主要在肝脏内合成,属于丝氨酸蛋白酶抑制物。研究发现,抗凝血酶与肝素结合是形成抗凝作用的关键环节,在肝素缺乏的情况下,抗凝血酶的作用减弱。抗凝血酶是凝血酶最重要的抑制物,正常情况下,循环血浆中几乎不存在肝素,但是在肝脏疾病中,抗凝血酶的活性降低,导致了肝细胞和内皮细胞均出现不同程度的损伤,原发性肝癌发生后由于肝脏受损,导致ATⅢ合成减少,恶性肿瘤组织发生崩解和坏死,会释放促凝血物质并破坏纤溶系统的平衡状态[13-14]。本研究发现,ATⅢ在原发性肝癌患者血清中的水平较低,其诊断原发性肝癌的灵敏度为68.50%,无法满足临床需求,考虑多数原发性肝癌患者合并基础类疾病,因此可能对该项指标产生影响,从而影响了其诊断效能。VN又称血清扩散因子,主要是由单链糖蛋白组成,一般存在于人体的血浆与细胞外基质中,通过与细胞表面的特异性受体结合从而促进内皮细胞的黏附,参与细胞外基质的构成与调控,在肿瘤细胞的迁移过程中起重要作用,其过度表达提示肿瘤的进展和细胞增殖过程[15]。本研究结果显示,肝癌组患者的血清A1BG和VN水平均高于肝硬化组、肝炎组和对照组患者,ATⅢ水平低于肝硬化组、肝炎组和对照组患者(P<0.05),说明A1BG和VN在肝癌中的水平较高,而ATⅢ水平较低。另外,本研究分析了不同分期肝癌患者的血清A1BG、ATⅢ和VN水平,结果显示,Ⅲ期肝癌患者的血清A1BG水平高于Ⅱ期和Ⅰ期肝癌患者,ATⅢ水平低于Ⅱ期和Ⅰ期肝癌患者(P<0.05)。Ⅱ期肝癌患者的血清A1BG水平高于Ⅰ期,ATⅢ水平低于Ⅰ期(P<0.05),说明随着肝癌分期的增加,患者的A1BG水平逐渐升高,而ATⅢ水平逐渐降低。在诊断肝癌的价值方面,通过Logistic回归分析发现,三项联合检测诊断肝癌的ROC曲线下面积为0.934,灵敏度为92.60%,特异度为82.64%,说明A1BG、ATⅢ和VN三者联合诊断肝癌具有较高的灵敏度和特异度,通过采用联合诊断的方法能够进一步提升对肝癌的诊断效能,有利于临床对肝癌的诊断。
综上所述,肝癌中血清A1BG和VN水平较高,而ATⅢ水平较低,三者联合检测对肝癌具有较高的诊断价值,值得临床应用。本研究的优势在于证实了A1BG、ATⅢ和VN三者联合检测在肝癌诊断中的临床应用价值,通过联合检测可以获得最大的诊断价值,提升对肝癌的诊断效果,但是本研究纳入患者数量有限,也未能对上述指标和AFP进行对比分析,可能存在一定的偏倚,因此还有待进一步深入论证分析。
