低温驯化对斑马鱼胚胎发育和mtDNA拷贝数的影响
2019-10-16冉皓宇陈良标
冉皓宇, 陈良标
(1. 海洋生物科学国际联合研究中心(上海海洋大学) 中国科学技术部, 上海 201306; 2. 水产种质资源发掘与利用教育部重点实验室(上海海洋大学), 上海 201306; 3. 水产科学国家级实验教学示范中心(上海海洋大学), 上海 201306)
水温是决定鱼类几乎所有生命活动的主要因素,影响鱼类的生长[1]、发育、繁殖、代谢以及地理分布[2]。和大多数变温动物一样,鱼类也可能会面临短时间内或者季节性的温度变化,如果水温的变化超过了其特定的热容差范围,会对鱼类造成不利的影响。自然条件下,长时间暴露在超出耐受范围的低温条件下,是大多数鱼类死亡的本质原因[3]。因此,研究鱼类应对低温刺激的能力对于鱼类的生存就显得至关重要。近年来有不少研究表明,温度驯化可以改变鱼类的生理活动和组织形态,进而去适应更低的温度。通过低温驯化的手段可以增强鱼类心脏收缩次数,抵消血液黏稠的压力[4],改变代谢酶活性和游泳速度[5],同时会导致心脏[6]和肌肉等组织发生重塑[7]。然而,我们所知道的驯化对鱼类的影响及其机制研究,主要对象都是幼年期或者成年期的动物,而长期的温度驯化对鱼类早期胚胎发育的影响则鲜有研究。
鱼类胚胎的早期发育过程非常复杂,包括了细胞分裂与分化、细胞运动、胚层形成和器官形成等生物过程[8]。在这个过程中涉及基因的表达,多种信号通路的协调互作。无论是在细胞层面还是在基因层面,该阶段的生物活动需要及时的能量供应[9]。线粒体是真核细胞进行氧化磷酸化的重要细胞器,合成ATP,为生命活动提供能量,同时在细胞凋亡和死亡过程中也发挥着重要的作用[10]。卵母细胞的受精和早期胚胎的发育潜力都受到线粒体数量的影响[11]。线粒体数量可以作为评价卵母细胞和早期胚胎质量的重要标志[12]。通过实时荧光定量PCR的方法对线粒体DNA(mtDNA)进行定量是测定线粒体数量的有效方法[13]。
在本研究中,我们选择模式生物斑马鱼进行驯化实验,构建斑马鱼低温驯化模型。正常情况下,斑马鱼发育温度为27 ℃左右,其所产的胚胎半致死温度(死亡率50%)为22 ℃,临界致死温度(死亡率100%)为20 ℃。通过对常温27 ℃发育至性成熟的斑马鱼进行22 ℃低温驯化,观察其胚胎的低温发育潜能和mtDNA含量的变化,进而探究在斑马鱼中,对亲本的驯化是否能使其早期胚胎发育产生相应的低温耐受性,并进一步探讨其早期胚胎发育的低温耐受性与线粒体数量之间的关系。
1 材料和方法
1.1 主要试剂和仪器
DNA抽提试剂盒(碧云天);琼脂糖凝胶回收试剂盒(OMEGA);质粒小提试剂盒(OMEGA);T-Vector pMD19 (Simple) (Takara);NanoDrop2000分光光度计(Thermo Fisher);实时荧光定量PCR仪(Bio-Rad)。
1.2 供试材料
本研究中的斑马鱼为 AB品系的野生型斑马鱼,来源于中国科学院遗传与发育生物学研究所, 饲养的最适宜水环境为27 ℃~28.5 ℃:培养水温为27 ℃,pH 7~8,盐度450~550 μS;通过自动光照系统控制光照周期,分别为明14 h、暗10 h。
1.3 方法
1.3.1 低温驯化斑马鱼
取来自于相同亲本,27 ℃正常孵化的6月龄野生型斑马鱼,均分为2组,每组中保证雌雄比例为1∶1。其中一组在27 ℃正常养殖,作为未驯化对照组,称为TE27(The temperature 27 ℃)。另一组,移入恒温培养箱中,以每小时1 ℃的速率,逐渐降温至22 ℃持续养殖,称为TA22(Acclimaion temperature 22 ℃)。持续养殖期间,每个培养箱中放置8个3 L的中型斑马鱼养殖缸,缸中含水量为2 L。每缸养殖8条斑马鱼,雌雄斑马鱼各4尾。每个缸中,分别加入充气石,保证水中的溶氧。每天早晚各过量投喂1次丰年虫,保证斑马鱼饱食。光暗比例为14 h∶10 h,每天8:00开启培养箱关照灯,22:00关闭培养箱关照灯。在晚上投喂3 h后,取27 ℃养殖斑马鱼的水体,使用冰块(循环水体-40 ℃冻结)调节水温至各个驯化温度(22 ℃及20 ℃)。在室温下,迅速给各个养殖缸换水,使用毛刷清除缸壁和缸底的残食和黏着物,保证水体新鲜,各项理化指标与TE27对照组一致。
1.3.2 繁殖及耐寒性统计
当驯化6个月后,将驯化组的斑马鱼TA22和未驯化对照组斑马鱼TE27,在其养殖温度下,以雌雄比例1∶1的比例配对放入繁殖缸中。次日8:00开启培养箱光照灯后0.5 h,使斑马鱼互相追逐、交配、产卵。产卵后10 min内,收集斑马鱼胚胎至10 cm培养皿中,使用养殖温度对应温度的E3培养基清洗后,在22 ℃和20 ℃发育,检测耐寒性并统计成活率。
1.3.3 DNA提取
于0 hpf(hour post-fertilization)、8 hpf、12 hpf和24 hpf 4个发育时期收集未驯化组TE27及驯化组TA22的胚胎并提取DNA(包含mtDNA)。两组均分别从3对亲鱼所产的胚胎中取样,其中0 hpf 100枚胚胎,8、12和24 hpf均为20枚胚胎。所提取的DNA溶于ddH20,琼脂糖凝胶电泳检测完整性,将浓度调至一致,-20℃保存备用。同时提取野生型斑马鱼基因组DNA,用于绝对定量标准品的制备。
1.3.4 PCR引物设计与合成
选择线粒体DNA上的mt-nd4,mt-cytb作为目的基因,单拷贝基因actb1作为对照。引物序列见表1。
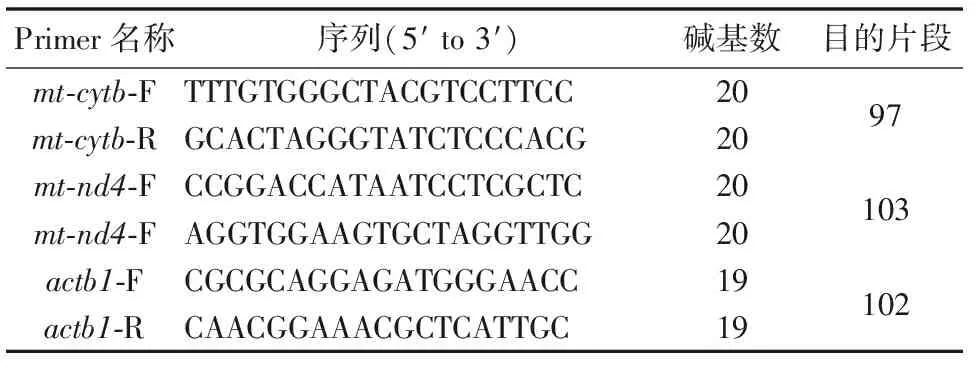
表1 引物序列
1.3.5 实时荧光PCR标准品的制备
以野生型斑马鱼总DNA为模板,通过PCR反应得到线粒体特有基因mt-nd4,mt-cytb以及单拷贝基因actb1的PCR产物。胶回收获取上述基因PCR纯化产物,通过T-Vector pMD19 (Simple)载体进行克隆。转化入感受态细胞后,37 ℃培养过夜,挑取阳性克隆,经PCR和DNA测序鉴定后,筛选出目的质粒。进行质粒小提并测定浓度。
1.3.6 mtDNA相关基因定量绝对定量
将获得的质粒等比例梯度稀释(10倍)获得6个梯度的标准品,并利用标准品绘制标准曲线。使用荧光定量PCR仪对mtDNA上的mt-nd4,mt-cytb基因以及单拷贝基因actb1进行定量。反应体系20 μL:SYBR Green mix 10 μL,胚胎DNA 1 μL,正向引物(10 μmol/L) 1 μL,反向引物(10 μmol/L) 1μL,ddH2O 7 μL)反应条件:95 ℃ 预变性5 min;95 ℃ 变性10 s, 60 ℃退火10 s, 72℃延伸30 s, 40个循环;溶解曲线95 ℃ 10 s,65 ℃~95 ℃ 0.5 ℃/s升温。
1.3.7 数据处理
所有数据均用平均值±标准差(x±s)表示,数据使用Excel 2013,GraphPad Prism 5,Bio-Rad CFX Manager分析和制图。拷贝数计算公式为:
DNA 拷贝数(copies/μL)=(6.02×1023)×(ng/μL×10-9) / (DNA碱基数×660)
单细胞中DNA拷贝数=mt-nd4/actb1
2 结果和分析
2.1 低温驯化组胚胎低温发育能力
如图1所示,将低温驯化组TA22斑马鱼所产的胚胎和未驯化组TE27斑马鱼胚胎放入22 ℃(半致死温度)发育至出膜,TA22斑马鱼所产的胚胎成活率约为90%,而TE27斑马鱼所产的胚胎成活率约为60%,二者差异明显(P<0.01)。同时将低温驯化组TA22斑马鱼所产的胚胎和未驯化组TE27斑马鱼胚胎放入20 ℃(临界致死温度)发育至出膜,TA22所产的胚胎可以在20 ℃存活,成活率约为50%而TE27斑马鱼胚胎全部死亡,成活率为0,二者差异显著(P<0.001)。结果证明,通过对亲本的长期低温驯化,其所产胚胎的低温发育能力增强,且可以突破正常温度发育斑马鱼的临界致死温度20 ℃。但随着发育温度的降低,胚胎发育至出膜的时间增加。如表2所示,发育至出膜的时间随着温度的降低而不断增加。

表2不同温度斑马鱼胚胎发育时间
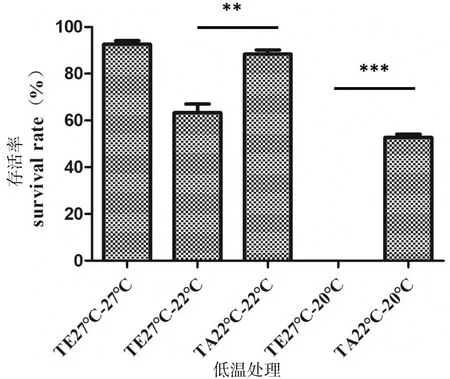
**:P<0.01,***:P<0.001
图1低温处理存活率统计
Figure 1 Low-temperature treatment survival
2.2 mtDNA拷贝数分析标准曲线
取用于制作标准曲线的目的质粒为模板,行荧光定量PCR得到标准曲线, 每个梯度(包括平行孔)均有特征性扩增曲线, 呈明显的S型; 根据104~109copies/μL标准品测得的荧光信号到达设定的域值时所经历的循环数(Ct)值绘制标准曲线。不同浓度标准定量的模板与Ct值呈直线相关,如图2-A所示mt-cytb标准曲线回归方程为y=-3.664x+45.314, 其中y为Ct值,x为质粒模板拷贝数以10为底的对数, 相关系数为0.999,变异系数为0.8%。如图2-B所示mt-nd4基因标准曲线回归方程为y=-3.615x+43.959, 其中y为Ct值,x为质粒模板拷贝数以10为底的对数,相关系数为0.999, 变异系数为1.6%。如图2-C所示,单拷贝基因组基因actb1标准曲线回归方程为y=-3.862x+43.959, 其中y为Ct值,x为质粒模板拷贝数以10为底的对数,相关系数为0.999, 变异系数为2.1%。
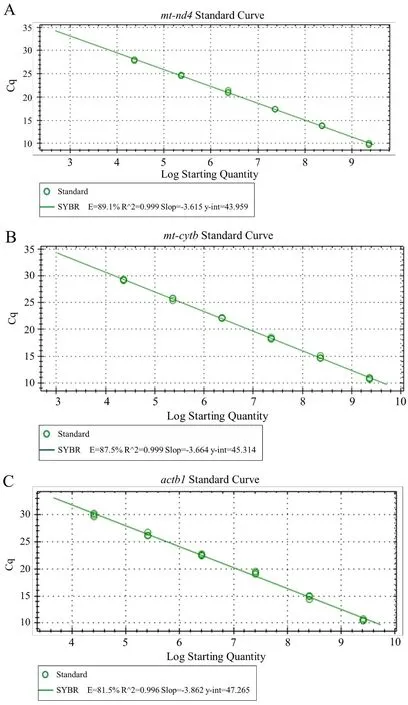
图2 标准曲线
2.3 斑马鱼0 hpf胚胎mtDNA数量
通过对TE27斑马鱼0 hpf胚胎和TA22斑马鱼0 hpf胚胎的mtDNA中2个不同的线粒体基因的定量发现(图3),TA22斑马鱼0 hpf胚胎mtDNA拷贝数约为2.43×104~2.83×104,而TE27斑马鱼0 hpf胚胎mtDNA拷贝数约为6.81×106~7.04×106,二者差异明显(P<0.001),TE27斑马鱼0 hpf胚胎mtDNA拷贝数约是TA22斑马鱼0 hpf胚胎的270倍。
2.4 斑马鱼胚胎线发育后期mtDNA数量
通过对TE27斑马鱼8 hpf、12 hpf和24 hpf胚胎和TA22斑马鱼8 hpf、12 hpf及24 hpf胚胎的mt-nd4基因的定量发现(图4),TE27斑马鱼8 hpf、12 hpf及24 hpf胚胎单个细胞中mt-nd4拷贝数平均值分别为453、243和150。TA22斑马鱼8 hpf、12 hpf及24 hpf胚胎单个细胞中mt-nd4拷贝数平均值分别为367、182和83。可见随着胚胎的不断分裂,胚胎中单个细胞的mtDNA拷贝数不断降低,代表着单个细胞中线粒体数量在不断减少。同时,TA22斑马鱼胚胎中mtDNA拷贝数仍小于TE27斑马鱼胚胎,虽然差异仍旧显著(P<0.001),但二者的数目逐渐接近。
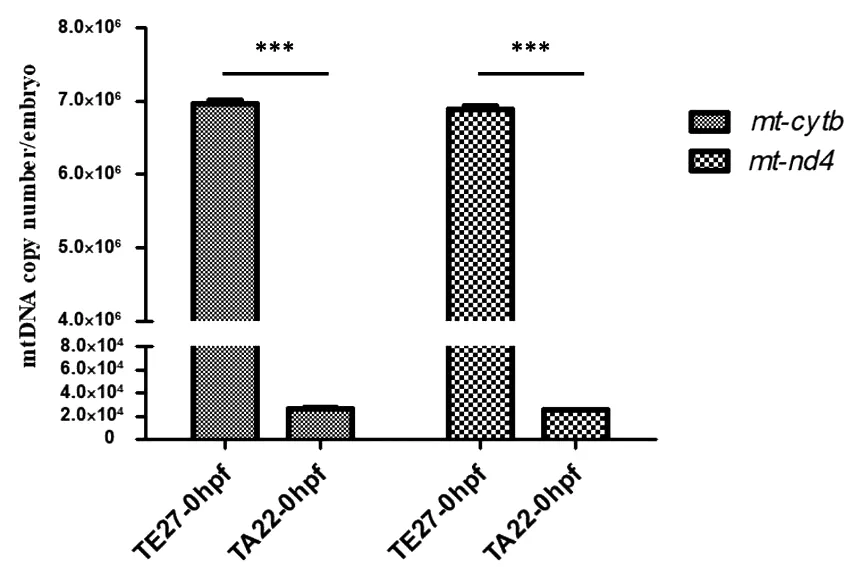
图3 斑马鱼0 hpf胚胎mtDNA拷贝数
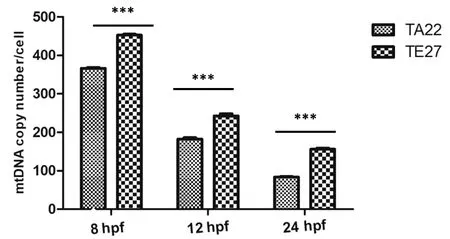
图4 斑马鱼胚胎发育后期mtDNA拷贝数
3 讨论与结论
本实验结果表明,对斑马鱼成鱼的低温驯化可以使其早期胚胎在低温下具有更好地发育能力。在低温下,驯化组斑马鱼早期胚胎的存活率与未驯化组斑马鱼早期胚胎相比显著增高,同时,驯化组斑马鱼胚胎可以突破未驯化组斑马鱼胚胎发育的临界致死温度。因此可以推测,温度驯化对于鱼类早期胚胎的发育过程具有重要影响,包括改变早期胚胎的低温耐受性,提高其低温存活率等。目前,低温驯化影响斑马鱼发育过程的具体机制尚不明确,本研究后续需要从分子水平上探究鱼类低温驯化以及低温耐受的调控网络。这为深入研究动物的进化以及生物体环境之间的关系提供了有价值的参考。
胚胎的发育能力与其线粒体的数量有着明显的关联,在合子基因尚未启动的胚胎发育早期,mtDNA不复制,胚胎的耗能主要依赖于卵母细胞所携带的线粒体,线粒体的数量和卵子发生以及胚胎发育阻滞有着密切的联系[14]。有研究表明,低水平的线粒体含量有助于卵母细胞的体外发育[15],在小鼠[16]和牛[17]的体外胚胎发育过程中的线粒体数目减少。在胚胎发育后期,随着合子基因的启动,跟线粒体复制和分裂相关的核基因的表达,使得线粒体数量不断增加,进而满足发育后期对能量的需求,使得胚胎能够继续生长。随着发育温度的降低,发育的时间不断延长,发育至合子基因启动的时间延长,但胚胎单位时间的耗能会随着减少,线粒体单位时间功能减少,相比于驯化组,未驯化组线粒体数量过剩。在南极鱼类的研究中发现,低温和酸化条件下线粒体具有一定的驯化潜能[18]。线粒体的功能可能在鱼类生长发育过程中对温度的适应至关重要。研究表明,低温会引起鱼类体内活性氧ROS(Reactive oxygen species)的相对增加,进一步引起线粒体损伤[19-20],同时线粒体也介导了细胞内氧化应激的产生[21]。低温也会引起细胞自噬并参与损伤线粒体的清除进而减弱细胞损伤[22]。驯化组胚胎在早期线粒体数量的减少,可能是胚胎发育早期能够耐受低温并发育的一个重要原因。
综上所述,低温驯化致使斑马鱼胚胎mtDNA拷贝数降低,代表着线粒体数量的减少。同时低温驯化也提高了斑马鱼胚胎的低温耐受性,但斑马鱼胚胎发育至出膜的时间延长。
