腾冲嗜热厌氧杆菌ahpC编码基因的克隆表达及生物信息学分析
2019-10-16郑航辉杨宇泽万学瑞
郑航辉, 高 昇, 杨宇泽, 吴 润, 万学瑞, 王 川, 刘 磊
(1. 甘肃农业大学 动物医学学院, 兰州 730070; 2. 北京市畜牧总站, 北京 100101)
腾冲嗜热厌氧杆菌MB4是1998年我国科学家从云南腾冲县的热泉里分离出的一株嗜热厌氧菌株,在50 ℃到80 ℃之间生长,最适生长温度是75 ℃[1],同时也是我国第一个完成全基因组测序和基因注释的原核微生物[2]。为什么嗜热菌可以在相对苛刻的条件下生长和繁殖?研究者从不同的角度对嗜热菌的嗜热机制进行了广泛而深入的探究,所涉及的方面包括嗜热菌的细胞膜的结构和流动性以适应高温[3-5]、蛋白质的热稳定性以及蛋白质对高温的适应[6-9]、酶的结构和功能及金属离子的保护作用等[10]。此外,截至2017年超过80株嗜热微生物的全基因组序列被发布,通过比较嗜热菌和常温细菌的生物学信息,分析嗜热机制也是一个研究方向,包括基因组的GC含量[11];氨基酸的组成和使用频率[12-13]等。虽然嗜热菌单一因素的嗜热机制被广泛研究,但由于细菌的生命活动在很大程度上是一个很复杂的分子网络,因此对嗜热微生物嗜热机制进行更广泛和深入地分析不仅有助于我们对原始地球环境的理解以及生物进化机制的研究,而且还能促进一些耐热蛋白、耐热酶等活性物质在工业、农业和医药等领域的应用。
AhpC是一种硫氧还原蛋白依赖的烷基过氧化氢还原酶,能够还原有毒的氢化氧化物[14]。AhpC是细菌清除自由基的一种主要成分,如果烷基过氧化氢还原酶基因功能缺陷就会导致包括形态学和细胞表面性质在内的表型改变[15]。AhpC可以催化减少过氧化氢和过氧化物,参与到冷压力或热压力反应过程中[16]。依据测序完成的基因组数据和已发现AhpC家族的其他生物学信息,腾冲嗜热厌氧菌基因tte0270被注释为ahpC的一种。我们通过使用腾冲嗜热厌氧基因组作为模板克隆ahpC并体外表达AhpC,希望使用生物信息学手段来分析AhpC在腾冲嗜热厌氧杆菌嗜热性中发挥的作用,希望为日后研究腾冲嗜热菌的嗜热机制提供重要的信息,为嗜热机制的阐明奠定良好的工作基础。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
质粒pET-28a,感受态菌E.ColiBL21 (DE3)和E.coliDH5α为本实验室保藏;腾冲嗜热厌氧杆菌MB4菌株由中国科学院微生物研究所谭华荣研究员惠赠。
1.1.2 培养基
腾冲嗜热厌氧杆菌培养基(TTE培养基)用于腾冲嗜热厌氧杆菌培养[17];2×YT培养基用于重组菌的诱导,LB培养基用于大肠杆菌DH5α、BL21(DE3)的培养。
1.1.3 主要试剂
XhoⅠ、RNase Inhibitor、BamHⅠ、DNase I、T4 DNA Ligase购自大连宝生物工程公司; IPTG、卡那霉素、FastPfu fly DNAPolymerase均购自TransGen Biotech有限公司;反转录酶Super Script Ⅲ购自Invitrogen;质粒DNA小提试剂盒、基因组DNA提取试剂盒、PCR产物纯化试剂盒购自TIANGEN公司;镍离子亲和柱购自GE公司;超纯RNA提取试剂盒购自北京康为世纪生物科技有限公司;荧光定量PCR试剂盒购自Roche公司。其他试剂购自国产分析纯。
1.2 方法
1.2.1 引物设计
参照GenBank中腾冲嗜热菌MB4(AE008691.1)ahpC在GenBank中的序列设计引物,并送金唯智科技有限公司合成。引物序列如下:ahpC-F:5′-CGCGGATCCATGGAGGAAATTAG-3′(下划线为BamHⅠ酶切位点);ahpC-R:5′-CCGCTCGAGTTTCAAAGGTTTGTGTACG-3′(下划线为XhoⅠ酶切位点)。
1.2.2 腾冲嗜热厌氧杆菌基因组DNA的提取
在TTE培养基中75 ℃培养腾冲嗜热厌氧杆菌,使用试剂盒提取嗜热菌基因组DNA。
1.2.3ahpC基因的扩增
以提取的基因组DNA为模板进行扩增。反应条件为:95 ℃预变性6 min;95 ℃变性35 s,50.7 ℃退火45 s,72 ℃延伸2 min,共35个循环。将ahpC和pET-28a双酶切,16 ℃连接,将其转化到DH5α中,提取质粒,双酶切判定,测序正确后,将其定名为pET-28a::ahpC。
1.2.4 AhpC蛋白的表达及纯化
将pET-28a::ahpC转化至感受态BL21(DE3)中,表达及纯化方法参照文献[18]。为分析AhpC蛋白表达情况,以诱导前、后的菌液作为对照进行SDS-PAGE电泳。
1.2.5 RNA提取及实时定量RT-PCR
ahpC上游引物:5′-CGACTGAAAGCCCAATGAGT-3′,下游引物5′-GCAGGAAAATGGTTTGTGCT-3′;16sRNA上游引物:5′-CGTAGGCGGTTTAGCAAGTC-3′,下游引物:5′-CTACGCATTTCACCGCTACA-3′。
分别在50 ℃、60 ℃、75 ℃和80 ℃培养厌氧杆菌。RNA提取及RT-PCR方法参照文献[17]。以16s RNA作为内参基因,采用相对定量的方法检测了50 ℃、60 ℃、75 ℃和80 ℃下腾冲嗜热菌ahpCRNA的表达量变化。反应结束后对 Ct 值采用 2-ΔΔCt法进行定量分析。分别对每个温度的 3 个生物学重复数据进行分析,使用 SPSS 软件进行 ANOVA单因素方差分析,P<0.05,表示有显著性差异。
1.2.6ahpC序列的生物信息学分析
选择腾冲嗜热厌氧杆菌(AE008691.1)、嗜冷菌单核细胞增生李斯特菌(NC_017537.1)、常温菌大肠杆菌(NC_000913.3)的ahpC基因序列,使用在线软件Prot-Param分析腾冲嗜热菌、大肠杆菌和李氏杆菌基因序列编码氨基酸序列组成及其理化性质[30];使用在线软件 ProtScale分析3种AhpC蛋白疏水性;使用在线软件 TMHMM v.2.0预测腾冲嗜热厌氧杆菌AhpC蛋白跨膜区;使用在线软件 PORTER来预测腾冲嗜热菌的AhpC蛋白二级结构;使用程序SignalP 3.0 Server分析腾冲嗜热厌氧杆菌AhpC蛋白信号肽;使用在线软件SWISS-MODEL/ SWISS-PdbView等,按照同源建模法构建出腾冲嗜热菌、大肠杆菌和李氏杆菌菌株AhpC蛋白的三级结构。
2 结果与分析
2.1 ahpC的PCR扩增结果及pET-28a::ahpC重组质粒酶切验证
经PCR扩增出的ahpC片段与已知的目的基因片段长度相符(图1),测序结果表明ahpC大小为663 bp。
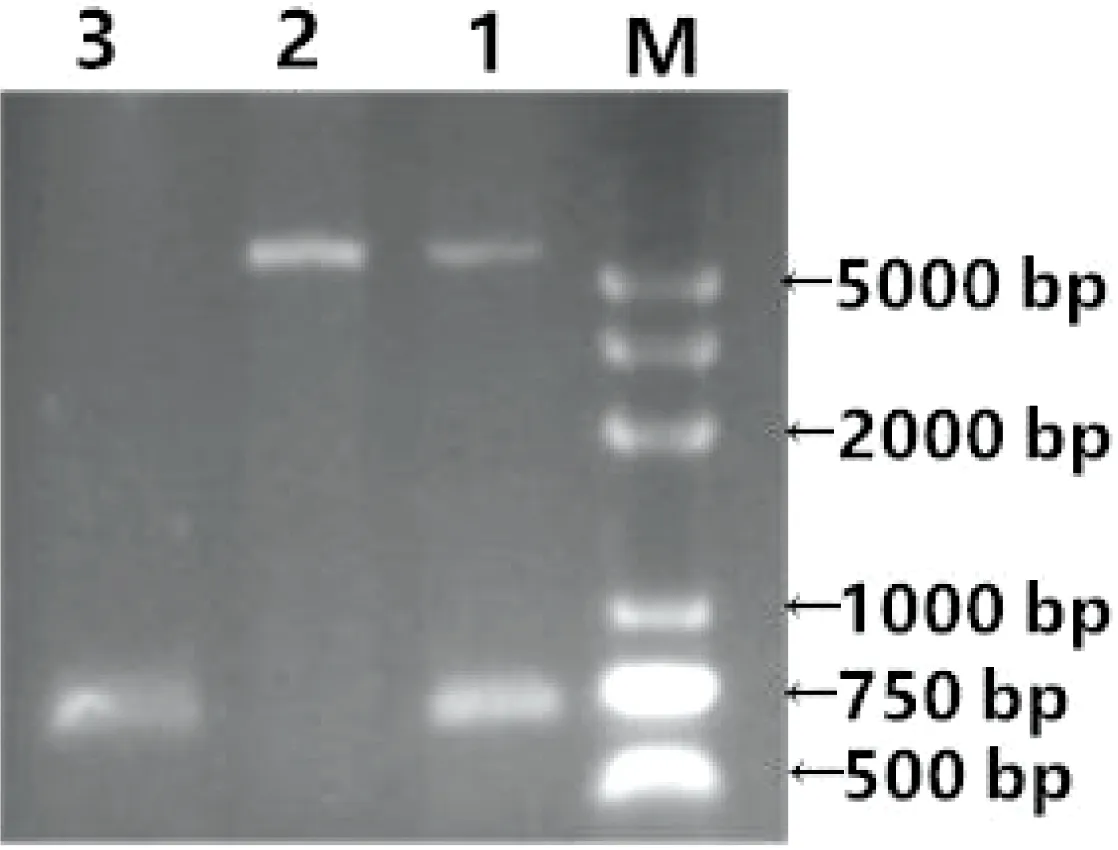
M:DNA分子质量标准DL 5000;1:pET-28a::ahpC双酶切;2:pET-28a质粒双酶切;3:ahpC基因PCR产物
M:DL 5000 DNA Marker; 1:Double endonuclease digestion product of pET-28a::ahpC; 2:Double endonuclease digestion product of pET-28a; 3:PCR products ofahpC
图1ahpC的PCR扩增产物及pET-28a::ahpC重组质粒双酶切
Figure 1 Electrophoresis of PCR products of objective gene and pET-28a::ahpCrecombinant plasmid digested
2.2 AhpC蛋白的纯化
通过SDS-PAGE 发现,诱导后菌体沉淀出现特异性条带,而诱导前菌体沉淀无特异条带,纯化后在25~35 ku之间出现单一条带,AhpC蛋白大小符合预期(图2)。
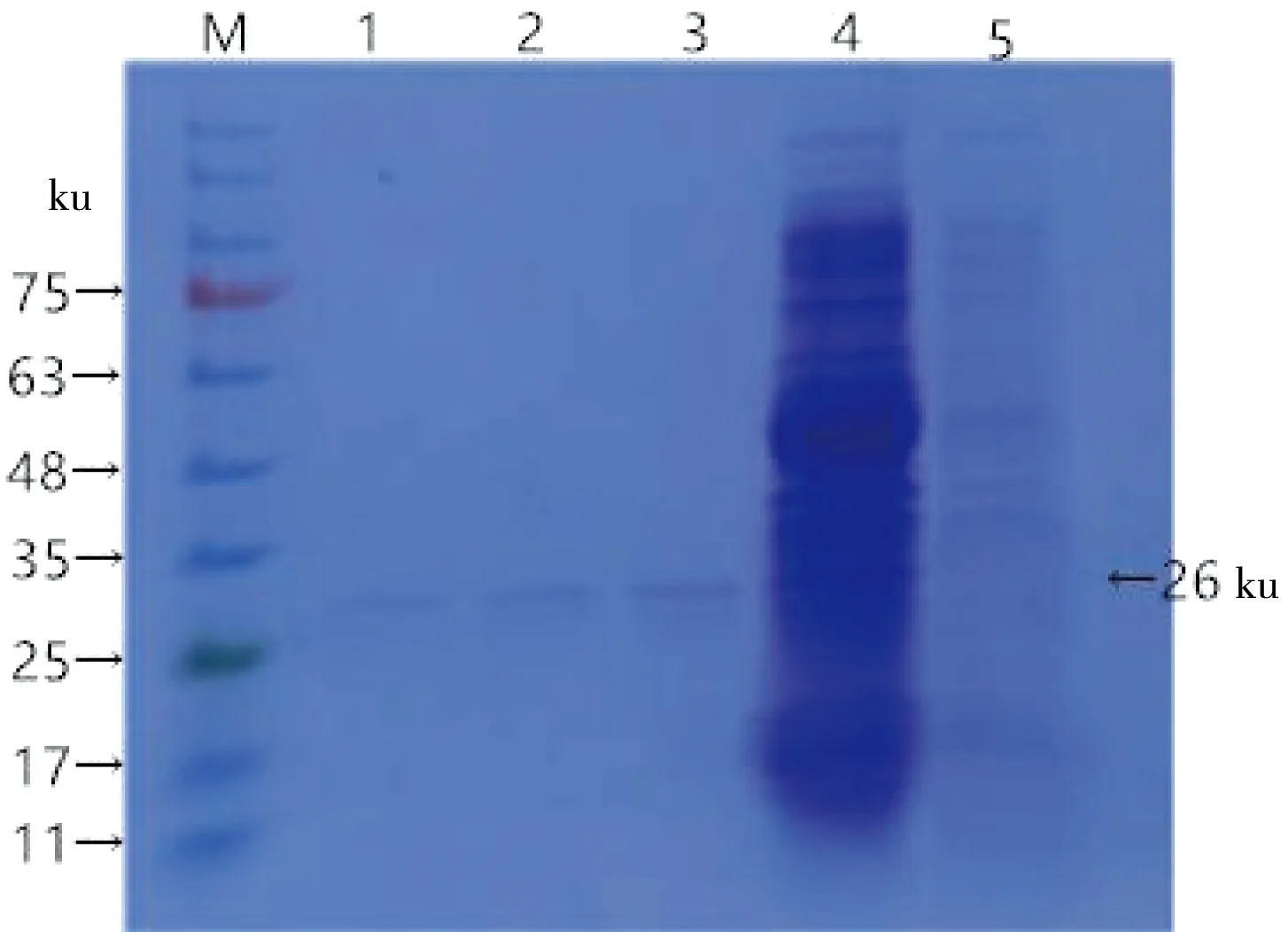
M:蛋白分子质量标准;1、2、3:纯化后的 pET28a-AhpC表达蛋白;4:诱导后的pET28a-AhpC菌液;5:未诱导的pET28a-AhpC菌液
M:Protein molecular weight Marker;1,2,3:Purification recombinant expressed protein pET-28a::ahpC;4:pET-28a::ahpCinduced with IPTG ;5:pET-28a::ahpCnot induced with IPTG
图2AhpC表达产物的SDS-PAGE
Figure 2 SDS-PAGE analysis of the AhpC expressed product
2.3 ahpC在不同温度下的转录分析
将50 ℃的表达量定义为1,结果显示:在60 ℃、75 ℃和80 ℃表达量是相对于50 ℃表达量的3.9倍、13.6倍和26.5倍(图3)。明显看出随着温度的升高ahpC表达量增高,ahpC的表达与温度呈正相关。
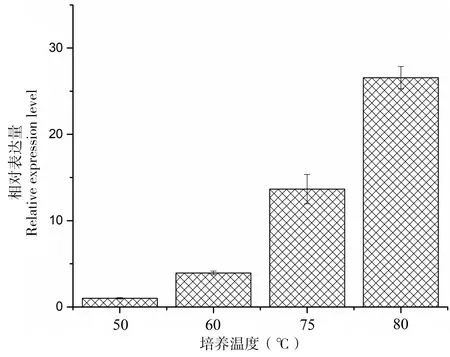
16S RNA作为内参基因,50 ℃时ahpC表达量作为1
16SrRNA was used as internal control, and the transcription at 50 ℃ was arbitrarily assigned as relative 1
图3ahpC在50℃、60℃、75℃和80℃下的转录分析
Figure 3 Relative transcriptional level ofahpCunder 50 ℃, 60 ℃, 75 ℃ and 80 ℃
2.4 腾冲嗜热菌ahpC及AhpC的生物信息学分子特征
2.4.1ahpC序列及AhpC氨基酸序列的分子特征
通过在线程序EXPASY分析得到腾冲嗜热菌ahpC基因全长663 bp,其中A碱基146个(22.0%)、T碱基243个(36.7%)、G碱基125个(18.9%)、C碱基149个(22.5%),AhpC编码220个氨基酸,AhpC分子质量约为26 ku,等电点(pI)为6.126,分子式为C1158H1795N299O323S7。通过生物信息学分析比较了ahpC在腾冲嗜热菌、大肠杆菌以及李氏杆菌所编码氨基酸的基本理化性质,结果发现:腾冲嗜热菌AhpC中脯氨酸含量比大肠杆菌高1.3%,比李氏杆菌高1.3%;腾冲嗜热菌AhpC中Arg和Lys含量分别为4.1%和8.6%,大肠杆菌为3.2%和7.5%,李氏杆菌为2.7%和4.8%;腾冲嗜热菌AhpC中Cys含量为0.5%,大肠杆菌为1.1%,李氏杆菌为2.1%。腾冲嗜热厌氧杆菌AhpC中Leu含量为7.3%,Ile为6.8%,大肠杆菌和李氏杆菌中均为7.0%和5.9%。腾冲嗜热菌AhpC中Cys含量为0.5%,大肠杆菌为1.1%,李氏杆菌为2.1%(表1)。
2.4.2ahpC编码蛋白质的疏水性分析
疏水性对蛋白三级结构的构成和稳定具有关键作用,在线程序ProtScale对AhpC的氨基酸序列进行疏水性分析,蛋白疏水性平均值为-0.272,最大值为1.700,最小值为-2.311,不稳定系数(instability index)为31.99,脂肪系数为89.00,表明为亲水蛋白。潜在疏水区分别位于16~17、34~42、45~47、49~53、69~79、81~82、95~105、111~112、124~140、142、153~160、166~167、181~184、186~188位aa。其中疏水性最强的是位于第95~105位的氨基酸。
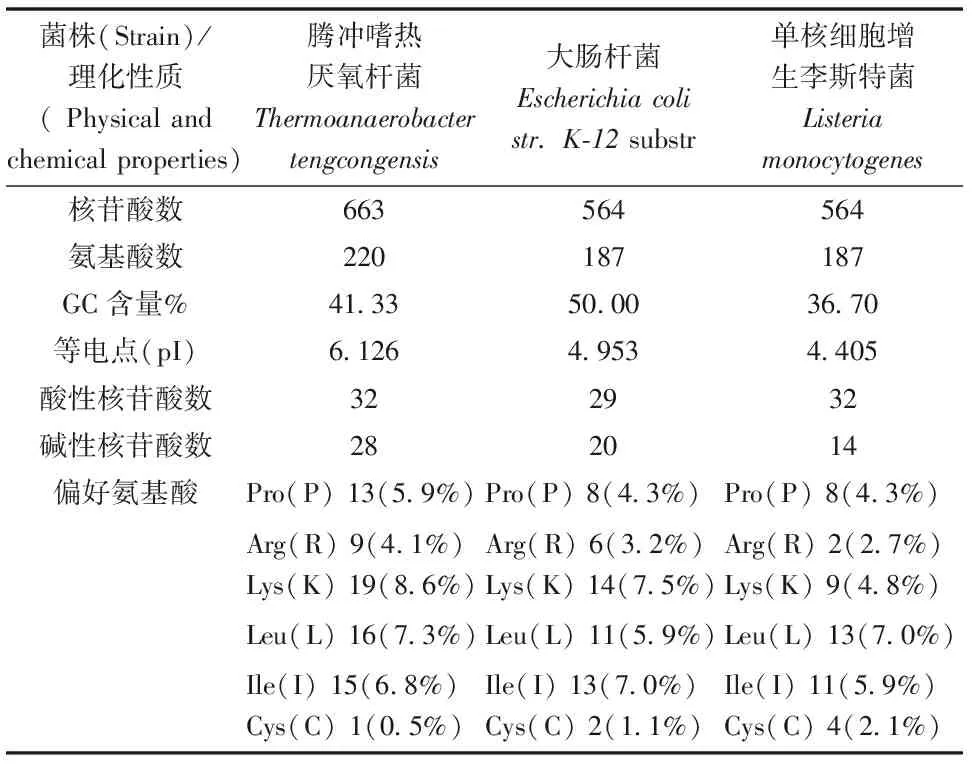
表1 ahpC在腾冲嗜热菌、大肠杆菌以及李氏杆菌所编码氨基酸的基本理化性质
2.4.3 AhpC跨膜区、信号肽位点的预测
经过预测腾冲嗜热菌的AhpC蛋白没有跨膜结构,也不存在信号肽位点。
2.4.4 AhpC蛋白二级结构和AhpC三级结构特征预测
应用Predict Protein 工具分析显示:利用在线程序PORTER软件预测AhpC的二级结构,结果如图4所示,有64个(19.1%)氨基酸残基参与形成α-螺旋,有99个(45%)氨基酸残基组成无规则卷曲结构(Random coil),有57个(25.9%)氨基酸残基参与构成β-折叠。同时对AhpC在腾冲嗜热菌、大肠杆菌、李氏杆菌中编码蛋白二级结构氨基酸残基进行比较结果如表2所示。使用在线软件 SWISS-MODEL/SWISS-PdbView 等,根据同源建模法预测出ahpC在腾冲嗜热菌、大肠杆菌以及李氏杆菌所编码蛋白的三级结构。如图5所示,腾冲嗜热菌的AhpC的三级结构比其他两种菌株更紧凑。
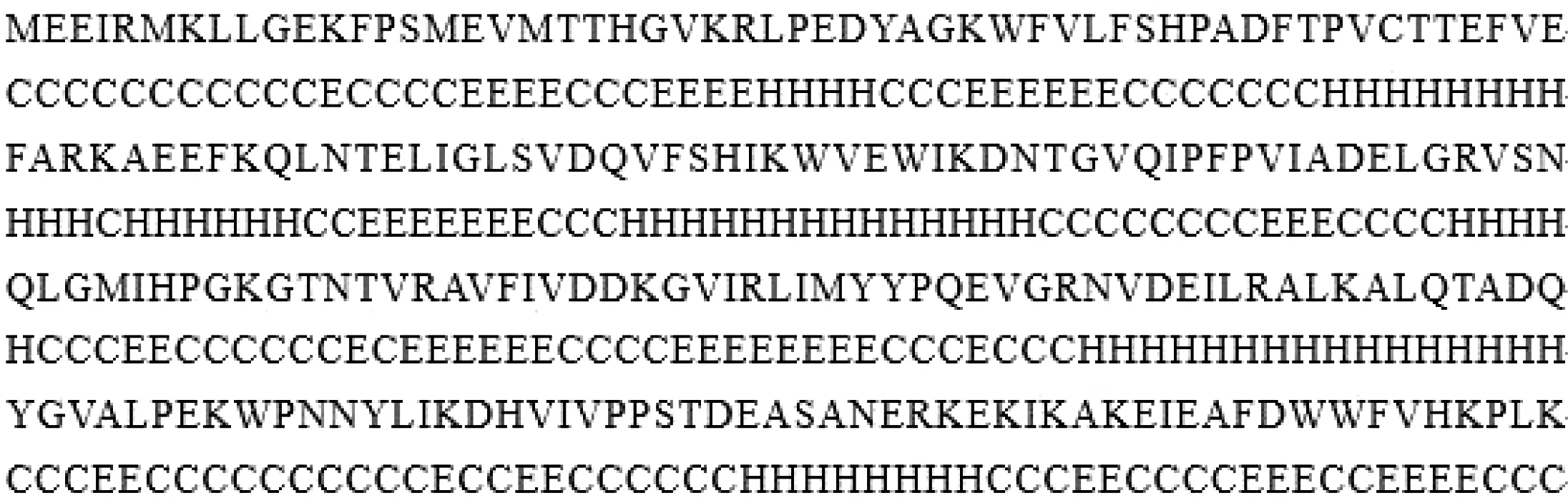
H:α-螺旋;C:无规卷曲;E:β-折叠
H:Α-helix;C:Random coil;E:β-extension
图4腾冲嗜热厌氧杆菌AhpC蛋白二级结构的预测
Figure 4 Prediction of secondary structure of AhpC ofThermoanaerobactertengcongensis
3 讨论
蛋白质的热稳定性是研究嗜热微生物嗜热机制的热点和关键。通过荧光定量PCR分析发现随着温度升高ahpCmRNA表达量显著升高,Liu等人[19]发现敲除ahpC会导致腾冲嗜热厌氧杆菌死亡,我们推测ahpC编码蛋白在腾冲嗜热厌氧杆菌嗜热过程中起到重要作用。
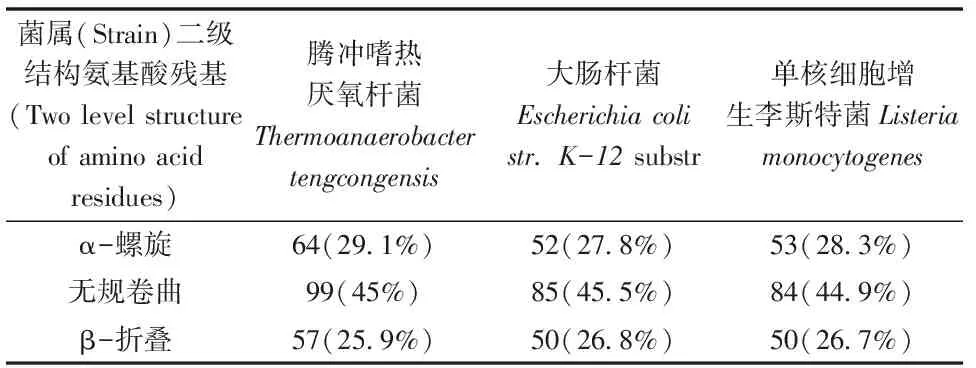
表2 ahpC在腾冲嗜热菌、大肠杆菌以及李氏杆菌所编码蛋白二级结构比较
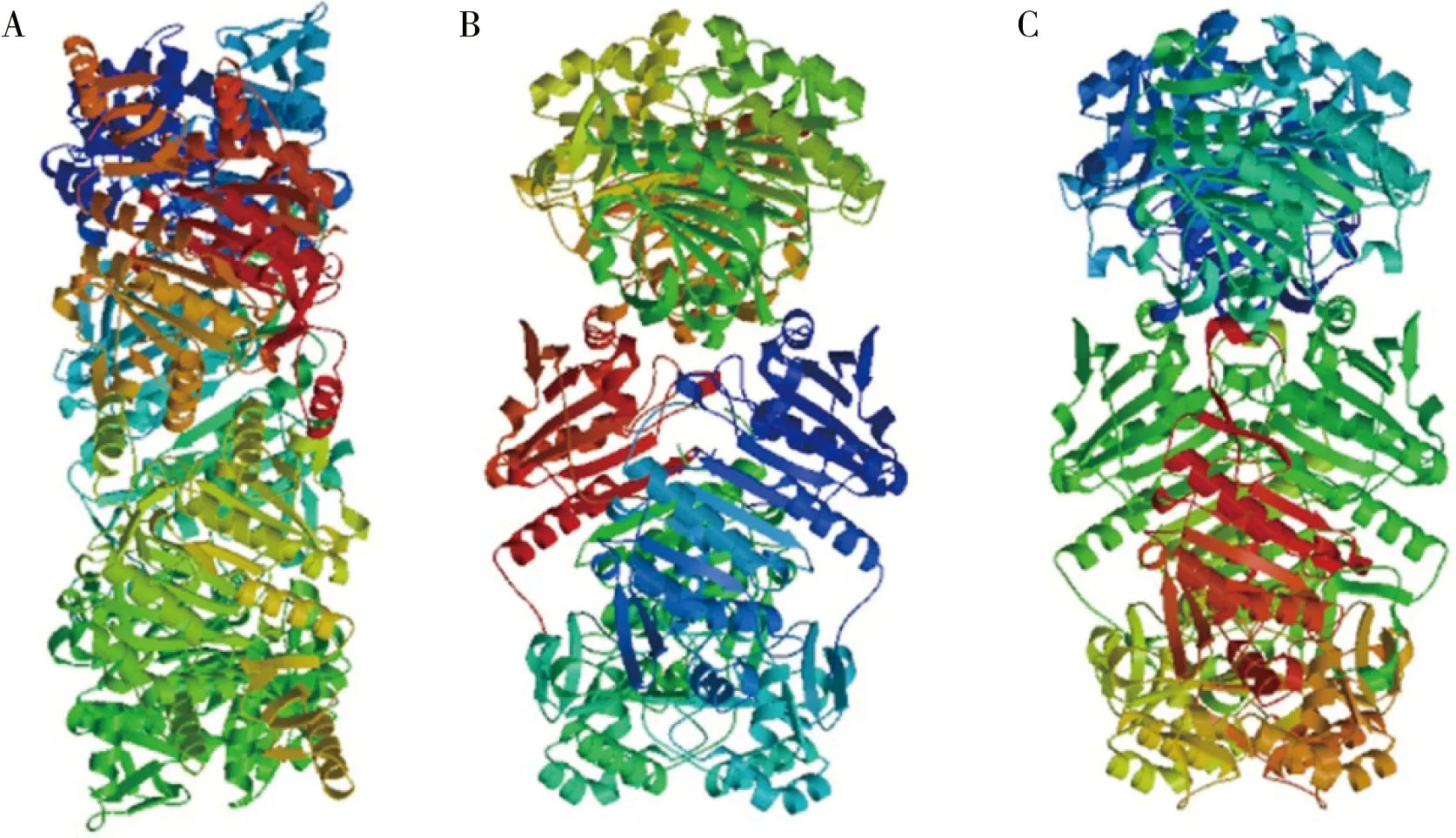
A、B和C分别代表AhpC在腾冲嗜热厌氧杆菌、大肠杆菌和单核细胞增生李斯特菌中编码蛋白三级结构预测
A, B and C were the representative of AhpC in the three level structure prediction of the coding protein ofThermoanaerobactertengcongensis,EscherichiacoliandListeriamonocytogenes
图5AhpC三级结构预测
Figure 5 Prediction of tertiary structure of AhpC
使用生物信息学分析ahpC在腾冲嗜热厌氧杆菌、大肠杆菌和李氏杆菌中编码蛋白的理化性质,发现3个菌株在CG含量、氨基酸组成、蛋白质结构方面有明显差异。蛋白质中各种氨基酸残基的含量和分布会对极端嗜热蛋白质热稳定性产生影响。研究发现氨基酸侧链对蛋白质的嗜热性质可能起决定性作用[20]。脯氨酸(Pro)具有最低的构象熵[21];半胱氨酸(Cys)在高温条件下易发生氧化作用;碱性氨基酸赖氨酸(Lys)和精氨酸(Arg)均参与离子键的形成,并且在高温条件下精氨酸所参与形成的离子键热稳定性更强[22]。将腾冲嗜热菌的AhpC与来自常温菌的大肠杆菌和来自嗜冷菌的李氏杆菌的AhpC氨基酸序列进行比较发现,腾冲嗜热菌AhpC中Pro、Arg含量高于大肠杆菌和李氏杆菌AhpC中的含量,而Lus、Cys含量比大肠杆菌和李氏杆菌低。蛋白质的疏水性在促进蛋白质热稳定性中也起到了关键作用。研究发现亮氨酸(Leu)和异亮氨酸(Ile)的侧链疏水性最强,而较大的疏水作用可以使肽链折叠成更加紧密的结构,这有利于蛋白质的热稳定性[23],而腾冲嗜热菌AhpC中Leu和Ile 含量高于在大肠杆菌和李氏杆菌AhpC中的含量。
腾冲嗜热菌AhpC不存在跨膜区域,说明该蛋白可能是非表面结构蛋白,也不存在信号肽,表明AhpC为非分泌蛋白。蛋白质的二级结构作为一级结构和三级结构之间的枢纽,是预测蛋白质三级结构的关键点,经过预测腾冲嗜热菌AhpC属于混合型蛋白[24]。较多的α-螺旋氨基酸残基的存在有利于蛋白结构的稳定[25],并且α-螺旋结构的形成会使蛋白分子表面 loop结构长度缩短,有利于提高蛋白分子的热稳定性[26],而α-螺旋在腾冲嗜热菌AhpC中含量高于大肠杆菌和李氏杆菌。对腾冲嗜热菌、大肠杆菌和李氏杆菌的三级结构预测,发现腾冲嗜热菌的AhpC蛋白三级结构明显比另外两种菌株更紧凑,这有利于蛋白质分子的稳定。
本研究发现腾冲嗜热菌ahpC表达量与温度呈正相关,并进一步利用生物信息学分析了AhpC蛋白热稳定性高于大肠杆菌和李氏杆菌的AhpC蛋白的原因。腾冲嗜热厌氧杆菌中AhpC的存在明显增强了其环境适应性。本研究为未来腾冲嗜热菌的嗜热机制的阐明提供重要的信息,为嗜热机制的研究奠定了良好的工作基础。
